红豆杉属Taxus L. 为红豆杉科(Taxaceae)植物,是裸子植物的一个属,为多年生乔木或大型灌木树种,生长缓慢仅为一般针叶树生长速度的1/10。红豆衫属包含至少14个种,在我国境内分布的红豆杉有4个种1个变种[1]。紫杉醇(taxol)是从短叶红豆杉Taxus brevifolia Nutt. 树皮中分离提取到的天然抗肿瘤物质,是迄今为止最具抗癌活性的天然化合物之一[2, 3]。现在广泛用于对肺癌、乳腺癌、卵巢癌等的治疗[4]。Strobel等[5]利用同位素14C标记的乙酸盐为底物的方法证明短叶红豆杉韧皮部合成紫杉醇的能力很强。红豆杉树皮包含许多紫杉醇合成和储存的酶,韧皮部是树皮的最重要部分,所以红豆杉植株中紫杉醇量高低主要取决于其韧皮部量的多少(厚度和长度)。对一般植物而言,树皮在植物热绝缘性、养分存储、水损失预防和害虫的保护方面起着重要作用[6],其韧皮部筛管分子的细胞形成特定运输网络,便于光合同化物和信号分子的长距离分配,作用更为重要[7]。
许多植物特别是树木,表现出2种截然不同的发育类型,初生生长和次生生长[8],形成层细胞通过平周分裂分化出次生木质部和次生韧皮部,最终形成以木质部为中心的木质部形成区和韧皮部同心环结构[9]。MYB转录因子指含有MYB结构域的一类转录因子,是目前植物中最大的一类转录因子。MYB结构域是N端由51~52个氨基酸残基采用螺旋-转角-螺旋的形式(HTH)与DNA大沟结合,一般都含有3个保守的色氨酸残基且相邻的2个色氨酸间一般相隔18或19个氨基酸,这些色氨酸起着疏水核心的作用[10, 11]。APL(altered phloem development)是编码一类具MYB卷曲螺旋结构的转录因子的基因,特异地在韧皮部表达,该转录因子编码基因突变后,拟南芥根部韧皮部的筛管和伴胞没有形成,取而代之的是木质部的细胞,异位表达APL基因可以抑制木质部细胞的分化[12, 13]。采用激活标记技术得到的杨树Populus tremula×Populus alba突变体,其表型为韧皮部增厚,同时检测到APL基因表达水平成上调趋势[14]。大面积剥皮后次生维管组织再生的最佳条件最先在杜仲上建立[15]。利用该实验系统,人们已从转录组水平、功能基因组水平和蛋白质组水平系统研究维管形成层发生和分化及韧皮部、木质部形成相关的基因,探讨木本植物的次生维管组织形成的分子机制[16, 17, 18],但中国红豆杉Taxus chinensis (Pilg.) Rehd. 的剥皮再生及其分子机制研究还未见有报道。中国红豆杉是中国特有种,有关其研究主要集中在组织培养[19]和紫杉醇合成相关酶[20]等方面。为了研究其次生维管组织形成的机制,课题组前期利用高通量测序技术(Illumina HiSeqTM 2000)对中国红豆杉的剥皮再生组织进行了转录组测序,并重点分析了参与韧皮部分化、发育调控的关键基因APL。本研究分析筛选得到了中国红豆杉APL(TcAPLs)片段序列,克隆了其中3个TcAPLs全长cDNA序列,并对其进行生物信息学和表达情况分析。研究结果以期为今后深入揭示APL基因在中国红豆杉韧皮部分化、发育过程中的作用提供依据。
1 材料与方法 1.1 植物材料和主要试剂样品由湖北省襄阳市林业科学研究所提供,由中国林业科学研究院林业研究所邱德有研究员鉴定为中国红豆杉Taxus chinensis (Pilg.) Rehd.十年生实生苗及三年生苗。
EASYpin Plus植物RNA快速提取试剂盒购于北京艾德莱生物科技有限公司,1st Strand cDNA Sythesis Kit与PrimeSTAR® Max DNA Polymerase mix均购于大连宝生物公司(TakaRa);TIANScript RT Kit购于天根生化科技有限公司;SYBR FAST qPCR Kit Master Mix(2×)Universal购于KAPA公司。
1.2 方法 1.2.1 中国红豆杉剥皮再生材料与其不同组织材料的采集在湖北襄阳于2013年6月初形成层活动旺盛期进行剥皮处理,取生长良好、干形良好、茎干均匀的中国红豆杉,按照Li等[15]的方法进行剥皮实验,稍作改动。对选取的中国红豆杉从其基部距地面约40 cm处开始一直向上环剥约25 cm,分别用无菌处理的刀片轻轻刮取暴露在外树干的材料,做好标记,迅速投入液氮中,为对照,即第0天。剥皮后将树用消毒的塑料薄膜包裹好。剥皮后第6天,选择第0天未取过样的树,揭开塑料薄膜,刮取树干上的材料做好标记立即投入液氮中,重新包裹好树干。剥皮后第12、18、24、30、36天参照第6天的方法分别取样,共处理了实验材料15株。采集三年生中国红豆杉的根、茎、叶、包含形成层的韧皮部和包含形成层的木质部的组织用于组织表达分析。
1.2.2 中国红豆杉总RNA的提取及cDNA的合成将采集的中国红豆杉的不同组织材料和不同时期剥皮再生的组织用液氮研磨之后,采用EASYpin Plus植物RNA快速提取试剂盒提取其总RNA,用30 μL无RNA酶的处理水溶解RNA。并对RNA进行浓度、完整性等质量检验后,保存于−80 ℃。然后用TIANScript RT Kit反转录试剂盒合成cDNA,用作RT-PCR和qRT-PCR分析。将中国红豆杉的树皮提取的RNA按照1st Strand cDNA Sythesis Kit说明书进行反转录合成单链cDNA,用于基因克隆。
1.2.3 TcAPLs基因的克隆根据这3个APL序列信息,分别在其开放阅读框(ORF)上、下游设计特异性引物(表 1),扩增全长cDNA序列。采用PrimeSTAR® Max DNA Polymerase mix 12.5 μL,引物0.6 μL,cDNA模板1 μL,用灭菌双蒸水补足25 μL。PCR反应条件:94 ℃预变性1 min,94 ℃变性15 s,52 ℃退火5 s,72 ℃延伸15 s,35个循环,最后72 ℃延伸7 min。将获得的PCR产物连接于pEASY-T1载体上,并利用中美泰和生物技术有限公司(北京)的ABI 3730进行测序。
| 表 1 所用引物列表 Table 1Primer sequences used |
利用ExPaSy、ProtScale、SOPMA和Swiss-model等生物信息学软件对TcAPLs的理化性质、结构域及其高级结构进行预测与分析,分析软件的网址见表 2,多序列比对使用Clustalx 1.83软件;进化树构建用MEGA 4.0软件完成,采用邻接算法(neighbor joining,NJ),bootstrap 检测设置重复为1 000次。
| 表 2 所用生物信息在线分析软件 Table 2Online analysis softwares of informatics used |
采用RT-PCR分析APL基因在正常生长的中国红豆杉根、茎、叶、包含形成层的韧皮部、包含形成层的未成熟木质部间的表达模式,以actin为内参基因,引物序列见表 1。采用Genesnap软件处理系统分析电泳图像目标条带的光密度值,计算各因子与actin的光密度比值作为半定量指标。采用qRT-PCR检测剥皮后不同时期组织中这2个基因的表达水平。荧光定量PCR反应体系:模板cDNA 1 μL,每对特异性引物均为0.4 μL( 10 μmol/L),SYBR FAST qPCR Kit Master Mix(2×)10 μL,0.4 μL ROX,用灭菌双蒸水补足20 μL,具体的操作步骤按SYBR FAST qPCR Kit Master Mix(2×)Universal说明书进行。PCR反应条件为95 ℃、30 s,(95 ℃、5 s,56 ℃、34 s)×40个循环,以灭菌双蒸水为模板作为空白对照,在ABI7500仪器(ABI,美国)上进行。目的基因相对表达水平采用2−ΔΔCt方法[21],所有反应均为2次生物学重复,3次技术性重复。
2 结果分析 2.1 基因克隆利用生物信息学分析筛查中国红豆杉的剥皮再生组织转录组数据库比对查找获得了3个TcAPLs电子序列。经NCBI的BLASTx 比对及ORF分析显示三者均具有完整的ORF,因此推测为全长基因,分别命名为TcAPL1、TcAPL2和TcAPL3。以中国红豆杉树皮总cDNA为模板,利用RT-PCR方法扩增目的条带,PCR产物经过1.0%的琼脂糖电泳之后,检测到大小分别为1 700、1 300、1 200 bp左右的条带。测序的序列结果与转录组电子序列基本一致,3个基因序列cDNA克隆的基本信息见表 3。
| 表 3 TcAPLs的cDNA序列特征 Table 3cDNA sequence identities of TcAPLs |
运用ExPaSy-Protparam工具对TcAPLs编码蛋白的理化性质进行了分析和预测,其中这3个TcAPLs基因的ORFs编码蛋白推测的氨基酸残基数为388~546 aa,预测的相对分子质量为4.320×104~6.008×104,理论等电点在5.38~6.49。从表 4可看出,3个基因之间的蛋白质理化性质基本相似,差异并不明显。蛋白质的二级结构主要TcAPLs蛋白的氨基酸主要由α-螺旋(alpha helix)、无规则卷曲(random coil)和延伸链(extended strand)和β-转角(beta turn)4种形式组成,并且这4种结构均匀分布在蛋白质中,分布情况见表 5。
| 表 4 TcAPLs蛋白序列特征 Table 4Sequence characteristics of TcAPLs protein |
| 表 5 TcAPLs蛋白的二级结构 Table 5Secondary structure of TcAPLs protein |
对推测的TcAPLs氨基酸序列进行序列比对分析,它们都具有APL基因的MYB保守结构域(图 1)。同时利用NCBI在线工具CD Search对3个TcAPLs进行保守结构域的分析,也表明该转录因子均具有保守的MYB结构域(图 2)。MYB结构域是N端由51~52个氨基酸残基采用螺旋-转角-螺旋的形式(HTH)与DNA大沟结合[10, 11]。这与Rubio等[22]报道的APL蛋白含有保守的MYB的DNA结构域相一致。
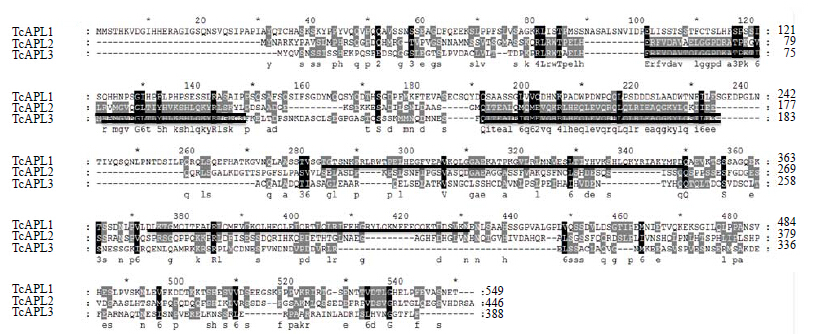 |
下划线表示MYB结构域 Underline showed MYB conserved domains 图 1 TcAPLs 蛋白多序列比对分析Fig.1 Comparison on multiple alignment of TcAPLs protein |
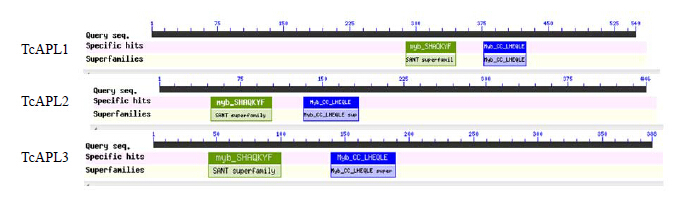 | 图 2 TcAPLs蛋白保守结构域预测分析Fig.2 Predicted conserved domains of TcAPLs protein |
由于TcAPL1的氨基酸残基数最多,且TcAPLs二级结构相似性较高,因此以TcAPL1为例,用SWISS-MODEL模拟其三维结构(图 3),三维模型中用于该模型的氨基酸残基范围为289~344位。模型以1irz.1.A蛋白为模板,序列同源性为46.00%,可以看到一个卷曲螺旋的结构(coiled-coil domain)。而此结构涉及蛋白与蛋白的相互作用[22]。
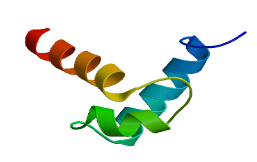 | 图 3 TcAPL1蛋白三维结构分析Fig.3 3D structure of TcAPL1 protein |
从GenBank数据库中筛选获得苹果Malus domestica Borkh、川桑Morus notabilis L.、甜橙Citrus sinensis L.、葡萄Vitis vinifera L.、烟草Nicotiana tabacum L.、拟南芥Arabidopsis thaliana L. 等不同植物来源的APL的氨基酸序列,利用MEGA 4.0软件构建了系统进化树(图 4)。结果表明,无根进化树出现大的3个独立分支:TcAPL1与川桑的APL氨基酸(EXB62671)具有很高的相似性,聚为一类,处于独立的小分支上;TcAPL2与川桑的APL(EXB64633)和马铃薯的APL(XP 001275151)聚为一类,二者处在一个大的独立分支上。TcAPL3与芸苔和香瓜等的APL处在一个大的独立分支上。而拟南芥APL则处于与上述所用APL亲缘关系都较远的一个大的独立分支上。聚类分析进一步证实了克隆的3个TcAPLs为中国红豆杉的APL基因。
 | 图 4 TcAPLs蛋白与其他植物来源的APLs系统进化树Fig.4 Phylogenetic tree of TcAPLs protein and APLs from other plants |
2.4 TcAPLs基因在不同组织中的表达分析
利用半定量RT-PCR技术对3个TcAPLs基因在中国红豆杉不同组织中的表达进行分析(图 5),Genesnap软件分析目标条带的光密度值(图 6),结果显示,3个基因在中国红豆杉的根、茎和叶片中均有表达;TcAPL1和TcAPL2 在根、茎、叶片和韧皮部(含形成层)中的表达量相当,且明显高于木质部(含形成层)的表达量,特别是TcAPL1在韧皮部(含形成层)中的表达量是木质部(含形成层)的2倍多。TcAPL3 在叶片中表达量最高,而在根和木质部(含形成层)中表达较低,其在韧皮部(含形成层)中的表达量是木质部(含形成层)中的2倍。
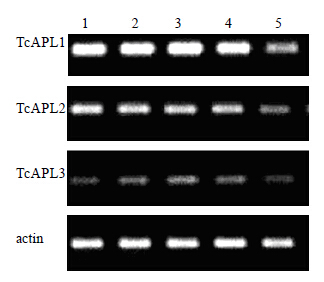 |
1-根 2-茎 3-叶 4-韧皮部(含形成层) 5-木质部(含形成层) 1-root 2-stems 3-leave 4-phloem with cambium 5-xylem with cambium 图 5 TcAPLs基因在中国红豆杉不同组织中的表达Fig.5 Expression of TcAPLs genes indifferent tissues of T. chinensis |
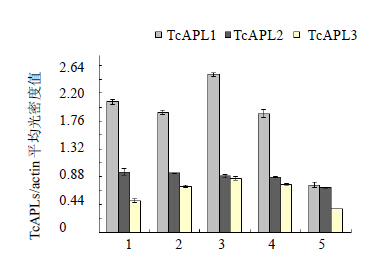 |
1-根 2-茎 3-叶 4-韧皮部(含形成层) 5-木质部(含形成层) 1-roots 2-stems 3-leaves 4-phloem with cambium 5-xylem with cambium 图 6 中国红豆杉不同组织中TcAPLs/actin平均光密度值比较Fig.6 Comparison on average OD of TcAPLs/actin in different tissues of T. chinensis |
TcAPLs基因在中国红豆杉剥皮再生过程中相对表达情况见图 7。TcAPL1表达量前30 d都处于上调表达,尤其12 d和30 d时,是对照的3倍左右,而在36 d时下调表达;TcAPL2在前期基因表达量变化不大,在18 d后有所增加,在24 d时达到最高,随后被抑制表达。而TcAPL3在中国红豆杉剥皮再生组织中一直处于下调趋势。
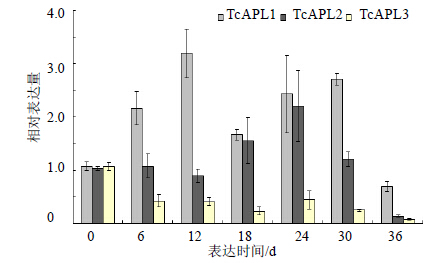 | 图 7 TcAPLs基因在中国红豆杉剥皮再生过程中的表达水平Fig.7 Expression levels of TcAPLs in regeneration after bark girdling in T. chinensis |
本研究通过RT-PCR技术成功克隆获得了3个中国红豆杉TcAPLs基因,TcAPLs是红豆杉属植物第1次获得该基因。3个基因与其他木本植物中克隆的APL基因编码的蛋白具有很高相似性,而且它们编码的氨基酸序列预测有保守的MYB的DNA结合域和一个卷曲螺旋蛋白与蛋白的二聚化位点[22],表明这3个基因均属于典型的APL基因。
在正常生长的中国红豆杉不同组织中均能检测TcAPLs基因的表达,但也具有组织特异性。TcAPL1和TcAPL2主要在根、茎、叶片和韧皮部(含形成层)中的表达;TcAPL3在根和木质部(含形成层)中表达较弱,推测其可能是由于它们氨基酸的差异,而导致各自在组织表达模式上有所不同。在拟南芥维管组织发育过程中,APL基因是第一个确定有特定的功能的基因:在不对称的韧皮部细胞分裂时,APL表达就固定在了维管组织区[12]。在杨树PtaLBD1突变体中APL基因在韧皮部的表达量最高[14]。这些与TcAPLs基因在茎中和韧皮部(含形成层)高表达是一致的。
这3个基因相比,无论是中国红豆杉正常条件下还是在剥皮再生过程中,TcAPL1的转录水平均高于TcAPL2和TcAPL3。在剥皮再生过程中,TcAPL1和TcAPL2 2个基因随着时间的延长表现出先上升后下降的趋势,但TcAPL1诱导表达上升的时间比TcAPL2要早,在剥皮再生第6天就开始表现出上升的趋势;而TcAPL3的表达则在整个组织再生过程中被抑制。TcAPL3表达情况与APL基因在杨树次生维管再生过程的韧皮部形成期(第2阶段)转录水平是增强的,直到损伤的形成层形成(第3阶段)时也保持较高得水平[18]的结果有所不同。推测此现象与红豆杉剥皮再生过程中不同的APL在具体的功能上存在差异有关,植物维管组织的发育过程中APL基因具有双重功能,可同时促进韧皮部发育和抑制木质部分化[12]。TcAPL3抑制表达也许是在促进木质部分化,而不致剥皮再生过程仅仅调控韧皮部分化而使再生的组织畸形发育,是植物损伤后自我调控的一种形式。由于APL基因的功能在拟南芥中的研究较为深入,其他物种如杨树只是根据韧皮部增厚的表型而略有涉及并没有精细研究。目前还没有与TcAPL3同源性较高的其他物种的APL有相似表现的文献报道。
本研究的3个基因尽管是都是中国红豆杉剥皮再生中重要的APL成员,它们在组织表达模式上和剥皮后组织再生表达上存在一定差异,预示其功能更为复杂。已知多个NAC基因参与拟南芥和水稻等植物的分生组织产生和器官边界的形成过程[23, 24, 25]。近年在拟南芥APL突变体中,发现NAC45基因表达量减少,暗示NAC45基因依赖于APL基因,为了验证推测,同时用pAPL(APL-GR转化APL突变体植株)检测到NAC45融合蛋白呈上调表达,预示NAC45可能是APL的直接靶基因[26],因此,对TcAPLs基因功能的深入研究,将对揭示植物维管组织特别是韧皮部发育的分子机制具有重要的意义,这也将是下一步研究的主要方向。
| [1] | 傅立国, 陈潭清, 郎楷, 等. 中国高等植物 [M]. 青岛: 青岛出版社, 2000. |
| [2] | Wani M C, Taylor H L, Wall M E, et al. Plant antitumor agents. VI. The isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia [J]. J Am Chem Soc, 1971, 93(9): 2325-2327. |
| [3] | McGuire W P. The story of taxol-Nature and politics in tepursuit of an anti-cancer drug [J]. Science, 2001, 292: 1073-1074. |
| [4] | Craag G M, Scheparat S A, Suffness M, et al. The taxol supply crisis. New NCI policies for handling the large-scale production of novel natural product anticancer and anti-HIV agents [J]. J Nat Prod, 1993, 56(10): 1657-1668. |
| [5] | Strobel G A, Stierle A, van Kuijk F J G M. Factors influencing the in vitro production of radiolabeled taxol by Pacific yew, Taxus brevifolia [J]. Plant Sci, 1992, 84: 65-74. |
| [6] | van Bel A J E. The phloem, a miracle of ingenuity [J]. Plant Cell Environ, 2003, 26(1): 125-149. |
| [7] | Lucas W J, Groover A, Lichtenberger R, et al. The plant vascular system: Evolution, development and functions [J]. J Integr Plant Biol, 2013, 55(4): 294-388. |
| [8] | Baucher M, El Jaziri M, Vandeputte O. From primary to secondary growth: Origin and development of the vascular system [J]. J Exp Bot, 2007, 58: 3485-3501. |
| [9] | Elo A, Immanen J, Nieminen K, et al. Stem cell function during plant vascular development [J]. Semin Cell Dev Biol, 2009, 20(9): 1097-1106. |
| [10] | Frampton. Myb Transcription Factors: their Role in growth, differentiation and disease [M]. Dordrecht: Kluwer Academic Publishers, Springer, 2004. |
| [11] | Jin H L, Martin C. Multifunctionality and diversity within the plant MYB-gene family [J]. Plant Mol Biol, 1999, 41(5): 577-585. |
| [12] | Bonke M, Thitamadee S, Mähönen A P, et al. APL regulates vascular tissue identity in Arabidopsis [J]. Nature, 2003, 426: 181-186. |
| [13] | Truernit E, Bauby H, Dubreucq B, et al. High-resolution whole-mount imaging of three-dimensional tissue organization and gene expression enables the study of Phloem development and structure in Arabidopsis [J]. Plant Cell, 2008, 20(6): 1494-1503. |
| [14] | Yordanova Y S, Reganb S, Busova V, et al. Members of the LATERAL ORGAN BOUNDARIES DOMAIN transcription factor family are involved in the regulation of secondary growth in Populus [J]. Plant Cell, 2010, 22: 3662-3677. |
| [15] | Li Z L, Cui K M, Yu C S, et al. Anatomical studies of regeneration after ringing of Eucomma ulmoides [J]. Acta Bot Sin, 1981, 23: 6-13. |
| [16] | Wang M J, Qi X L, Zhao S T, et al. Dynamic changes in transcripts during regeneration of the secondary vascular system in Populus tomentosa Carr, revealed by cDNA microarrays [J]. BMC Genomics, 2009, 10: 215-219. |
| [17] | Pang Y, Zhang J, Cao J, et al. Phloem transdifferentiation from immature xylem cells during bark regeneration after girdling in Eucommia ulmoides Oliv. [J]. J Exp Bot, 2008, 59(6): 1341-1351. |
| [18] | Zhang J, Gao G, Chen J J, et al. Molecular features of secondary vascular tissue regeneration after bark girdling in Populus [J]. New Phytol, 2011, 192(4): 869-884. |
| [19] | 马均, 马明东. 曼地亚红豆杉的组织培养快繁技术 [J]. 林业科学, 2007, 43(7): 30-34. |
| [20] | 阮仁余, 孔建强, 郑晓东, 等. 中国红豆杉细胞色素P450还原酶的基因克隆、表达与活性分析 [J]. 遗传, 2010, 32(11): 1187-1194. |
| [21] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-Delta Delta C(T) method [J]. Methods, 2001, 25(4): 402-408. |
| [22] | Rubio V, Linhares F, Solano R, et al. A conserved MYB transcription factor involved in phosphate starvation signaling both in vascularplants and in unicellular algae [J]. Genes Dev, 2001, 15(16): 2122-2133. |
| [23] | Souer E, vanHouwelingen A, Kloos D, et al. The no apical meristem gene of petunia is required for pattern formation in embryos and flowers and is expressed at meristem and primordia boundaries [J]. Cell, 1996, 85(2): 159-170. |
| [24] | Vroemen C W, Mordhorst A P, Albrecht C, et al. The CUP-SHAPED COTYLEDON 3 gene is required for boundary and shoot meristem formation in Arabidopsis [J]. Plant Cell, 2003, 15(7): 1563-1577. |
| [25] | Mao C, Ding W, Wu Y, et al. Overexpression of a NAC-domain protein promotes shoot branching in rice [J]. New Phytol, 2003, 176(2): 288-298. |
| [26] | Kaori M F, Shri R Y, Satu L et al. Arabidopsis NAC45/86 direct sieve element morphogenesis culminating in enucleation [J]. Science, 2014, 345(6199): 933-937. |
 2015, Vol. 46
2015, Vol. 46


