2. 解放军第三〇二医院 全军中医药研究所, 北京 100039;
3. 山东中医药大学附属医院, 山东 济南 250011;
4. 首都医科大学附属北京友谊医院, 北京 100050;
5. 解放军第三〇二医院 中西医结合肝病诊疗与研究中心, 北京 100039
2. China Military Institute of Chinese Medicine, 302 Military Hospital, Beijing 100039, China;
3. The Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250011, China;
4. Beijing Friendship Hospital of Capital Medical University, Beijing 100050, China;
5. Integrative Medicine Center for Diagnosis and Treatment of Liver Disease of Integrated Traditional Chinese and Western Medicine, 302 Military Hospital, Beijing 100039, China
何首乌为蓼科植物何首乌Polygonum multiflorum Thunb. 的干燥块根,在我国已有一千余年的应用历史。近年来国内外有关何首乌不良反应的报道有所增加,尤其是何首乌导致的肝损伤问题受到很大关注[1]。何首乌作为著名传统补益类中药,历代本草著作鲜有述及其安全性问题,大多谓其“无毒”。但在《本草汇言》中称“何首乌,味极苦涩。生用气寒,性敛有毒;制熟气温,无毒”,首次明确提出了何首乌“生用有毒,炮制减毒”的认识。何首乌应用广泛,有关何首乌导致的肝损伤问题应受到高度重视,何首乌的炮制减毒问题亦应进行深入研究。
在何首乌的临床应用中发现,服用生首乌与制首乌均可导致肝损伤的出现,并且出现肝中毒的患者,大多服用剂量在《中国药典》规定范围(生首乌3~6 g/d,制首乌6~12 g/d)之内[2, 3, 4, 5, 6, 7, 8]。前期实验结果表明在正常SD大鼠,何首乌临床等效剂量长期给药并不会导致大鼠出现肝损伤,需要在超大剂量(生药40~60 g/kg)、长期给药(4~12周)情况下才能引起大鼠肝损伤[9, 10, 11, 12]。何首乌肝毒性的发生存在显著个体差异,发生率相对较低,且往往在临床治疗剂量即可发生肝损害,故而考虑何首乌肝损害可能类似于特异质肝损害。然而炮制是否可以降低何首乌的特异质肝毒性,未见报道。因此本课题组在前期研究中采用目前应用较多的基于内毒素(脂多糖)的特异质动物模型,考察了何首乌生品(生首乌)对大鼠肝脏的损伤作用及其量-毒关系,发现生首乌在生药1.08 g/kg(相当于人6 g/d的2倍临床等效剂量)即可引起大鼠肝损害。本实验着重研究制首乌在该模型上对大鼠肝脏的损伤作用及其量-毒关系,比较生首乌与制首乌的肝毒性作用,并对炮制是否可以降低何首乌的特异质肝损害进行研究,以期为何首乌炮制减毒提供科学数据支持,为何首乌临床安全合理用药提供参考和指导。
1 材料 1.1 药品与试剂何首乌(批号13101701,经解放军第三〇二医院肖小河研究员鉴定为蓼科植物何首乌Polygonum multiflorum Thunb. 的干燥块根)、小黑豆(批号12021507)均购于北京绿野药业有限公司。二苯乙烯苷对照品(北京市药品检验所,批号130725),大黄素(批号110756-200110)、儿茶素(批号110877-201203)、没食子酸(批号110831-201204)对照品购于中国食品药品检定研究院,大黄素-8-O-β-D葡萄糖苷对照品(深圳菲斯化工有限公司,批号23313-21-5),各对照品质量分数均≥98%。分析纯甲醇(北京化工厂);双蒸水;色谱级甲醇、戊巴比妥钠、脂多糖(LPS),Sigma公司;甲醛(西陇化工股份有限公司);磷酸盐缓冲液(PBS,武汉博士德生物工程有限公司);0.9%氯化钠注射液(石家庄四药有限公司)。一次性真空采血管(奥地利格雷那公司);一次性真空采血针(天津哈娜好医材有限公司);一次性使用无菌注射器(江苏苏云医疗器材有限公司);微孔滤膜(天津市津腾实验设备有限公司)。丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)试剂盒(南京建成生物工程研究所)。
1.2 仪器酶联免疫检测仪(Synergy H1,BioTek);爱华KPJ-1A生物组织摊片烤片机(天津天利航空有限公司);Leica 2016石蜡切片机(上海莱卡仪器有限公司);Nikon E200光学显微镜;液质联用仪(Agilent Technologies 6550 iFunnelQ-TOF LC/ MS)。
1.3 实验动物健康雄性SD大鼠,SPF级,6~8周龄,体质量(180±20)g,购于中国人民解放军军事医学科学院实验动物中心,许可证号SCXK-(军)2012-0004,分笼饲养于解放军第三〇二医院实验动物中心[使用许可证号SYXK(军)2002-00500]。自由进食及饮水,实验室温度(22±2)℃,湿度60%~80%,人工光照约12 h/12 h明暗周期,并定期消毒。
2 方法 2.1 样品制备何首乌按《中国药典》2010年版[13]何首乌项下检查,符合各项规定。制首乌按《中国药典》2010年版方法自制,得率为92.3%。
基于本课题组前期实验,何首乌50%乙醇提取物毒性最强,故本实验采用生首乌与制首乌50%乙醇提取物进行研究[14]。具体方法:取适量何首乌饮片,加8倍量50%乙醇,置阴凉处密封,冷浸提取,共提取2次,每次48 h,合并提取液浓缩至相应浓度。
2.2 样品化学成分分析 2.2.1 色谱条件色谱柱Agilent 300SB-C18柱(100 mm×2.1 mm,1.8 μm);流动相为水(A)-乙腈(B),线性梯度洗脱:0~5 min,95%~68% A;5~6 min,68%~45% A;6~12 min,45%~12% A;12~15 min,12%~10% A;柱温30 ℃;体积流量0.3 mL/min;检测波长280 nm;洗脱时间为15 min;进样量1 μL。
2.2.2 混合对照品溶液的制备分别称取没食子酸、大黄素、二苯乙烯苷、儿茶素、大黄素-8-O-β-D葡萄糖苷适量于量瓶中,50%甲醇定容,配成质量浓度分别为50.9、51.3、49.2、53.1、48.8 μg/mL的混合对照品溶液。
2.2.3 供试品溶液制备取生首乌与制首乌乙醇提取液适量,用甲醇稀释10倍,过0.22 μm微孔滤膜,取续滤液,得供试品溶液,即时分析检测。
2.2.4 样品测定各供试品溶液在“2.2.1”项色谱条件下进行测定。经过对照品出峰时间和质谱特征碎片指认,共鉴定5个特征峰(图 1)。制首乌与生首乌各共有峰的峰面积比值见图 2。
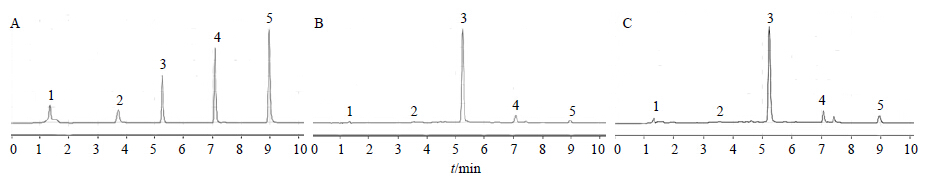 |
1-没食子酸 2-儿茶素 3-二苯乙烯苷 4-大黄素-8-O-β-D葡萄糖苷 5-大黄素,图 2同 1-gallic acid 2-catechin 3-dipheny lethylene glycosides 4-physcion-8-O-β-D-glucoside 5-emodin,figure 2 is same 图 1 混合对照品 (A)、生首乌样品 (B) 及制首乌样品 (C) 的UPLC色谱图Fig.1 UPLC of mixed reference substances (A),crude PM sample (B),and prepared PM sample (C) |
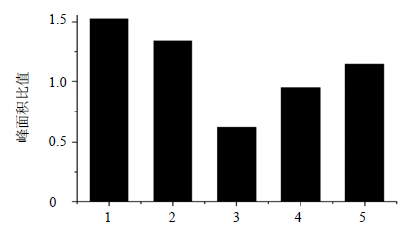 | 图 2 制首乌与生首乌样品各峰峰面积比值Fig.2 Ratio of each peak area of common peaks between crude and prepared PM |
将SD大鼠160只随机分为16组(n=10):对照组,模型组,生首乌单独给药2个剂量组,LPS联合生首乌给药2个剂量组,制首乌单独给药5个剂量组,LPS联合制首乌给药5个剂量组。生首乌给药剂量分别为生药1.08、2.16 g/kg,制首乌给药剂量分别为生药1.08、2.16、4.32、8.64、17.28 g/kg。
2.3.2 给药方式大鼠禁食不禁水12 h后,称体质量,各给药组按设定剂量ig给药,对照组和模型组给予等量蒸馏水,3 h后模型组及LPS联合何首乌给药组大鼠尾iv给予LPS(2.8 mg/kg)[15]。
2.3.3 标本采集大鼠尾iv给予LPS 7 h后,采用戊巴比妥钠(60 mg/kg)溶液ip麻醉,下腔静脉取血,3 500 r/min离心10 min,取血浆,并采集肝脏标本[15]。
2.3.4 血浆指标检测和肝组织病理学检查肝功能指标检测:血浆ALT、AST检测,按试剂盒说明书进行操作。肝脏病理学检查:取大鼠肝组织,10%甲醛固定,常规病理切片,HE染色,光镜下观察。
2.4 统计学分析数据均以x±s表示,采用SPSS 17.0软件进行统计分析,计量资料采用单因素方差分析(ANOVA)。
3 结果 3.1 动物一般情况观察大鼠给予何首乌醇提物后,1~2 h内均出现轻微腹泻现象,尿液颜色加深,精神状态良好,活动未出现明显减少;尾iv LPS后,1~2 h内均出现排便增多现象,LPS联合生首乌组重于LPS联合制首乌组;LPS联合生首乌组大鼠大便稀溏、臭味重,精神状态差,出现怠动、无力等中毒症状,随剂量加大,症状加重;LPS联合制首乌组,给药剂量在1.08、2.16、4.32 g/kg时排便量略有增加,大便质地改变不明显,尿液颜色加深,呈浓茶色,精神状态尚好,给药剂量在8.64、17.28 g/kg时排便多且大便稀溏,尿液色重、味臭,大鼠精神萎靡、乏力怠动。
3.2 对大鼠血浆ALT和AST的影响在内毒素特异质肝损伤模型中,单独尾iv无毒剂量的LPS对大鼠ALT、AST无显著影响(P>0.05);与对照组比较,单次ig给予1.08、2.16 g/kg生首乌50%乙醇提取物后大鼠血浆ALT、AST无显著变化(P>0.05);而相同剂量的生首乌联合LPS给药后,1.08、2.16 g/kg剂量组大鼠血浆ALT、AST显著升高(P<0.05);与对照组比较,单次ig给予1.08、2.16、4.32、8.64、17.28 g/kg制首乌50%乙醇提取物后大鼠血浆ALT、AST均无显著变化(P>0.05);而相同剂量制首乌联合LPS给药后,1.08、2.16、4.32 g/kg剂量组ALT、AST无显著变化(P>0.05);8.64、17.28 g/kg剂量组大鼠血浆ALT、AST显著升高(P<0.05)。结果见图 3。
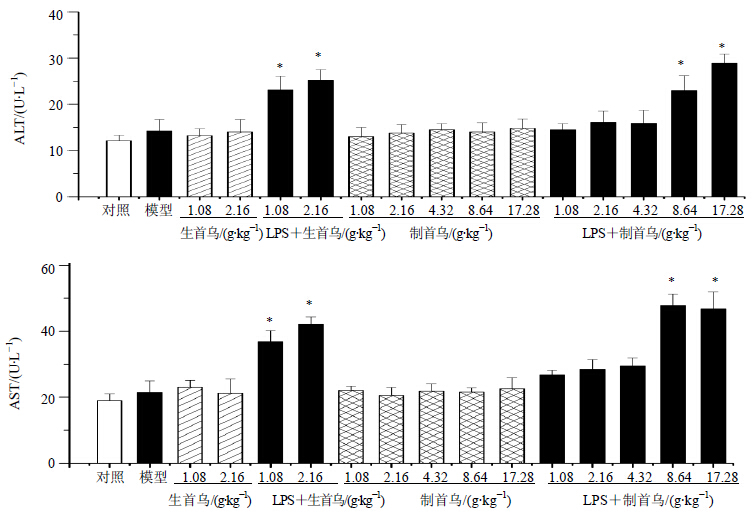 |
与对照组比较:*P<0.05 *P < 0.05 vs control group 图 3 生首乌与制首乌提取物对内毒素特异质肝损伤模型大鼠血浆ALT和AST的影响 (x±s,n=6)Fig.3 Effects of extract from crude and prepared PM at different concentration on ALT and AST in plasma of rats with liver injury (x±s,n=6) |
在内毒素特异质肝损伤模型中,单独尾iv无毒剂量的LPS后,大鼠肝脏切片可见汇管区炎症细胞增多,未见肝细胞有明显病理学改变;单次给予1.08、2.16 g/kg生首乌50%乙醇提取物,大鼠肝脏切片未见明显病理学改变;而相同剂量的生首乌联合LPS给药后,肝脏切片可见中央静脉扩张,汇管区有大量炎症细胞浸润。单次给予1.08、2.16、4.32、8.64、17.28 g/kg制首乌50%乙醇提取物,大鼠肝脏切片亦未见明显病理学改变;而相同剂量制首乌联合LPS给药后,1.08、2.16、4.32 g/kg剂量组大鼠肝脏切片未见明显病理学改变,8.64、17.28 g/kg剂量组大鼠肝脏切片可见中央静脉扩张、内膜脱落,汇管区有大量炎症细胞浸润。结果见图 4和5。
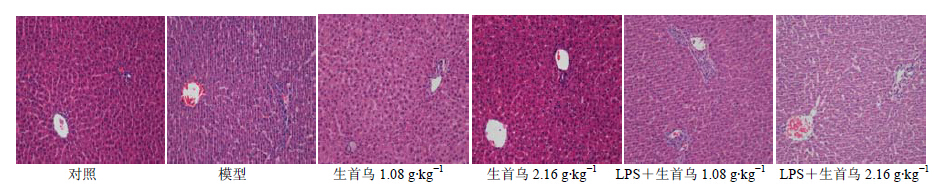 | 图 4 生首乌对正常及模型大鼠肝组织病理形态的影响Fig.4 Effects of crude PM on pathomorphology of liver issue in normal and model rats |
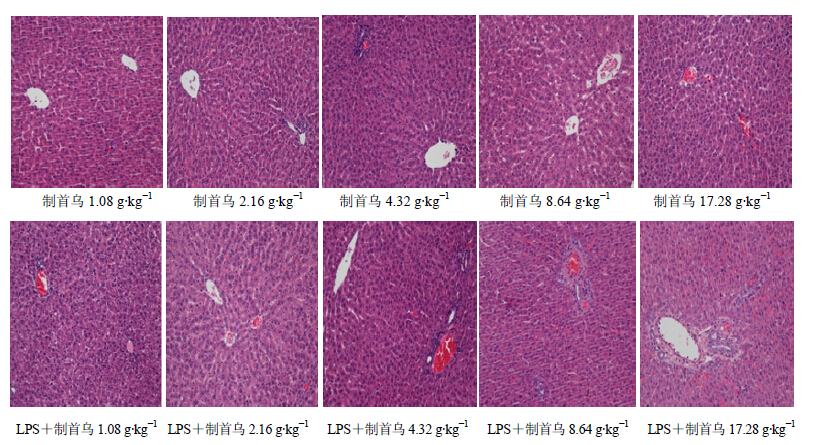 | 图 5 制首乌对正常及模型大鼠肝组织病理形态的影响Fig.5 Effects of prepared PM on pathomorphology of liver issue in normal and model rats |
《中国药典》2010年版收载何首乌及其炮制加工品制首乌,二者功能与主治有所不同,何首乌具有解毒、消痈、润肠通便的功效,而制首乌则主要用于补肝肾、益精血、乌须发、强筋骨。药典规定剂量:生首乌3~6 g/d,制首乌6~12 g/d。尽管历代本草著作鲜有述及何首乌的安全性问题,但从何首乌临床多制用以及使用禁忌、注意事项等记载也都提示何首乌的安全隐患。“生用气寒、性敛、有毒;制熟气温无毒”(《本草汇言》),“大抵生用则流利,制用则固补”(《本草便读》),临床通过使用制首乌来避免或降低生首乌可能导致的毒性损伤,但现在都是在超大剂量下对正常动物的毒性研究资料,与临床剂量相差较大,对了解和阐释何首乌的特异质肝毒性还不够[16, 17, 18, 19, 20]。
鉴于服用何首乌人群巨大,虽然何首乌肝损害病例报道较多,但其发生率相对较低,并且其在正常动物安全性评价表现出的肝毒性不强的特点,因而考虑何首乌可能为特异质肝毒性[21, 22]。特异质肝毒性评价一直是国内外毒理学研究的难点和热点[9, 20]。近年来研究表明,采用内毒素(如LPS)免疫敏化的动物模型评价药物特异质肝毒性与临床实际情况较为近似。本课题组前期采用该模型对生首乌的肝毒性作用进行评价[23],结果较为显著;并考察了常用无肝毒性中药甘草(生药2.16 g/kg)在LPS模型上的反应,未见肝损伤现象,说明LPS对何首乌肝毒性的增强作用不是普遍现象,具有选择性,可用于何首乌特异质肝毒性评价。
本实验基于内毒素特异质肝损伤模型,对低剂量生首乌肝毒性作用进行验证,并对一定剂量范围(从临床等效剂量到16倍临床等效剂量)制首乌肝毒性作用进行评价。研究证实生首乌在1.08 g/kg剂量(相当于人6 g/d的2倍临床等效剂量)即可引起大鼠肝功能损害和组织病理学改变。结果显示制首乌需达到8.64 g/kg(相当于人12 g/d的8倍临床等效剂量)才可对大鼠造成肝损伤。本实验首次对何首乌生品与炮制品的肝毒性作用联合进行研究,何首乌经过炮制后,每日最大安全用量从1.08 g/kg提高到8.64 g/kg,证明何首乌通过炮制可以达到减毒的目的,为何首乌的炮制减毒提供科学数据支持。传统中药化学成分和药理活性复杂,给药剂量、炮制方式、提取方法等均会对其产生影响[24]。通过化学分析,炮制后的何首乌二苯乙烯苷的量均较生品降低,故推断何首乌毒性与二苯乙烯苷相关。同时前期已有研究推测二苯乙烯苷和大黄素可能为何首乌肝毒性产生的原因[25],这与本实验结论相似。由于本研究仅对《中国药典》2010年版方法制首乌与生首乌毒性作用进行比较,其他炮制方法制首乌的毒性作用有待进一步研究。
| [1] | 鄢春良, 赵军宁, 邱雄. 何首乌安全性问题研究进展 [J]. 中药药理与临床, 2009, 25(3): 77-81. |
| [2] | Panis B, Wong D R, Hooymans P M, et al. Recurrent toxic hepatitis in a Caucasian girl related to the use of Shou Wu Pian, a Chinese herbal preparation [J]. J Pediatr Gastroenterol Nutr, 2005, 41(2): 256-258. |
| [3] | Jung K A, Min H J, Yoo S S, et al. Drug-induced liver injury: Twenty five cases of acute hepatitis following ingestion of Polygonum multiflorum Thunb. [J]. Gut Liver, 2011, 5(4): 493-499. |
| [4] | But P P, Tomlinson B, Lee K L. Hepatitis related to the Chinese medicine Shou-wu-pian manufactured from Polygonum multiflorum [J]. Vet Hum Toxicol, 1996, 38(4): 280-282. |
| [5] | Park G J, Mann S P, Ngu M C. Acute hepatitis induced by ShouWu-Pian, a herbal product derived from Polygonum multiflorum [J]. J Gastroenterol Hepatol, 2001, 16(1): 115-117. |
| [6] | Mazzanti G, Battinelli L, Daniele C, et al. New case of acute hepatitis following the consumption of Shou Wu Pian, a Chinese herbal product derived from Polygonum multiflorum [J]. Ann Int Med, 2004, 140(7): W30. |
| [7] | Cárdenas A, Restrepo J C, Sierra F, et al. Acute hepatitis due to shen-min: a herbal product derived from Polygonum multiflorum [J]. J Clin Gastroenterol, 2006, 40(7): 629-632. |
| [8] | 张栩, 丁向春, 杨岩, 等. 口服何首乌致肝脏损害6例报告 [J]. 宁夏医学院学报, 2000, 22(2): 115-116. |
| [9] | 李奇, 赵奎君, 赵艳玲, 等. 大剂量何首乌醇提物致大鼠多脏器损伤研究 [J]. 环球中医药, 2013, 6(1): 1-7. |
| [10] | 胡锡琴, 耿增岩, 李巧兰, 等. 制何首乌不同剂量与大鼠肝损伤程度的实验研究 [J]. 陕西中医, 2007, 28(10): 1420-1421. |
| [11] | 张思玉, 朱晓光, 张广平, 等. 制首乌提取液毒理学研究 [J]. 毒理学杂志, 2013, 274(4): 261-264. |
| [12] | Chang Q, Zhao H J, Li C, et al. Effects of Radix Polygoni Multiflori Preparata and quantitative exercise on rat liver microcirculation and liver function [J]. Chin J Pharmacovigil, 2014, 11(4): 193-197. |
| [13] | 中国药典 [S]. 一部. 2010. |
| [14] | 吕旸, 王伽伯, 嵇扬, 等. 提取溶剂对何首乌肝细胞毒性的影响 [J]. 实验方剂学杂志, 2012, 19(20): 268-272. |
| [15] | Steven B Y, Umesh M H, Bryan L C, et al. Endothelial cell injury and coagulation system activation during synergistic hepatotoxicity from monocrotaline and bacterial lipopolysaccharide coexposure [J]. Toxicol Sci, 2003, 74(1): 203-214. |
| [16] | Wang J B, Zhao H P, Zhao Y L, et al. Hepatotoxicity or hepatoprotection Pattern recognition for the paradoxical effect of the Chinese herb Rheum palmatum L. in treating rat liver injury [J]. PLoS One, 2011, 6(9): e24498. |
| [17] | Wang J, Zhao Y, Xiao X, et al. Assessment of the renal protection and hepatotoxicity of rhubarb extract in rats [J]. J Ethnopharmacol, 2009, 124(1): 18-25. |
| [18] | Qin Y, Wang J B, Kong W J, et al. The diarrhoeogenic and antidiarrhoeal bidirectional effects of rhubarb and its potential mechanism [J]. J Ethnopharmacol, 2011, 133(3): 1096-1102. |
| [19] | 庞晶瑶, 王伽伯, 马致洁, 等. 基于化学指纹图谱和生物毒性检测的何首乌质量评控 [J]. 中草药, 2014, 45(23): 3392-3396. |
| [20] | 涂灿, 蒋冰倩, 赵艳玲, 等. 何首乌炮制前后对大鼠肝脏的损伤比较及敏感指标筛选 [J]. 中国中药杂志, 2015, 40(4): 654-660. |
| [21] | Victor J N, John R S. Drug-related hepatotoxicity [J]. New Engl J Med, 2006, 354(7): 731-739. |
| [22] | William M L. Drug-induced hepatotoxicity [J]. New Engl J Med, 2003, 349(5): 474-485. |
| [23] | 李春雨, 李晓菲, 涂灿, 等. 基于内毒素模型的何首乌特异质肝损伤评价 [J]. 药学学报, 2015, 50(1): 28-33. |
| [24] | 李卫先, 张琦, 王国仁, 等. 不同炮制品种制何首乌致肝损害的研究 [J]. 光明中医, 2012, 27(3): 595-597. |
| [25] | Wu X Q, Chen X Z, Huang Q C, et al. Toxicity of raw and processed roots of Polygonum multiflorum [J]. Fitoterapia, 2012, 83(3): 469-475. |
 2015, Vol. 46
2015, Vol. 46


