黄酮类化合物广泛分布于自然界的植物中,多存在于被子植物中,在低等植物中亦有少量分布。20世纪80年代,Bandyukova等[1]首次对天然碳苷黄酮的光谱、色谱特征,以及化合物结构进行了系统综述,涉及300种不同科属植物。随着黄酮类化合物的深入研究和开发,迄今,从自然界中已经分离出400多个碳苷黄酮类化合物。
碳苷黄酮具有广泛的药理活性,包括抗氧化[2]、保护心血管系统[3]、降血糖[4]、保肝[5]、兴奋子宫平滑肌[6]、治疗甲状腺疾病[7]、杀虫[8]、抗病毒[9]、抗辐射[10]等作用。研究表明,多种黄酮类化合物对心肌缺血损伤具有保护作用。本文就现有分离鉴定的碳苷黄酮及其抗心肌缺血损伤作用机制的研究进展进行归纳性总结,为更好地开展黄酮碳苷在保护心肌缺血方面的相关研究工作提供文献资料。 1 碳苷黄酮的结构特征
碳苷是结构较为特殊的一类苷类化合物,碳苷黄酮是碳苷类化合物中为数最多的一类。碳苷黄酮(C-glycosylflavones)是指糖与黄酮母核通过C-C键连接的一类黄酮苷。根据黄酮母核结构不同,碳苷黄酮可分为黄酮、黄酮醇、二氢黄酮、二氢黄酮醇、异黄酮、二氢查耳酮、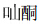 、黄烷-3-醇等。碳苷黄 酮以芹菜素和木犀草素为苷元的最多。所连接的糖苷大多与黄酮母核A环的C-6或C-8位相连,糖基主要包括葡萄糖、鼠李糖、木糖、阿拉伯糖等。部分碳苷黄酮中含有2个糖,连接在不同的碳位,或者2个糖以不同的顺序相连。部分碳苷黄酮中有乙酰基、羟基苯甲酰基、芥子酰基、香豆酰基等取代。碳苷黄酮具有溶解度小,难于酸水解的共同特点。
、黄烷-3-醇等。碳苷黄 酮以芹菜素和木犀草素为苷元的最多。所连接的糖苷大多与黄酮母核A环的C-6或C-8位相连,糖基主要包括葡萄糖、鼠李糖、木糖、阿拉伯糖等。部分碳苷黄酮中含有2个糖,连接在不同的碳位,或者2个糖以不同的顺序相连。部分碳苷黄酮中有乙酰基、羟基苯甲酰基、芥子酰基、香豆酰基等取代。碳苷黄酮具有溶解度小,难于酸水解的共同特点。
近年来,随着分离纯化技术的提高,碳苷黄酮的研究有了更深入的进展。以芹菜素为苷元的碳苷黄酮,尤以牡荆苷和异牡荆苷为母核的碳苷黄酮居多,见表 1。其次为以木犀草素为苷元的碳苷黄酮,尤以荭草素和异荭草素为母核代表,见表 2。其他碳苷黄酮也在各科属植物中有所报道(表 3)。黄酮醇、二氢黄酮、二氢黄酮醇、异黄酮、二氢查耳酮、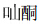 、黄烷-3-醇等报道相对较少(表 4)。
、黄烷-3-醇等报道相对较少(表 4)。
| 表 1 近10年来分离和鉴定的以芹菜素为苷元的碳苷黄酮 Table 1 C-glycosylflavones with apigenin as aglucon isolated and identified in recent decade |
| 表 2 近10年来分离和鉴定的以木犀草素为苷元的碳苷黄酮 Table 2 C-glycosylflavones with luteolin as aglucon isolated and identified in recent decade |
| 表 3 近10年来分离和鉴定的其他母核碳苷黄酮 Table 3 C-glycosylflavones with other nucleus isolated and identified in recent decade |
| 表 4 近10年来分离和鉴定的其他类碳苷黄酮 Table 4 Other C-glycosyl flavonoids isolated and identified in recent decade |
黄酮结构中的酚羟基一方面可通过供氢与其他自由基结合形成稳定的苯氧自由基,终止自由基的链式反应,另一方面活泼的酚羟基易被氧化形成醌。因此,一般认为黄酮虽具有较强的抗氧化活性,但稳定性较差,生物利用度较低,不利于其开发利用。不同于氧苷黄酮的易酸水解或专一性酶水解,碳苷黄酮在一般条件下是不能被水解的,在酸性环境中有较好的稳定性[78],而人体肠液、胃液正好提供了良好的酸环境,避免了首关消除的严重影响。碳苷黄酮上的糖不能通过酸水解除去,但在强酸条件下会发生Wessely-Moser重排,如牡荆苷可产生同分异构体异牡荆苷,或发生糖环异构化,如C-阿拉伯吡喃糖苷异构化为C-阿拉伯吡喃糖苷和呋喃糖苷的混合物[79]。由于碳苷黄酮的相对酸稳定性,为开发利用碳苷黄酮类成分提供了可能。 3 碳苷黄酮保护心肌缺血的药理作用
心肌缺血/再灌注损伤是心肌缺血后,冠状动脉再通,恢复心肌灌注后引起的心肌一系列损伤性反应,广泛见于临床,是造成临床溶栓治疗、冠状动脉搭桥术和心脏移植失败的重要原因。近年来,碳苷黄酮提取物和单体物质对心肌缺血损伤保护作用的研究陆续展开,作用机制正逐步被揭示。
研究表明,竹叶提取物[80]通过提高模型组大鼠心室内压最大上升和下降速率,降低左室末期舒张期压力,提高心输出量,同时降低模型组肌酸磷酸激酶(CPK)及乳酸脱氢酶(LDH)的活性,增加超氧化物歧化酶(SOD)的活性,通过电压依赖性钙通道及受体依赖性钙通道降低钙的量,减少丙二醛(MDA)的量,从而对心肌缺血/再灌注(缺氧复氧)损伤起保护作用。淡竹叶黄酮可抑制大鼠心肌中LDH及肌酸激酶(CK)的漏出,降低血清和心肌组织中LDH与CK活性,降低MDA水平,提高SOD、谷胱甘肽过氧化物酶(GSH-Px)和NO浓度,可抑制核因子-κB(NF-κB)和肿瘤坏死因子- α(TNF-α)蛋白的表达,下调caspase-3蛋白表达,对心肌缺血/再灌注损伤有一定的保护作用,其作用机制可能与抗自由基、抑制炎症反应和减少细胞凋 亡有关[81]。淡竹叶总黄酮提取物中已知的碳苷黄酮包括牡荆苷、异牡荆苷、荭草苷、异荭草苷、当药黄素、日当药黄素等[82]。有研究结果显示,牡荆苷保护心肌缺血及缺血/再灌注损伤的作用机制涉及抗氧化、抑制炎症细胞因子释放和细胞凋亡,与抑制NF-κB p65核移位和细胞内钙超载以及激活细胞外调节蛋白激酶(ERK)1/2有关[83]。荭草苷可抑制细胞内钙的释放和外钙的内流,具有舒张血管的作用;可显著提高缺氧/复氧损伤心肌细胞内SOD及线粒体脱氢酶的活性,并能显著抑制LDH的活性、MDA的生成以及细胞内钙浓度,具有抗氧自由基的作用;可显著降低bax、caspase-3、细胞色素C(cytochrome C)蛋白在缺血/再灌组织中的表达,提高bcl-2的表达,其抗缺血/再灌和缺氧/复氧引起的心肌细胞凋亡,是通过阻止线粒体细胞凋亡途径的激活而实现的[3]。芒果苷能有效降低血清中心肌酶谱的表达,发挥其抗炎、抗氧化作用,减轻心肌细胞超微结构的损伤,可促进bcl-2基因转录和蛋白表达水平,降低caspase-3的基因转录和蛋白表达水平,从而抑制心肌缺血/再灌注损伤中细胞 凋亡的发生,降低损伤大鼠心肌间质胶原纤维化,减轻心室重构,改善心肌顺应性,保护心脏收缩舒张功能,达到保护心肌缺血/再灌注损伤的作用[84]。 4 碳苷黄酮保护心肌缺血的可能作用机制
目前,已知的碳苷黄酮保护心肌缺血/再灌注损伤的可能作用机制主要通过改善细胞内钙离子超载、抑制呼吸氧爆发、抑制细胞凋亡和炎症反应等实现的。 4.1 降低细胞内钙离子浓度
细胞内钙增多主要是由再灌注时钠平衡障碍、细胞膜通透性增高和线粒体受损引起的[85]。付晓春[3]采用大鼠原代心肌细胞缺氧/复氧损伤模型,发现竹叶提取物对KCl和去甲肾上腺素(NE)引起的细胞内钙升高有抑制作用,对电压依赖性钙通道和受体操控性钙通道均有阻断作用,是其抗心肌缺血损伤的作用机制之一。 4.2 抑制氧自由基生成
心肌组织是机体中对血氧供应十分敏感的组织,缺血、缺氧是产生自由基的重要条件。心脏手术、体外循环术和急性心肌缺血等过程中,缺血导致大量氧自由基生成,而再灌注则进一步催化了自由基的大量形成,活性氧自由基(ROS)清除不足,导致其在体内增多并引起细胞氧化损伤[85]。研究发现,玉米须正丁醇提取物具有较强的抗氧化能力,而其成分以碳苷黄酮为主[41]。红花芒毛苣苔黄酮提取物可有效清除自由基和还原Fe3+,具有抗氧化活性,其成分中包含了槲皮素-6-C-葡萄糖苷、5,7,3′,4′-四羟基-6-C-葡萄糖二氢黄酮苷、二氢槲皮素-6-C-葡萄糖苷等多种碳苷黄酮[61]。 4.3 抑制细胞凋亡
细胞凋亡与心肌缺血/再灌注损伤密切相关,细胞凋亡的多少决定了心功能损害的程度[86]。Caspase家族是细胞凋亡起关键作用的一组半胱氨酸蛋白酶,caspase-3在凋亡级联反应中处于核心地位[87],在死亡受体介导的细胞凋亡过程中起重要作用。董六一[88]通过荧光染料和流式细胞仪检测缺氧/复氧损伤模型的心肌细胞凋亡发现,与对照组相比,模型组心肌细胞凋亡率显著升高,而缺氧预处理组及牡荆素预处理组心肌细胞凋亡率明显低于模型组,提示牡荆素预处理产生的心肌细胞保护作用可能与降低心肌细胞再灌注损伤时心肌细胞凋亡有关。 4.4 抑制炎症反应
炎症反应在心肌缺血的发病中起着重要作用[89]。TNF-α是一种重要的具有多种生物学效应的促炎症细胞因子,参与多种心血管疾病的发生,在缺血/再灌注病理过程中主要由单核吞噬细胞受刺激后反应性分泌。研究表明心肌缺血/再灌注导致的心肌损伤主要是由TNF-α引起的[90]。NF-κB是一种具有多向性转录调节作用的序列特异性DNA结合蛋白,胞内外刺激信号激活NF-κB,启动相关因子与受体的基因表达,引起细胞核组织损伤[91,92,93,94]。在心肌缺血/再灌注过程中产生大量的各种活性氧以及炎症介质能导致NF-κB的激活,引起TNF-α的产生,形成正反馈反应,加重心肌细胞凋亡损伤。荭草素-2″-O-β-D-半乳糖苷可抑制小胶质细胞炎症反应,其抗炎作用可能与其抑制核因子-κB抑制蛋白α(IκB-α)磷酸化降解并抑制NF-κB p65亚基的核转位相关[95]。 5 碳苷黄酮保护心肌缺血的可能作用通路 5.1 丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)通路
MAPK是细胞内的一类高度保守的丝氨酸/苏氨酸蛋白激酶。在哺乳类动物细胞中,MAPK包括3条并行的通路:细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、c-Jun氨基末端激酶(c-Jun NH2-terminal kinase,JNK)和p38MAPK。这3条主要信号转导途径在缺血/再灌注中发挥的作用不尽相同。ERK参与的信号转导途径在心肌缺血/再灌注损伤中主要起保护心肌细胞作用。T细胞中ERK的激活可诱导FLICE抑制蛋白(一种已知的caspase级联反应抑制剂),从而减少凋亡。ERK激活后,还可在线粒体中形成蛋白激酶C(PKC)复合物,使Bad磷酸化并失活,抑制细胞凋亡[96]。相反,JNK/应急激活的蛋白激酶SAPK和p38MAPK参与的信号转导通路在缺血/再灌注损伤中发挥促进凋亡的作用,可加重心肌缺血/再灌注损伤[97]。
p38MAPK信号通路是MAPK家族的主要成员,是细胞内信号传递系统的共同通路。p38MAPK通过增强c-myc表达、磷酸化p53、参与Fas/Fasl介导的凋亡、激活c-Jun和c-Fos、诱导bax转位、增强TNF-α表达,进一步促进p38MAPK活化,诱导细胞凋亡。相关研究表明,p38MAPK通过加重炎症反应、代谢异常及促进细胞凋亡作用加剧心肌细胞损伤[98,99],但可通过改善细胞能量代谢而减轻心肌细胞损伤。阻断p38MAPK级联能减轻炎症反应,亦可减轻心脏、肾脏和大脑的缺血/再灌注损伤。
董六一[88]经研究发现,心肌细胞缺氧预处理组及牡荆素预处理组ERK1/2活性明显高于对照组,而牡荆素预处理前给予ERKs的上游激酶MEK-1/2抑制剂PD98059则能显著抑制磷酸化ERK1/2的表达,结果提示牡荆素预处理对心肌细胞的保护作用可能与磷酸化ERK1/2的表达增加有关。因此,牡荆素预处理保护机制可能涉及MAPKs通路,诱导PKC以及下游激酶MAPKs活化,使机体对缺血的耐受性明显增强,从而产生延迟心肌保护作用。 5.2 NF-κB相关通路
NF-κB属于Rel蛋白家族。心肌细胞中的NF-κB参与缺血/再灌注导致的炎症、凋亡、坏死、心功能下降等病程的发生和发展[100]。NF-κB是一类具有多向转录调节作用的核蛋白因子,激活后参与多个基因的转录调控,与细胞凋亡关系密切,具有抑制细胞凋亡和促进细胞凋亡的双向作用[101],这主要取决于细胞的类型和诱发因素的种类。
NF-κB与心肌缺血/再灌注损伤密切相关,NF- κB的激活可加重缺血损伤,但在某些条件下又可触发心肌保护。心肌缺血预处理可以激活NF-κB[102],缺氧时可诱使心肌血管再形成,使心肌毛细血管和小动脉密度显著增加[103],引发内源性心脏保护,继而抑制NF-κB激活,减少炎性介质的表达,抑制中性粒细胞的激活,减少心肌细胞的凋亡,进而减轻心肌缺血/再灌注损伤。如果用二硫代氨基甲酸吡咯烷阻断NF-κB激活,则随后的再灌注损伤不受抑制,因此,预适应所产生的心肌保护效应需要有NF-κB的激活。 5.3 过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor gamma,PPARγ)相关通路
PPARγ是核内激素受体基因转录子,是一个重要的炎症调节因子。缺血/再灌注损伤发生时,PPARγ在缺血损伤区高度表达,参与抗缺血/再灌注损伤。用PPARγ激动剂罗格列酮治疗心肌缺血/再灌注损伤,可减轻与高胆固醇血症相关的动脉粥样硬化的形成,表现出抑制心肌细胞凋亡的作用。
PPARγ及其激动剂抗心肌缺血/再灌注损伤的主要分子机制可能包括:抑制中性粒细胞、白细胞等的聚集与激活,抑制单核细胞在内皮细胞的黏附,抑制组织中相关酶的活化;抑制促炎症因子的产生,诱导巨噬细胞凋亡,抑制巨噬细胞分化及活化时产生促炎症因子;调节MAPK信号通路平衡,减轻心肌细胞凋亡,减少自由基的产生及其转录因子的表达,抑制血管和炎症细胞中促炎转录因子信号通路;上调血红素加氧酶-1(HO-1)等有关保护因子的表达;增加内皮细胞一氧化氮的释放,保护血管内皮功能。枳壳中柚皮素和橙皮素可增强分化的3T3-L1细胞中脂联素的转录,诱导PPARγ激活,实现抗动脉硬化的作用[104]。 6 结语
碳苷黄酮特殊的苷键类型与一定的生物活性相关联,随着色谱质谱联用技术、药理模型和分子生物技术的不断发展和应用,对此类化合物的研究也将更为深入,对其生物活性及作用机制的研究也将有新的突破。
由于碳苷黄酮结构和取代基的特殊性,使其常以异构体形式出现,给分离鉴定带来了较大的困难。本课题组采用多种吸附材料,结合液相色谱技术,分离纯化精制总黄酮,得到淡竹叶乙醇提取物中多个碳苷黄酮,包括荭草苷、异荭草苷、牡荆苷、异牡荆苷、木犀草苷、当药黄素、日当药黄素等。现代研究表明,含有碳苷黄酮类化合物的天然药物具有良好的生物活性,因此,揭示碳苷总黄酮部位的药效物质基础是相关功能性产品开发研究的基础和前提,具有重要意义。
| [1] | Bandyukova V A, Yugin V A. Natural flavonoid C-glycosides [J]. Chem Nat Compd, 1981, 17(1): 1-21. |
| [2] | Matsufuji H, Ochi H, Shibamoto T. Formation and inhibition of genotoxic malonaldehyde from DNA oxidation controlled with EDTA [J]. Food Chem Toxicol, 2006, 44(2): 236-241. |
| [3] | 付晓春. 竹叶提取物及荭草苷抗心肌缺血作用及其机制探讨 [D]. 沈阳: 沈阳药科大学, 2005. |
| [4] | Sezik E, Aslan M, Yesilada E, et al. Hypoglycaemic activity of Gentiana olivieri and isolation of the active constituent through bioassay-directed fractionation techniques [J]. Life Sci, 2005, 76(11): 1223-1238. |
| [5] | Deliorman Orhan D, Aslan M, Aktay G, et al. Evaluation of hepato-protective effect of Gentiana olivieri herbs on subacute administration and isolation of active principle [J]. Life Sci, 2003, 72(20): 2273-2283. |
| [6] | Afifi F U, Khalil E, Abdalla S. Effect of isoorientin isolated from Arum palaestinum on uterine smooth muscle of rats and guinea pigs [J]. J Ethnopharmacol, 1999, 65(2): 173-177. |
| [7] | Gaitan E, Cooksey R C, Legan J, et al. Antithyroid effects in vivo and in vitro of vitexin: a C-glucosylflavone in millet [J]. J Clin Endocrinol Metab, 1995, 80(4): 1144-1147. |
| [8] | Annelis L, Bernard W, Byung H U, et al. 4"- hydroxymaysin and cassiaoccidentalin B, two unusual C-glycosylflavones from Mimosa pudica (Mimosaceae) [J]. Biochem Syst Ecol, 2002, 30(4): 375-377. |
| [9] | Li Y L, Ma S C, Yang Y T, et al. Antiviral activities of flavonoids and organic acid from Trollius chinensis Bunge [J]. J Ethnopharmacol, 2002, 79(3): 365-368. |
| [10] | Vrinda B, Devi U P. Radiation protection of human lymphocyte chromosomes in vitro by orientin and vicenin [J]. Mutat Res, 2001, 498(1/2): 39-46. |
| [11] | Zhang P C, Xu S X. C-glucoside flavonoids from the leaves of Crataegus pinnatifida Bge. var. major N. E. Br. [J]. J Asian Nat Prod Res, 2003, 5(2): 131-136. |
| [12] | Zou J H, Yang J S, Dong Y S, et al. Flavone C-glycosides from flowers of Trollius ledebouri [J]. Phytochemistry, 2005, 66(10): 1121-1125. |
| [13] | Ishida H, Wakimoto T, Kitao Y, et al. Quantitation of chafurosides A and B in tea leaves and isolation of prechafurosides A and B from oolong tea leaves [J]. J Agric Food Chem, 2009, 57(15): 6779-6786. |
| [14] | Rayyan S, Fossen T, Andersen Ø M. Flavone C-glycosides from seeds of fenugreek, Trigonella foenumgraecum L. [J]. J Agric Food Chem, 2010, 58(12): 7211-7217. |
| [15] | 吴新安, 赵毅民, 赵 刚. 短瓣金莲花黄酮碳苷类化学成分研究 [J]. 中国中药杂志, 2007, 32(9): 864-865. |
| [16] | Zou J H, Yang J, Zhou L. Acylated flavone C-glycosides from Trollius ledebouri [J]. J Nat Prod, 2004, 67(4): 664-667. |
| [17] | 马 国, 蒋学华, 黄 婷, 等. 山楂叶总黄酮在大鼠体内的药动学研究 [J]. 中国药学杂志, 2007, 42(8): 613-617. |
| [18] | 徐方方, 范春林, 王 磊, 等. 枳椇子的化学成分 [J]. 暨南大学学报: 自然科学与医学版, 2011, 32(3): 304-306. |
| [19] | Zehrmann N, Zidorn C, Ganzera M. Analysis of rare flavonoid C-glycosides in Celtis australis L. by micellar electrokinetic chromatography [J]. J Pharm Biomed Anal, 2010, 51(5): 1165-1168. |
| [20] | El-Alfy T S, El-Gohary H M, Sokkar N M, et al. A new flavonoid C-glycoside from Celtis australis L. and Celtis occidentalis L. leaves and potential antioxidant and cytotoxic activities [J]. Sci Pharm, 2011, 79(4): 963-975. |
| [21] | Doyama J T, Rodrigues H G, Novelli E L, et al. Chemical investigation and effects of the tea of Passiflora alata on biochemical parameters in rats [J]. J Ethnopharmacol, 2005, 96(3): 371-374. |
| [22] | 袁 珂, 吕洁丽, 殷明文. 海南含羞草中黄酮碳苷类化学成分的研究 [J]. 药学学报, 2006, 41(5): 435-438. |
| [23] | 胡永美, 叶文才, 李 茜, 等. 繁缕中的黄酮碳苷类化合物 (英文) [J]. 中国天然药物, 2006, 4(6): 420-424. |
| [24] | 池玉梅, 李 瑶, 张 瑜, 等. 超高效液相色谱-四极杆串联飞行时间质谱分析黄酮类化合物及小毛茛茎叶的成分 [J]. 色谱, 2013, 31(9): 838-844. |
| [25] | 宁丽娟, 叶志文, 欧 彪, 等. 毛鸡骨草中异夏佛塔苷对照品的制备研究 [J]. 中草药, 2010, 41(9): 1464-1466. |
| [26] | 周桂芬, 吕圭源. 基于高效液相色谱-二极管阵列光谱检测-电喷雾离子化质谱联用鉴定铁皮石斛叶中8种黄酮碳苷化合物及裂解规律研究 [J]. 中国药学杂志, 2012, 47(1): 13-19. |
| [27] | 朱田密, 陈科力, 黎 莉, 江南卷柏中的黄酮碳苷类成分研究 [J]. 中国药房, 2012, 23(7): 622-624. |
| [28] | 贾 安, 杨义芳, 孔德云. 广东紫珠中黄酮碳苷的分离与结构鉴定及初步体外抗炎活性研究 [J]. 中国医药工业杂志, 2012, 43(4): 263-267. |
| [29] | 冯卫生, 郑晓珂, 刘云宝, 等. 石胆草中黄酮碳苷的分离与结构鉴定 [J]. 药学学报, 2004, 39(2): 110-115. |
| [30] | 李亚萍, 张雷红, 范春林, 等. 海金沙草黄酮及酚酸类化学成分的研究 [J]. 中药材, 2008, 31(2): 224-226. |
| [31] | 舒积成, 张 锐, 张 维, 等. 凤尾草中黄酮类化学成分研究 [J]. 中成药, 2012, 34(6): 1122-1126. |
| [32] | 杨念云, 段金廒, 李 萍, 等. 金钱草中黄酮类化合物的分离与结构鉴定 [J]. 中国药学杂志, 2006, 41(21): 1621-1624. |
| [33] | 聂 韡, 罗建光, 孔令义. 大叶石头花中的黄酮碳苷 (英文) [J]. 中国天然药物, 2010, 8(4): 250-252. |
| [34] | 高桂花, 邓湘昱, 刘 娟, 等. 大青叶中碳苷黄酮类化合物 [J]. 沈阳药科大学学报, 2007, 24(12): 748-750. |
| [35] | Rahman K, Krenn L, Kopp B, et al. Isoscoparin- 2"-O-glucoside from Passiflora incarnate [J]. Phytochemistry, 1997, 45(5): 1093-1094. |
| [36] | Lin C N, Kuo S H, Chung M I, et al. A new flavones C-glycoside and antiplatelet and vasorelaxing flavones from Gentiana arisanensis [J]. J Nat Prod, 1997, 60(8): 851-853. |
| [37] | 王英平. 玉米须化学成分及其抗氧化作用研究 [D]. 长春: 吉林农业大学, 2004. |
| [38] | Hosoya T, Yun Y S, Kunugi A. Five novel flavonoids from Wasabia japonica [J]. Tetrahedron, 2005, 61(29): 7037-7044. |
| [39] | Du Z Z, Yang X W, Han H, et al. A new flavone C-glycoside from Clematis rehderiana [J]. Molecules, 2010, 15(2): 672-679. |
| [40] | Nørbaek R, Aaboer D B, Bleeg I S, et al. Flavone C-glycoside, phenolic acid, and nitrogen contents in leaves of barley subject to organic fertilization treatments [J]. J Agric Food Chem, 2003, 51(3): 809-813. |
| [41] | Pan Y X, Zhou C X, Zhang S L, et al. Constituents from Ranunculus sieboldii Miq. [J]. J Chin Pharm Sci, 2004, 13(2): 92-96. |
| [42] | Liu M, Liu Q, Liu Y L, et al. An acylated flavones C-glycoside from Glycyrrhiza eurycarpa [J]. Phytochemistry, 1994, 36(4): 1089-1090. |
| [43] | Williams C A, Toscano De Brito A L, Harborne J B, et al. Methylated C-glycosyl flavones as taxonomic markers in orchids of the subtribe Ornithocephalinae [J]. Phytochemistry, 1994, 37(4): 1045-1053. |
| [44] | 魏金霞, 李丹毅, 华会明, 等. 金莲花化学成分的分离与鉴定 (II) [J]. 沈阳药科大学学报, 2012, 29(1): 12-15. |
| [45] | Wu Q X, Li Y, Shi Y P. Antioxidant phenolic glucosides from Gentiana piasezkii [J]. J Asian Nat Prod Res, 2006, 8(5): 391-396. |
| [46] | 宋志军, 刘 鑫, 邱声祥, 等. 西番莲中黄酮碳苷的串联质谱分析 [J]. 分析测试学报, 2008, 27(1): 72-73. |
| [47] | 武海艳. 霞草花化学成分的研究 [D]. 济南: 济南大学, 2012. |
| [48] | 袁 珂, 贾 安, 吕洁丽. 含羞草中新黄酮碳苷的结构鉴定 [J]. 分析化学, 2007, 35(5): 739-742. |
| [49] | Tang L, Xu X M, Rinderspacher K A, et al. Two new compounds from Comastoma pedunlulatum [J]. J Asian Nat Prod Res, 2011, 13(10): 895-900. |
| [50] | 朱 迪, 杨 杰, 赖茂祥, 等. 金丝草中的新黄酮碳苷 (英文) [J]. 中国天然药物, 2010, 8(6): 411-413. |
| [51] | 吴 巍, 宋凤瑞, 刘志强, 等. 利用HPLC-ESI-MS/MS区分黄芩中黄酮C-苷异构体的研究 [J]. 高等学校化学学报, 2005, 26(1): 27-30. |
| [52] | Suzuki R, Okada Y, Okuyama T. A new flavones C-glycoside from the style of Zea mays L. with glycation inhibitory activity [J]. Chem Pharm Bull, 2003, 51(10): 1186-1188. |
| [53] | Markham K R, Mabry T J, Averett J E. Acacetin 7-O- rhamnosyl-galacturonide from Reboulia hemispherica [J]. Phytochemistry, 1972, 11(9): 2875-2876. |
| [54] | Bylka W, Szaufer-Hajdrych M, Matławska I, et al. Antimicrobial activity of isocytisoside and extracts of Aquilegia vulgaris L [J]. Lett Appl Microbiol, 2004, 39(1): 93-97. |
| [55] | Salvador M J, Ferreira E O, Mertens-Talcott S U, et al. Isolation and HPLC quantitative analysis of antioxidant flavonoids from Alternanthera tenella Colla [J]. Z Naturforsch C, 2006, 61(1/2): 19-25. |
| [56] | Mishra B B, Yadav S B, Singh R K, et al. A novel flavonoid C-glycoside from Sphaeranthus indicus L. (family Compositae) [J]. Molecules, 2007, 12(10): 2288-2291. |
| [57] | 李会军, 李 萍. HPLC法测定酸枣仁不同炮制品中两种黄酮碳苷的含量 [J]. 中国中药杂志, 2002, 27(4): 23-25. |
| [58] | 王 慧. 酸枣仁化学成分及其配伍制剂天王补心丹质量标准的研究 [M]. 沈阳: 沈阳药科大学, 2009. |
| [59] | Morsch M, Girardi L G, Cechinel-Filho V, et al. Separation of C-glycoside flavonoids from Aleurites moluccana using chitin and full N-acetylated chitin [J]. Z Naturforsch C, 2002, 57(9/10): 957-959. |
| [60] | Wallace J W, Morris G. C-Glycosylflavones in Gnetum gnemon [J]. Phytochemistry, 1978, 17(10): 1809-1810. |
| [61] | Hawas U W, Soliman G M, Abou El-Kassem L T, et al. A new flavonoid C-glycoside from Solanum elaeagnifolium with hepatoprotective and curative activities against paracetamol-induced liver injury in mice [J]. Z Naturforsch C, 2013, 68(1/2): 19-28. |
| [62] | 赵国伟. 石南藤的化学成分研究 [D]. 济南: 山东大学, 2012. |
| [63] | 刘建群, 潘景行, 张 锐, 等. 扁担杆的化学成分 II [J]. 中国实验方剂学杂志, 2011, 17(5): 87-89. |
| [64] | Nianbifan G, Sangggng Y, Tom J M. Flavonoids from Ageratina calophylla [J]. Phytochemistry, 1986, 25(11): 2684-2686. |
| [65] | 刘辉鑫, 廖海兵, 袁 珂. 红花芒毛苣苔化学成分研究 [J]. 中国中药杂志, 2012, 37(13): 1963-1967. |
| [66] | Faizi S, Shamimin M A. A new flavonol C-glycoside from leaves of Bombax ceiba [J]. Planta Med, 1999, 65(4): 383-385. |
| [67] | Righi A A, Alves T R, Negri G, et al. Brazilian red propolis: unreported substances, antioxidant and antimicrobial activities [J]. J Sci Food Agric, 2011, 91(13): 2363-2370. |
| [68] | Mbafor J T, Fomum Z T. Isolation and characterization of taxifolin 6-C-glucoside from Garcinia epunctata [J]. J Nat Prod, 1989, 52(2): 417-419. |
| [69] | Rong H J, Stevens J F, Deinzer M L, et al. Identification of isoflavones in the roots of Pueraria lobata [J]. Planta Med, 1998, 64(7): 620-627. |
| [70] | 张培成, 毋 艳, 于德泉. 海南黄檀化学成分研究 [J]. 中国中药杂志, 2003, 28(6): 50-53. |
| [71] | Kawaguchi K, de Mello Alves S, Watanabe T, et al. Colony stimulating factor-inducing activity of isoflavone C-glucosides from the bark of Dalbergia monetaria [J]. Planta Med, 1998, 64(7): 653-655. |
| [72] | Kreuz S, Joubert E, Waldmann K H, et al. Aspalathin, a flavonoid in Aspalathus linearis (rooibos), is absorbed by pig intestine as a C-glycoside [J]. Nutr Res, 2008, 28(10): 690-701. |
| [73] | Joubert E. HPLC quantification of the dihydrochalcones, aspalathin and nothofagin in rooibos tea (Aspalathus linearis) as affected by processing [J]. Food Chem, 1996, 55(4): 403-411. |
| [74] | Slimestad R, Fossen T, Verheul M J. The flavonoids of tomatoes [J]. J Agric Food Chem, 2008, 56(7): 2436-2441. |
| [75] | 陆薪如, 秦民坚, 徐德然. HPLC-ESI-MS/MS法鉴定通关丸的主要化学成分 [J]. 中国天然药物, 2008, 6(4): 283-291. |
| [76] | Sun Y, Zhang X, Xue X, et al. Rapid identification of polyphenol C-glycosides from Swertia franchetiana by HPLC-ESI-MS-MS [J]. J Chromatogr Sci, 2009, 47(3): 190-196. |
| [77] | A·德根哈德特, F·乌尔里希, T·霍夫曼, 等. 类黄酮糖加成产物、生产方法及其应用: 中国, CN 101081858 [P]. 2007-12-05. |
| [78] | 李 楠. 金莲花中黄酮类化合物稳定性研究 [J]. 食品研究与开发, 2011, 32(11): 76-77. |
| [79] | 张培成. 黄酮化学 [M]. 北京: 化学工业出版社, 2008. |
| [80] | 付晓春, 李少鹏, 王敏伟, 等. 竹叶提取物对心肌缺血再灌注损伤的保护作用 (英文) [J]. 天然产物研究与开发, 2006, 18(2): 214-218. |
| [81] | 邵 莹, 吴启南, 周 婧, 等. 淡竹叶黄酮对大鼠心肌缺血/再灌注损伤的保护作用 [J]. 中国药理学通报, 2013, 29(2): 241-247. |
| [82] | Shao Y, Wu Q N, Wen H M, et al. Determination of flavones in Lophatherum gracile by liquid chromatography tandem mass spectrometry [J]. Instrum Sci Technol, 2014, 42(2): 1-14. |
| [83] | 董六一, 邵 旭, 江 勤, 等. 牡荆素对大鼠实验性心肌缺血损伤的保护作用及其机制 [J]. 中草药, 2011, 42(7): 1378-1383. |
| [84] | 郑德志. 大鼠心肌缺血再灌注损伤心室重构及芒果苷对其作用和机制的研究 [D]. 重庆: 第三军医大学, 2012. |
| [85] | 边云飞. 氧化应激与心血管疾病 [M]. 北京: 军事医学科学出版社, 2012. |
| [86] | 吕纪华, 贺 敏, 黄建春, 等. 玉郎伞黄酮对心肌缺血再灌注损伤心肌组织ATP酶和凋亡蛋白的影响 [J]. 中国实验方剂学杂志, 2010, 16(13): 162-166. |
| [87] | Kim K S, Yoon S T, Li J, et al. Disc degeneration in the rabbit: a biochemical and radiological comparison between four disc injury models [J]. Spine, 2005, 30(1): 33-37. |
| [88] | 董六一. 牡荆素对心肌缺血/再灌注损伤的保护作用及其作用机制 [D]. 合肥: 安徽医科大学, 2007. |
| [89] | Jiang W L, Fu F H, Xu B M, et al. Cardioprotection with forsythoside B in rat myocardial ischemia-reperfusion injury: relation to inflammation response [J]. Phytomedicine, 2010, 12(8/9): 635-639. |
| [90] | Sugano M, Hata T, Tsuchida K, et al. Local delivery of soluble TNF-alpha receptor gene reduces infarct size following ischemia/reperfusion injury in rats [J]. Mol Cell Biochem, 2004, 266(1/2): 127-132. |
| [91] | Yeh C H, Chen T P, Wu Y C, et al. Inhibition of NF kappa B act ivation with curcum in attenuates plasma inflammatory cytokines surge and cardiomyocytic apoptos is following cardiac ischemia/reperfusion [J]. J Surg Res, 2005, 125(1): 109-116. |
| [92] | Altavilla D, Deodato B, Campo G M, et al. IRFI042, a novel dual vitamin E-like antioxidant, inhibits activation of nuclear factor-kappa B and reduces the in flammatory response in myocardial ischemia-reperfusion injury [J]. Cardiovasc Res, 2000, 47(3): 515-528. |
| [93] | Wong E T, Tergaonkar V. Roles of NF-kappa B in health and disease: mechanisms and therapeutic potential [J]. Clin Sci, 2009, 116(6): 451-465. |
| [94] | Pasparakis M. Regulation of tissue homeostasis by NF-kappa B signalling: implications for inflammatory diseases [J]. Nat Rev Immunol, 2009, 9(11): 778-788. |
| [95] | 周 翔. 荭草素-2"-O-β-D-半乳糖苷抑制小胶质细胞炎症反应及其机制研究 [D]. 苏州: 苏州大学, 2013. |
| [96] | Janicke R U, Sprengart M L, Wati M R, et al. Caspase-3 is required for DNA fragmentation and morphological changes associated with apoptosis [J]. J Biol Chem, 1998, 273(16): 9357-9360. |
| [97] | Ferrandi C, Ballerio R, Gailard P, et al. Inhibition of c-Jun N-teminal kinase decreases cardiomyocyte apoptosis and infarct size after myocardial ischemia and reperfusion in anaesthetized rats [J]. Br J Pharmacol, 2004, 142(6): 953-60. |
| [98] | Niwa K, Inanami O, Ohta T, et al. p38 MAPK and Ca+2 contribute to hydrogen peroxide-induced increase of permeability in vascular endothelial ceils but ERK does not [J]. Free Radic Res, 2001, 35(5): 519-527. |
| [99] | Kevil C G, Oshima T, Alexander J S. The role of p38 MAP kinase in hydrogen peroxide mediated endothelial solute permeability [J]. Endothelium, 2001, 8(2): 107-116. |
| [100] | Valen G. Signal transduction through nuclear factor kappa B in ischemia-reperfusion and heart failure [J]. Basic Res Cardiol, 2004, 99(1): 1-7. |
| [101] | Escarcega R O, Fuentes-Alexandro S, Gareia Carraseo M, et al. The transeription factor nuclear faetor-kappa B and cancer [J]. Clin Oncol (R Coll Radiol), 2007, 19(2): 154-161. |
| [102] | 刘 芳, 潘 芳. 核转录因子NF-kB与心肌缺血再灌注损伤 [J]. 中国实用医药杂志, 2007, 13(2): 83-85. |
| [103] | Goukassian D A, Qin G, Dolan C, et al. Tumor necrosis factor-alpha receptor p75 is required in ischemia-induced neovascularization [J]. Circulation, 2007, 115(6): 752-762. |
| [104] | Liu L, Shan S, Zhang K, et al. Naringenin and hesperetin, two flavonoids derived from Citrus aurantium up-regulate transcription of adiponectin [J]. Phytother Res, 2008, 10(22): 1400-1403. |
 2015, Vol. 46
2015, Vol. 46


