2. 中国人民解放军第三〇二医院, 北京 100039
2. 302 Military Hospital of China, Beijing 100039, China
葫芦素B(cucurbitacin B,CuB)是从葫芦科植物甜瓜Cucumis melo L. 瓜蒂及其他葫芦科植物中分离得到的一种四环三萜类化合物,具有抗炎、保肝及抗肿瘤等活性[1]。近年来,CuB在肿瘤治疗方面的潜在应用引起了国内外学者的高度关注。药理研究表明,CuB对多种肿瘤均有抑制作用,其抗肿瘤机制可能与阻断信号转导通路(STAT3和MAPA),诱导细胞凋亡及破坏细胞骨架等有关[2]。然而,CuB毒性大、水溶性差,口服生物利用度低,严重限制了其临床应用[3, 4]。为解决这一难题,国内外学者已研制出多种CuB新型制剂,包括葫芦素混合胶束、固体脂质纳米粒、水-醇凝胶、聚乳酸纳米粒、B-PLGA微球[5, 6, 7, 8, 9]等,却均面临着产业化困难及载药量低等缺点。磷脂复合物(PLC)作为一种前景广阔的给药系统,即药物和磷脂分子通过电荷迁移作用形成一种较为稳定的化合物或络合物,可改善药物的理化性质、增强疗效、增加口服吸收、提高生物利用度等[10, 11, 12]。然而目前关于葫芦素B磷脂复合物(CuB-PLC)的研究至今未见报道。本实验在前期研究的基础上,采用Box-Behnken设计结合效应面法优化CuB-PLC的制备工艺,对其理化性质进行评价,并初步研究其体外抗肿瘤活性。
1 仪器与试药KQ-100E型超声波清洗器,昆山市超声仪器有限公司;85-2恒温磁力搅拌器,常州国华电器有限公司;LC-20A岛津液相色谱仪,日本岛津公司;DZF-6020真空干燥箱,上海一恒科学仪器有限公司;Winner801纳米激光粒度仪,济南微纳颗粒仪器股份有限公司;XDS-1B倒置生物显微镜,北京京瑞天下科技有限公司;Forma Series II水套CO2培养箱,Thermo Fisher公司;Multiskan GO全波长酶标仪,Thermo Scientific公司。
胎牛血清,美国HyClone公司,批号DPEO167;二苯基四氮唑蓝(MTT),批号1325B38,美国Sigma公司;二甲基亚砜(DMSO),批号20130505324,购自美国Amresco公司;人肝癌细胞株HepG2细胞系,购自中国典型培养物保藏中心;RPMI 1640培养基,美国Hyclone公司,批号2013120817;CuB对照品,批号130111,上海源叶生物科技有限公司,HPLC质量分数≥98%;CuB原料药,质量分数95%,天津药物研究院,批号120301;大豆磷脂,批号20130414,上海太伟药业有限公司,注射级;甲醇为色谱纯;四氢呋喃,批号120304,成都科龙试剂有限公司;其余试剂均为分析 纯。
2 方法与结果 2.1 CuB-PLC的制备及工艺评价标准[13]利用CuB不溶于四氢呋喃,而磷脂和CuB-PLC均易溶于四氢呋喃的特性,称取CuB原料药0.1 g及一定量的磷脂于100 mL圆底烧瓶中,加入适量四氢呋喃,在一定的温度下搅拌反应一定时间后,减压除去反应溶剂。残余物加入适量四氢呋喃,充分溶解,滤过,再用少量四氢呋喃洗涤沉淀物,收集沉淀物,干燥。合并滤液及洗涤液,回收溶剂,剩余物真空干燥即得CuB-PLC。
将沉淀物溶于一定体积的甲醇溶液中,HPLC法测定其中CuB的量[8]。初始投药量CuB的量(W1)与沉淀中CuB的量(W2,W2=测得CuB的质量浓度×体积)的差值即为形成CuB-PLC的CuB的量。以CuB-PLC的复合率(CR)为指标评价CuB-PLC的制备工艺,计算公式为CR=(W1 -W2)/W1。
2.2= HPLC法测定CuB[8] 2.2.1 色谱条件色谱柱为Diamonsil-C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-水(62∶38);体积流量1.0 mL/min;紫外检测波长228 nm;柱温为室温;进样量10 μL。
2.2.2 对照品溶液的制备精密称取干燥至恒定质量的CuB对照品 11.28 mg,置于 100 mL量瓶中,用甲醇溶解制成112.8 μg/mL的储备液。
2.2.3 供试品溶液的制备将“2.1”项下收集的沉淀物移入10 mL量瓶中,加适量甲醇振摇待溶液澄清后,继续加甲醇至刻度。溶液过0.45 μm微孔滤膜滤过,备用。
2.2.4 专属性考察将阴性对照溶液(不含CuB的空白磷脂溶于甲醇后的溶液),CuB对照品溶液以及供试品溶液,依照“2.2.1”项下色谱条件进行测定,结果显示,阴性对照溶液在与CuB对照品相同保留时间处未见色谱峰,故认为其他成分对CuB的测定无干扰,其色谱图见图 1。
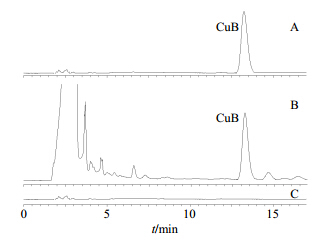 | 图 1 CuB对照品 (A)、供试品 (B) 和阴性对照溶液 (C)的HPLC色谱图Fig. 1 HPLC of CuB reference substance (A), sample (B), and negative reference solution (C) |
精密吸取质量浓度为112.8 μg/mL的CuB对照品储备液溶液适量,用甲醇按不同比例稀释,得质量浓度为0.112 8、0.564、2.820、5.640、11.28 μg/mL系列对照品溶液。分别吸取10 μL进样分析,以质量浓度为横坐标(X),色谱峰面积为纵坐标(Y),以质量浓度对峰面积用最小二乘法进行回归运算,求得的直线回归方程为Y=103.28 X+2.986 6,r=0.999 7,结果表明CuB在0.112 8~11.28 μg/mL与峰面积的线性关系良好。按上述方法配制高、中、低质量浓度的对照品溶液,测得日内和日间精密度的RSD均小于2.10%。
2.2.6 稳定性试验取“2.2.3”项下的供试品溶液,分别于室温放置0、1、2、4、8 h后进样,结果5次测定的质量分数平均值为99.4%,RSD为0.66%。结果表明样品溶液8 h内稳定。
2.2.7 重复性试验取“2.2.3”项下的供试品溶液按“2.2.1”项下色谱条件测定CuB的峰面积,RSD为1.05%。结果表明,本方法重复性良好。
2.2.8 加样回收率试验先按“2.2.1”项下方法测定供试品中CuB的量;另量取已测定的供试品,共9份,均分为3组,分别加入相当于所取样品溶液标示量80%、100%、120%的CuB对照品溶液,按“2.2.3”项下方法制备供试品溶液,依法测定,计算回收率,结果显示CuB的平均回收率为99.54%,RSD为0.83%,表明本法回收率较好,准确度较高。
2.3 单因素考察试验 2.3.1 反应溶剂的选择根据文献报道及预试验,设定CuB与磷脂的投料比为1∶1(物质的量比),反应温度为60 ℃,反应时间为3 h,质量浓度为1 mg/mL。以CuB-PLC的CR为评估标准,对1, 4-二氧六环、二氯甲烷、四氢呋喃、醋酸乙酯和丙酮进行考察,优选出最佳反应溶剂,结果CR分别为10.9%、32.2%、84.6%、45.3%、51.5%。可见当四氢呋喃为反应溶剂时,药物的CR最高,综合考虑,选择四氢呋喃为反应溶剂。
2.3.2 反应温度的影响以四氢呋喃为反应溶剂,分别考察在40、50、60 ℃下CuB-PLC的CR,结果分别为38.3%、76.5%、79.1%。
2.3.3 反应时间的影响考察反应时间为1、2、3、4 h的CR,结果分别为20.3%、60.6%、88.3%、88.1%。
2.3.4 反应物质量浓度的影响考察反应物质量浓度(以CuB计)对CR的影响。质量浓度分别为1.0、1.5、2.0 mg/mL时CR分别为80.6%、84.6%、62.7%。
2.3.5 投料比例的影响考察CuB与磷脂的不同投料比(物质的量比)时的CR。投料比例分别为1∶1.0、1∶1.5和1∶2.0时CR分别为83.7%、81.1%、65.6%。
2.4 Box-Behnken设计-效应面法优化CuB-PLC制备工艺 2.4.1 试验设计在单因素考察试验的基础上,以CuB-PLC的CR为指标,选取对CuB-PLC的CR影响显著的3个因素:反应温度(A)、反应物质量浓度(B)、CuB与磷脂的投料物质的量比(C),采用3因素3水平的Box-Behnken设计优化CuB-PLC制备工艺,Box-Behnken设计试验安排表见表 1。
| 表 1 Box-Behnken试验安排及结果 Table 1 Arrangement and results of Box-Behnken design |
使用Design-Expert 8.0.7.1软件对Box-Behnken设计数据进行处理,以CR为指标进行多元线性回归和二项式方程拟合。CR用二项式回归最优,其二次多元回归方程为CR=94.51+6.91 A-4.10 B-7.71 C+4.35 AB+10.78 AC-3.89 BC-3.46 A2+0.23 B2-5.73 C2(R2=0.978 9,P<0.000 1)。
2.4.3 方差分析和显著性检验拟合方程的相关系数说明设计模型拟合程度良好,可用此模型对处方进行分析和预测。从表 2回归系数的显著性检验可知,模型CR中A的一次项、二次项,B的一次项、二次项,C的一次项、二次项,各因素的交互项都达到显著水平(P<0.05)。
| 表 2 二项式回归方程系数显著性检验 Table 2 Significance of coefficients in second order regression |
采用Design-Expert 8.0.7.1实验设计软件,分别绘制效应指标CR与其中2个自变量的三维效应面图,见图 2。
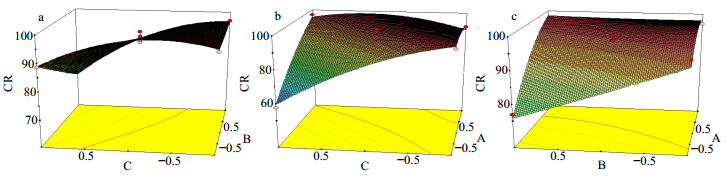 | 图 2 各因素对响应值影响的三维效应曲面图Fig. 2 3D Response surface plot for effects of each factor |
图 2-a显示A在50 ℃的条件下,B和C对CuB-PLC的CR的影响。CuB-PLC的CR随着B的增加而非线性降低,随着C的增加先升后降。
图 2-b显示在B为1.5 mg/mL的条件下,A和C对CuB-PLC的CR的影响。CR随着C的增加呈非线性降低,随着A的增加呈非线性降低。
图 2-c显示在C为1.5∶1的条件下,A和B对CuB-PLC的CR影响。CR随着B的增高而呈非线性降低,随着A的增加呈非线性增高。
按各指标的期望设定目标,得到的优选处方条件为磷脂与CuB的投料物质的量比为1∶1,反应温度为60 ℃,反应时间为3 h ,反应物质量浓度为1.5 mg/mL。依据该处方制备3批CuB-PLC,测定各响应指标。实际测量值CR为(97.01±0.79)%(n=3),模型对指标的预测值为97.94%。结果显示实际测量值与模型预测值接近,表明该模型的预测性良好,表明该制备处方可行。
2.5 CuB-PLC的理化性质研究 2.5.1 X射线衍射(XRD)分析[13]
分别将CuB- PLC、物理混合物、磷脂和CuB进行XRD分析。结果见图 3,显示了CuB-PLC、物理混合物、磷脂和CuB的XRD峰。CuB和磷脂均显示有多个晶体衍射峰,物理混合物中CuB和磷脂的特征衍射峰均存在,而在磷脂复合物中,两者的晶型完全转变,说明CuB以无定型态分散在磷脂中。
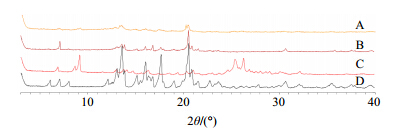 | 图 3 CuB-PLC (A)、物理混合物 (B)、磷脂 (C)、CuB (D)的XRD图Fig. 3 XRD pattern of CuB-PLC (A), physical mixture (B), phospholipids (C), and CuB (D) |
分别取CuB-PLC、CuB、磷脂、处方比例物理混合物适量,以KBr为参比进行IR分析,波数范围400~4 000 cm−1。结果见图 4,通过比较可以看出,物理混合物(图 4-A)的图谱基本上是CuB与磷脂主要峰的叠加。说明CuB与磷脂的混合物中二者之间并没有相互作用。而CuB-PLC的图谱与物理混合物完全不一样,不再保持CuB的IR图的基本特征,CuB分子结构中特征峰碳氢吸收(νC-H 1 372.83、1 253.03 cm−1)消失,
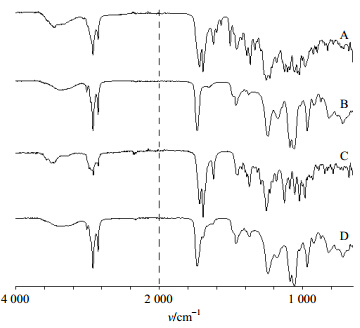 | 图 4 磷脂 (A)、物理混合物 (B)、CuB (C)、CuB-PLC (D)IR图Fig. 4 FTIR Patterns of phospholipids (A), physical mixture(B), CuB (C), and CuB-PLC (D) |
酮吸收峰向高波数移动,由1 718.22、1 694.61 cm−1变成单峰1 732.73 cm−1,羟基的伸缩振动峰的峰位由3 502.66 cm−1变为3 393.68 cm−1。磷脂的非极性端相应的主要吸收峰基本未发生变化,而CuB碳氢吸收、羟基、酮基发生了变化。说明CuB结构中的官能团与磷脂分子中的某些部分发生了一定的相互作用。
2.5.3 表观油水分配系数的测定采用平衡法测定,称取过量的CuB、处方比例物理混合物和CuB-PLC,分别加入50 mL蒸馏水置磨口三角瓶中,各3份,室温下搅拌24 h,静置平衡,移置离心管中,离心。取上层20 mL,各置磨口三角瓶中,分别加入正辛醇20 mL,于室温下摇匀至溶解平衡(预试验表明平衡时间为12 h),离心。分别移取水相、正辛醇相2 mL置10 mL量瓶中定容。按“2.2”项下方法测定,即得溶解度。重复3次,结果见表 3。可见CuB-PLC在水-正辛醇中的溶解度大于原药及物理混合物,CuB-PLC表观油水分配系数[lg(Co/Cw)]增大。
| 表 3 CuB、物理混合物及CuB-PLC在正辛醇-水系统中表观分配系数 (n = 3) Table 3 Apparent partition coefficient of CuB, physical mixture, and CuB-PLC in octyl alcohol-water system (n = 3) |
取CuB-PLC 20 mg用3 mL双蒸水混悬并涡旋10 min分散后,呈混悬状,再用双蒸水稀释1倍后,得到半透明状胶体溶液,用透射电镜观察粒子的形态大小,见图 5。用粒径测定仪测得CuB-PLC的水分散体的粒径为(521.30±10.50)nm,多分散指数(PDI)为0.133 2±0.024 0,见图 6。
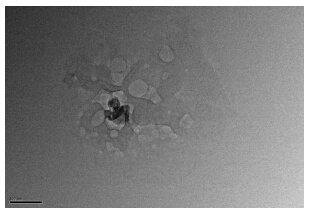 | 图 5 CuB-PLC的TEM图Fig. 5 TEM of CuB-PLC |
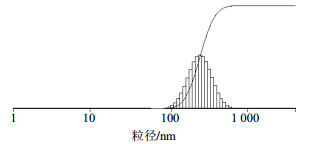 | 图 6 CuB-PLC的水分散体粒径图Fig. 6 Diameter distribution of aqueous dispersion of CuB-PLC |
MTT法测定HepG2细胞增殖。分别精密称取反应CuB原料药、CuB-PLC、磷脂各0.2 g,分别置于50 mL具塞锥形瓶中,加水25 mL,称定质量,超声提取40 min,取出放冷,再称定质量,补足减少的质量,摇匀,离心10 min(8 000 r/min),过0.45 μm微孔滤膜,取续滤液,即得供试品溶液,5 ℃冷藏,供体外抗肿瘤药效实验用。
取对数生长期人肝癌细胞HepG2,胰酶常规消化成单细胞悬液,接种至96孔板中(每孔约5×104细胞),孔板四周用无菌PBS填充以防止边缘效应,细胞置96孔板中贴壁12 h后,96孔板分成3组:分别给予CuB原料药(含0.1% DMSO的培养基溶液)、CuB-PLC和磷脂,每组设4个浓度梯度(即含CuB 0.1、1、10、100 μmol/L),每个浓度梯度设5个复孔,并设5个阴性对照孔(细胞自然生长组)和2个调零孔,细胞在37 ℃ 5% CO2条件下培养48 h后,加入5 mg/mL MTT溶液20 μL,继续培养4 h后,小心吸取培养液,每孔加入10% SDS(含10 mmol/L HCl)溶液100 μL,摇床低速振荡10 min后,用酶联免疫检测仪测定各孔在570 nm处的吸光度(A)值。并利用以下公式计算药物对细胞的增殖抑制率(IR):IR=(A0-A1)/A0(A0为阴性对照组A值,A1为药物作用组A值)。
根据实验结果计算得CuB原料药和CuB-PLC抑制HepG2细胞增殖的IC50值为42.55、27.61 μmol/L。t检验结果显示,在各浓度组,CuB原料药与CuB-PLC对细胞的抑制率存在显著性差异(P<0.05),CuB-PLC组与磷脂组对细胞的抑制率存在显著性差异(P<0.05)。见表 4。
| 表 4 CuB-PLC、CuB及磷脂作用HepG2细胞48 h的抑制效应(x±s, n = 5) Table 4 Inhibitory effects of CuB-PLC, CuB, and phospholipids on HepG2 cells at 48 h (x±s, n = 5) |
通过本实验发现,采用溶剂蒸发法制备了CuB- PLC,采用Box-Behnken设计-效应面优化法系统考察并优化了其制备工艺,药物与磷脂的复合反应较容易进行,并且从IR图谱中羟基、酮基等多个特征吸收峰的改变推测,CuB中含有较多的羟基,可以与磷脂中的不饱和基团发生氢键或分子间作用力,PLC与普通磷脂与药物的物理混合物不相同。CuB-PLC中CuB与磷脂基本化学结构没有发生根本性的改变,没有形成新的化合物,也不是混合物,而是一种复合物。
XRD分析表明发生电荷传递作用后CuB和磷脂均处于高度分散状态,CuB自身的晶体特征被抑制,以无定型存在,自由能较高。
CuB-PLC在水中和正辛醇中的溶解性能均有改善,一方面是由于其无定型的状态及在水中形成胶团的增溶作用,另一方面则可能是是由于药物极性基团与磷脂缔合,使药物极性基团受到屏蔽,表现出较强的脂溶性。从物理混合物的实验结果可以看到,磷脂的存在只是有限地改善了CuB在水中和正辛醇中的溶解性能。CuB-PLC既增加了CuB的水溶性,又增加了其脂溶性,这可显著提高其生物利用度。
采用HepG2细胞考察了CuB-PLC的体外抗肿瘤活性,实验发现,CuB原料药、CuB-PLC抑制HepG2细胞增殖的IC50分别42.55、27.61 μmol/L,空白磷脂几乎没有细胞毒性。结果说明,CuB在体外对HepG2细胞具有很强的抑制作用。将其制备成磷脂复合物后,其IC50减小,对HepG2细胞增殖的抑制作用增强。本研究中出现的这一现象可能与磷脂复合物能够提高药物细胞膜的通透性,增强了肿瘤细胞对药物的摄取有关。
| [1] | Chen J C, Lu L, Zhang X M, et al. Eight new cucurbitane glycosides, kuguaglycosides A-H, from the root of Momordica charantia L. [J]. Helv Chim Acta, 2008, 91(5): 920-929. |
| [2] | 张延亭, 欧阳东云, 何贤辉. 葫芦素B抗肿瘤作用及其机制研究进展 [J]. 中国药理学与毒理学杂志, 2012, 26(1): 112-115. |
| [3] | Hu H Y, Liu D, Zhao X L, et al. Preparation, characterization, cellular uptake and evaluation in vivo of solid lipid nanoparticles loaded with cucurbitacin B [J]. Drug Dev Ind Pharm, 2013, 39(5): 770-779. |
| [4] | Lu P, Yu B D, Xu J. Cucurbitacin B regulates immature myeloid cell differentiation and enhances antitumor immunity in patients with lung cancer [J]. Cancer Biother Radio, 2012, 27(8): 495-503. |
| [5] | 盛秋双, 王绍宁, 李妍妍, 等. 葫芦素B水-醇凝胶的体外经皮通透性 [J]. 沈阳药科大学学报, 2009, 26(12): 849-851. |
| [6] | 王文宇, 陈大为, 邓智先, 等. 注射用葫芦素B固体脂质纳米粒的制备 [J]. 沈阳药科大学学报, 2010, 27(3): 180-184. |
| [7] | 周丽莹, 关 津, 聂淑芳, 等. 中药提取物葫芦素B-PLGA微球的制备及处方工艺优化 [J]. 中国药房, 2009, 20(33): 2588-2592. |
| [8] | 徐炳欣, 郑甲信, 赵媛媛, 等. 葫芦素B固体脂质纳米粒对人神经母细胞瘤SK-N-SH细胞的体外细胞毒作用评价 [J]. 中国药学杂志, 2012, 47(23): 1894-1898. |
| [9] | 于 超, 肖云芝, 徐平华, 等. 葫芦素B磷脂胆酸盐混合胶束口腔速溶膜的制备、表征和抗肿瘤活性研究 [J]. 中国中药杂志, 2014, 39(10): 1799-1803. |
| [10] | 夏海建, 张振海, 孙 娥, 等. 胶体二氧化硅固化银杏黄酮组分磷脂复合物的研究 [J]. 中草药, 2014, 45(8): 1078-1082. |
| [11] | Jena S K, Singh C, Dora C P, et al. Development of tamoxifen-phospholipid complex: Novel approach for improving solubility and bioavailability [J]. Int J Pharm, 2014, 473(1/2): 1-9. |
| [12] | 唐 勤, 顾 勇, 李 纳, 等. 姜黄素磷脂复合物壳聚糖微球在大鼠体内药动学研究 [J]. 中草药, 2013, 44(14): 1939-1943. |
| [13] | 常 颖, 郑启泰, 吕 扬. X射线衍射分析技术在药物研究中的应用 [J]. 物理, 2007, 36(6): 452-459. |
| [14] | 张洪亮. 葫芦素B在体内外对肝癌细胞的生长抑制作用 [D]. 南京: 中国药科大学, 2008. |
 2015, Vol. 46
2015, Vol. 46



