2. 肯塔基大学药学院, 莱克星顿, 美国 肯塔基州 40503
2. College of Pharmacy, University of Kentucky, KY 40503, USA
黄酮类化合物是广泛存在于药用植物中的一类化合物,大多与糖类结合为苷存在,多具有调血脂、扩张冠脉、止血、镇咳、祛痰、降低血管脆性等活性。银杏、红花、黄芩、陈皮等常用中药中都含有此类成分[1]。此外,黄酮类化合物具有多种多样的生物学功能,如调节植物生长、保护植物免受紫外线的损伤以及作为植物抗毒素(phytoalexin)和活性氧清除剂等。目前药用植物黄酮类化合物的研究主要集中在提取工艺、成分分析及药理活性方面[2]。随着分子生物学的迅速发展,分子生物学也开始涉及到药用植物的研究,中药有效成分研究越来越趋向于有效成分的合成及调控机制的研究。黄酮类化合物多种多样的生物活性备受研究者的关注,因此黄酮类化合物的生物合成途径的研究开始较早,并取得了较大进展。本文对药用植物黄酮类化合物代谢合成途径及功能基因的研究进展进行综述,以期为黄酮类化合物进一步研究提供参考。
1 黄酮类化合物代谢合成途径黄酮类化合物是一类由苯丙素起始的植物次生代谢产物,其研究十分广泛。从结构上来说,黄酮类化合物包括2-苯基苯并吡喃类(2-phenylchromans)和3-苯基苯并吡喃类(3-phenylchromans)。2-苯基苯并吡喃类即黄酮类(flavonoids),包含黄烷酮(flavanones)、黄酮(flavones)、黄酮醇(flavonols)、黄烷醇(flavanol)以及花青素(anthocyanidins);3-苯基苯并吡喃类即异黄酮类(isoflavonoids),包含异黄酮素(isoflavone s)、异黄烷类(isoflavans)以及紫檀素类(pterocarpans)。
黄酮类化合物合成代谢途径中的相关基因可以分为2类:一类是编码酶的结构基因,另一类是调控基因。黄酮类化合物的合成途径见图 1。
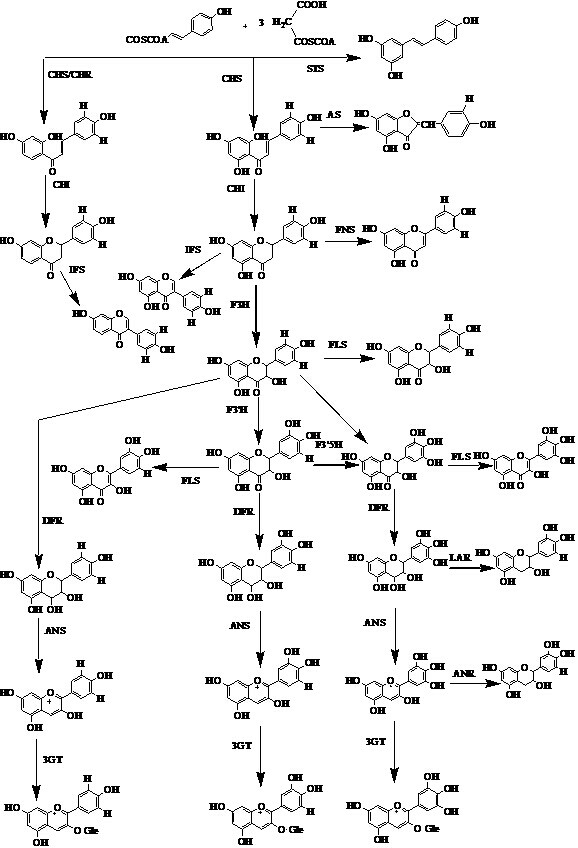
|
图 1 黄酮类化合物代谢合成途径 Fig. 1 Metabolic synthesis pathway of flavonoids |
查耳酮合成酶(chalcone synthase,CHS)催化该途径的第1步。查耳酮异构酶(chalcone isomerase,CHI)催化分子内的环化反应。异黄酮合成酶(isoflavone synthase,IFS)催化CHI催化合成的(2S)-黄烷酮(5, 7, 4′-三羟基查耳酮)或 (2S)-5-脱氧黄烷酮(7, 4′-二羟基查耳酮)的B环从C-2位转移到C-3位,进而通过异黄酮脱水酶使杂环C-2, 3位形成双键。黄烷酮3羟化酶(flavanone 3-β-hydroxyalse,F3H)将CHI催化合成的 (2S)-黄烷酮或 (2S)-5-脱氧黄烷酮的C-3位羟基化,生成二氢黄酮醇。黄酮醇合成酶(flavonol synthase,FLS)催化黄酮结构中的C-3位羟基化,从而形成各种黄酮醇类物质。二氢黄酮醇还原酶(dihydroflavonol 4-reductase,DFR)是花青素(anthocyanidins)和鞣质(phlobaphenes)合成途径中的关键酶,是一个重要的分支点[3]。
2 药用植物黄酮类化合物代谢合成途径中的相关功能基因功能基因是DNA上编码蛋白质或RNA等具有特定功能产物的遗传信息的基本单位。功能基因包括能够转录成相应mRNA并编码蛋白的编码区和起调控作用的非编码区,在编码区上游有一小段核苷酸序列被称为启动子,是RNA聚合酶的结合位点,是转录的起始点,相应的在编码区下游有一小段核苷酸序列被称为终止子,是转录的终止点。功能基因的研究就是在了解基因结构的基础上,确定基因的功能,主要包括开放阅读框的确定、基因时空表达的调节机制以及表达产物的功能分析[4]。
黄酮类化合物代谢合成途径中的切入酶是CHS和IFS,其中,更准确地说IFS应该是2-羟基异黄烷酮合成酶(2-hydroxyisoflavanone synthase),是一种能催化芳基转移反应使黄酮类化合物转化成异黄酮类化合物的细胞色素P450。基本碳骨架通过羟基化、糖基化、甲基化、酰化和异戊烯化的取代形成了结构多样的(异)黄酮。在某些情况下,通过聚合形成了花青素和鞣质。催化这些取代反应的酶包括CHI、F3H、FLS以及DFR[5]。
2.1 CHS基因CHS是黄酮类化合物合成途径中的第1个关键酶,也是药用植物中研究较多的一个基因。它催化该途径的第1步,即将3分子的丙二酰辅酶A(malonyl-CoA)和1分子的4-香豆酰辅酶A(4-coumaroyl-CoA)结合形成第1个具有C13架的黄酮类化合物——查尔酮,该产物进一步衍生转化形成了各类黄酮类化合物[6]。CHS基因表达除了参与植物的生长发育,也参与了植物抵抗外来压力,如UV、细菌或真菌感染等[7]。CHS在植物中广泛存在,第1个植物CHS基因序列是1983年在荷兰芹中发现的。到目前为止,GenBank数据库中已经有4 000多条植物CHS的核苷酸序列。
钟德馨等[8]从决明Cassia tora Linn. 的新鲜子叶中提取基因组DNA作为模板,利用一对特异引物进行PCR扩增,然后克隆测序得到决明CHS基因全长。测序结果表明,决明CHS基因全长为1 766 bp,含有2个外显子和1个内含子。将其提交GenBank,登录号为JX676773。决明CHS基因的内含子位于188~765 bp,长度为578 bp,内含子的剪切符合GU-AG规律,含有多个酶切位点和顺式调控元件,可能与决明CHS基因的表达调控有关。CHS基因内含子具有多态性,可能是由不同植物存在多样性的生活史与生活环境导致的。决明CHS基因外显子2 较为保守,编码几乎所有CHS的功能位点。
文海涛等[9]以广东道地药材化橘红基源化州柚Citrus grandis Tomentosa为研究材料,采用RT-PCR技术克隆获得了CHS基因,并对其进行了序列分析。结果表明化州柚CHS基因编码区全长1 176 bp,编码391个氨基酸残基,与同样来源于柑橘属的CHS基因序列同源性高于98%,与其他科植物CHS基因同源性也达到70%以上,且化州柚CHS基因编码的氨基酸序列具有CHS家族的全部4个保守序列。
2.2 CHI基因CHI是黄酮类化合物代谢途径中的第2个关键酶。它催化分子内的环化反应,将CHS催化合成的查耳酮(4, 2′, 4′, 6′-四羟基查耳酮)或6′-脱氧查耳酮(4, 2′, 4′-三羟基查耳酮)的C-2′位羟基失氢与β位断裂的碳碳双键形成“-O-”,从而分别形成分子内环化的 (2S)-黄烷酮或 (2S)-5-脱氧黄烷酮[10]。一般将CHI分为2种类型,I型CHI只能以查耳酮为底物,II型CHI既可以查耳酮为底物,也可以6′-脱氧查耳酮为底物[11]。第1个CHI基因是1987年Mehdy等[12]利用抗体技术从法国豌豆中分离出来的,到目前为止,GeneBank数据库中已经有1 400多条植物CHI的核苷酸序列。
刘春霞等[13]采用RT-PCR和RACE技术,获得了灯盏花Erigeron breviscapus (Vant.) Hand. -Mazz. CHI cDNA全序列,GenBank登录号为GU208823.1,序列全长996 bp,开放阅读框为594 bp,编码197个氨基酸,3-Race有一个多聚腺苷酸加尾信号。应用软件预测该基因编码蛋白质相对分子质量约为2.16×104,理论等电点为4.78。该基因编码的蛋白无跨膜结构域,其二级结构的主要构件为α-螺旋和随机卷曲。对其三级结构进行了建模,表明其结构与苜蓿CHI的三级结构相似。同时根据灯盏花CHI N端序列变化的特征,提出了灯盏乙素的合成可能与CHI在细胞亚结构的定位及其与合成代谢相关酶形成复合酶的特异性有关。
刘长英等[14]采用同源克隆法和抑制PCR法克隆桑树Morus alba L. 查耳酮异构酶基因(MaCHI)全序列。该基因的基因组序列全长2 402 bp,包含2 112 bp长的开放阅读框和290 bp长的3′UTR序列,开放阅读框由4个外显子和3个内含子组成,该基因编码219个氨基酸。预测MaCHI编码蛋白质的相对分子质量为2.38×104,理论等电点为5.29。采用RT-PCR法分析MaCHI在不同组织中的表达水平,在叶片和果中的表达量较高,在根中表达量较低。构建pET-28a (+)-MaCHI原核表达重组质粒,并在大肠杆菌中诱导表达。
2.3 IFS基因IFS是异黄酮合成途径的关键酶,其催化CHI合成的(2S)-黄烷酮或 (2S)-5-脱氧黄烷酮的B环从C-2位转移到C-3位,进而通过异黄酮脱水酶使杂环C-2, 3位形成双键[15]。到目前为止,GeneBank数据 库中收录了50多条IFS的核苷酸序列。
张丹凤[16]用还原型谷胱甘肽处理蒙古黄芪Astragalus membranaceus (Fisch.) Bunge var. mongholicus (Bunge) P. K. Hsiao根部,诱导IFS基因表达,提取总RNA。采用同源克隆方法,首先利用RT-PCR技术得到了673 bp的序列;再通过cDNA末端快速扩增技术(RACE)技术获得长度为1 995 bp的IFS基因,并命名为MHIFS。MHIFS包含一个完整的开放阅读框(l 578 bp),编码525个氨基酸,推导肽链的相对分子质量约为6.0×104。经同源查找,通过相关的生物信息学分析,在核苷酸水平上,蒙古黄芪IFS基因全长cDNA序列与大豆、鹰嘴豆、豌豆、刺甘草异黄酮合成酶基因分别有82%、84%、82%、83%的相似性;在氨基酸水平上,蒙古黄芪IFS与大豆、鹰嘴豆、豌豆、刺甘草IFS的氨基酸序列分别有80%、83%、79%、83%的同源性和88%、89%、87%、88%的相似性。对其进行氨基酸保守区域分析,结果表明其与其他豆科植物的IFS一样都含有3个保守区域。
2.4 F3H基因F3H是黄酮类化合物代谢途径上的关键酶,将CHI催化合成的 (2S)-黄烷酮或 (2S)-5-脱氧黄烷酮的C-3位羟基化,生成二氢黄酮醇[17]。F3H基因是整个黄酮类化合物代谢途径的中枢位点,调控着合成途径中的代谢流向。它催化生成二氢黄酮醇,而二氢黄酮醇是黄酮类化合物生物合成中生成黄酮、花色素和异黄酮等黄酮类化合物的重要中间产物。到目前为止,GeneBank数据库中收录了800多条植物的F3H的核苷酸序列。
本课题组根据桑科植物F3H基因序列,设计引物PCR克隆得到桑Morus alba L. 的F3H基因,将测序得到的F3H基因片段与Genbank所登录F3H基因的序列进行同源性比较,发现同源性较高,达97%左右,认为该序列是F3H基因的片段。实验首次克隆并表达了F3H基因,为桑叶的分子生物学研究提供了一定的依据[18]。
雷栀[19]通过RACE成功克隆了粘毛黄芩Scutellaria viscidula Bunge. 类黄酮生物合成途径中F3H,命名为SvF3H,并登录到Genbank,获得了基因序列登录号FJ432699。SvF3H全长1 317 bp,包括5′和3′非翻译区、polyA尾巴和一个编码1 050 bp的开放阅读框,它编码1条350个氨基酸残基的F3H蛋白质,预测分子式为C1751H2732N474O524S18,相对分子质量为3.382×104,等电点为5.41。TargetP分析结果显示SvF3H定位于细胞质基质,且无转运肽。ProtScale预测SvF3H是疏水性蛋白质。通过GOR预测SvF3H的二级结构,结果显示SvF3H含有31.43%的α-螺旋、22.29%的延伸链和46.29%的无规则卷曲。分析SvF3H蛋白的三级结构显示,SvF3H亚基包含多个重要的功能结构域,如Fe2+结合位点和2-酮戊二酸结合位点等。用Neighber-joining方法构建了系统进化树,SvF3H 很清楚地和其他植物中的F3H合为一簇,从分子水平上验证了所选植物的F3H可能起源于同一个祖先,也反映出植物间的黄酮醇类化合物量的差异与植物间亲缘关系可能存在一定相关性。
2.5 FLS基因2.5 FLS基因
FLS作为黄酮类化合物合成途径与儿茶素合成途径的桥梁,在植物中高度保守[20],它催化黄酮类结构中的C-3位羟基化,从而形成各种黄酮醇类物质。Britsch等[21]用从欧芹细胞中提取的酶作用于二氢黄酮醇,第1次体外检测到二氢黄酮醇转变为黄酮醇。到目前为止,GeneBank数据库中收录了100多条植物的FLS的核苷酸序列。
乔中全等[22]根据已知的其他物种黄酮醇合成酶cDNA保守序列设计引物,用RT-PCR技术从金银花Lonicerae Flos 叶片中扩增获得黄酮醇合成酶基因部分cDNA序列,再用RACE技术获得其两端序列。序列拼接得到完整的1 248 bp FLS基因,根据获得的序列,设计引物扩增获得1 001 bp的开放阅读框,编码333个氨基酸。序列分析显示,金银花黄酮醇合成酶与烟草、马铃薯和桔梗的同源性分别为86%、83%和80%,与其他物种的同源性也在80%左右,表明不同物种中FLS基因具有高度同源性。
李广平等[23]克隆银杏Ginkgo biloba L. FLS基因启动子序列的基础上,利用生物信息学方法,分析了该基因的启动子结构。结果表明FLS基因启动子中包含了3个MYB转录因子结合位点和9个光信号应答位点,为确立银杏FLS基因与CHI基因间的共调控关系及揭示FLS基因应答光信号的转录调控机制提供了分子基础。
2.6 DFR基因DFR是花青素和鞣质合成途径中的关键酶,是一个重要的分支点[24]。Reilly等[25]于1985年采用转座子标签法从玉米和金鱼草中首次分离出了DFR基因。到目前为止,GenBank数据库中收录了600多条植物的DFR核苷酸序列。
樊云芳等[26]根据已报道植物DFR基因cDNA序列的保守区域设计引物,对宁夏枸杞Lycium barbarurn Linn. DFR基因进行克隆及序列分析。结果表明,宁夏枸杞DFR基因cDNA全长1 140 bp,有1个编码1 116 bp的开放阅读框,编码1个长372个氨基酸的蛋白质;氨基酸序列的聚类分析显示,宁夏枸杞LbDFR与马铃薯、烟草、蕃茄等茄科植物的DFR亲缘关系较近,其中与马铃薯DFR亲缘关系最近,相似性为92%;通过编码蛋白的三级结构预测,该蛋白为单体模式,具有酶学的生物特征;宁夏枸杞LbDFR在宁夏枸杞的根、茎、叶等组织中广泛表达,为组成表达型基因。
潘丽晶等[27]根据已报道的石斛Dendrobium nobile Lindl. DFR基因序列设计引物,从石斛中分离了DFR基因。将该基因序列正向与反向连接到植物表达载体pCAMBIAl301中,并由组成型启动子CaMV35S驱动,成功构建了DFR基因的正义和反义植物表述载体pCSDN1和pCSDN2,并导入根癌农杆菌Agrobacterium tumefacien EHAl05,以期利用转基因技术培育出石斛花色新品种。
3 结语与展望迄今,有关黄酮类化合物代谢合成途径及相关功能基因都已得到证实并进行了系统的研究,从而使得黄酮类化合物代谢合成途径成为植物次级代谢中研究得最为深入的代谢系统之一。在药用植物中,黄酮类化合物代谢合成途径及相关基因的研究处于起步阶段,但也取得了较大的成果,为药用植物黄酮类化合物合成途径及相关功能基因的深入研究奠定了基础。药用植物黄酮类化合物代谢合成途径中相关基因的研究方法主要是通过已有的相关基因序列,设计特异性的引物,PCR扩增得到序列,再通过RACE法等得到全长序列,并将测序结果进行生物信息学分析,最后再将基因在植物中进行不同的表达,以期得到有效成分累积及调控机制。常用在线软件http://www.ncbi.nlm.nih.gov/gorf/gorf.html、http://emboss.bioinformatics.nl/cgi-bin/emboss/getorf、http://genes.mit.edu/GENSCAN.html等,可找出测序所得基因的开放阅读框,并可获得其编码蛋白质序列;在线软件http://blast.ncbi.nlm.nih.gov/Blast. gi,将预测蛋白序列结果与NCBI中已登录的物种进行对比分析;软件MEGA5.10可构建进化树;在线软件http://web.expasy.org/protparam/、http://psort. hgc.jp、http://www.cbs.dtu.dk/services/SignalP等,可分析其编码蛋白质序列的一级结构;http://www. cbs.dtu.dk/services/TMHMM可分析其编码蛋白质序列的二级结构。
目前国内药用植物的研究还是集中于化学成分研究,分子生物学研究处于起步阶段,今后可以将化学成分分析与基因表达分析结合起来,研究药用植物有效成分的累积和调控机制。功能基因是后基因时代植物基因组研究的最活跃、最核心的领域之一。它强调发展和应用整体(基因组水平或系统水平)实验方法分析基因组序列信息,阐明基因功能。其基本策略从过去的单一基因或蛋白质上升到系统角度研究所有基因或蛋白质[28]。在药用植物功能基因研究中,与基因组研究相比,最为活跃的研究领域是与活性成分形成关系最密切的生物合成相关基因克隆研究。由于临床上对天然药物的实际需求不断增加,以及基因克隆与表达技术的发展,近年来药用植物功能基因的克隆呈现快速增长的趋势[29]。通过生物合成途径的研究,推动药用植物次生代谢工程的发展,提高中药材的品质,为中药的良种选育、规范化种植和质量控制提供技术支撑,将是中药材品质研究的前沿和热点课题。
| [1] | 王青云. 中草药的有效成份探讨[J]. 内蒙古中医药, 2010(13): 105-106. |
| [2] | 赵娅敏, 马好文, 孟淑娟. 紫花苜蓿中黄酮类化学成分及其生物活性研究进展[J]. 中草药, 2013, 44(22): 3245-3252. |
| [3] | Schijlen E G W M, de Vos C H R, van Tunenet A J, et al. Modification of flavonoid biosynthesis in crop plants[J]. Phytochemistry, 2004, 65: 2631-2648. |
| [4] | 周小龙, 郑云云, 董迎辉, 等. 海洋贝类功能基因的研究进展[J]. 海洋科学, 2012, 36(12): 99-107. |
| [5] | Dixon R A, Pasinetti G M. Flavonoids and isoflavonoids: from plant biology to agriculture and neuroscience[J]. Plant Physiol, 2010, 154(2): 453-457. |
| [6] | Koes R E, Francesca Q, Joseph N M. The flavonoid biosynthetic pathway in plants: function and evolution[J]. Bioessays, 1994, 16: 123-132. |
| [7] | 钟德馨, 方袁梦梦, 郭壮浩. 决明查尔酮合成酶全长基因序列的克隆与分析[J]. 生物技术通报, 2013, 29(5): 99-104. |
| [8] | Pierre P, Thierry G, Bentrice I E, et al. Crystal structure of grape dihydroflavono1 4-Reductase, a key enzyme in flavonoid biosynthesis[J]. J Mol Biol, 2007, 368: 1345-1357. |
| [9] | 文海涛, 赵红英, 肖凤霞, 等. 化州柚查尔酮合成酶基因克隆与序列分析[J]. 生物学杂志, 2011, 28(1): 39-41. |
| [10] | Jez J M, Bowman M E, Dixon R A, et al. Structure and mechanism of the evolutionarily unique plant enzyme chalcone isomerase[J]. Nat Struct Biol, 2000, 7(9): 786-791. |
| [11] | Shimada N. A cluster of genes encodes the t wo types of chalcone is omerase involved in the biosynthesis of general falavonoids and legume specific 5-deoxy (iso) flavonoids in Lotus japonicus[J]. Plant Physiol, 2003, 131(3): 941-951. |
| [12] | Mehdy M C, Lamb C J. Chalcone isomerase cDNA cloning and mRNA induction by fungal elicitor wounding and infection[J]. EM-BO J, 1987, 6(6): 1527-1533. |
| [13] | 刘春霞, 王 玥, 崔明昆, 等. 灯盏花CHI的克隆及其生物信息学分析[J]. 武汉植物学研究, 2010, 28(6): 682-690. |
| [14] | 刘长英, 赵爱春, 李 军, 等. 桑树查尔酮异构酶基因的克隆与原核表达分析[J]. 林业科学, 2013, 49(2): 39-45. |
| [15] | Jung W. Identification and expression of isoflavone synthase, the key enzyme for biosynthesis of isoflavones in legumes[J]. Nat Biotechnol, 2000, 18(2): 208-212. |
| [16] | 张丹凤. 蒙古黄芪异黄酮合成酶基因的克隆及序列分析[D]. 福州 福建农林大学, 2004. |
| [17] | Tmothy A, Edwina C. Genetics and biochemistry of anthocyan in biosynthesis[J]. Plant Cell, 1995, 7: 1071-1083. |
| [18] | 刘 薇. 桑叶化学成分的动态变化与PAL、F3H基因的表达水平研究[D]. 成都: 成都中医药大学, 2012. |
| [19] | 雷 栀. 黄芩苷生物合成途径中关键酶基因的克隆与序列分析[D]. 重庆: 西南大学, 2009. |
| [20] | Forkmann G, Martens S. Metabolic engineering and applications of flavonoids[J]. Curt Opin Biotechno1, 2001, 12(2): 155-160. |
| [21] | Britsch L, Heller W, Grisebach H. Conversion of flavanon to flavone. dihydroflavonol and flavonol with an enzyme system from cell cultures of parsley[J]. Zeitschrift Naturforsch, 1981, 36: 742-750. |
| [22] | 乔中全, 何 钢, 王晓明, 等. 金银花黄酮醇合成酶基因全长克隆及其序列分析[J]. 生物技术通报, 2012, 28(4): 63-68. |
| [23] | 李广平, 张兴青, 曹福亮. 银杏FLS基因启动子克隆及序列分析[J]. 中国农学通报, 2010, 26(23): 77-80. |
| [24] | Cynthia A D, Jason B, Timothy B, et al. Arctic mustard flower color polymorphism controlled by petalspecific downregulation at the threshold of the anthocyanin biosynthetic pathway[J]. PLoS One, 2011, 6(4): e18230. |
| [25] | Holton T A, Cornish E C. Genetics and biochemistry of anthocyanin biosynthesis[J]. Plant Cell, 1995, 7(7): 1071-1083. |
| [26] | 樊云芳, 陈晓军, 李彦龙, 等. 宁夏枸杞DFR基因的克隆与序列分析[J]. 西北植物学报, 2011, 31(12): 2373-2379. |
| [27] | 潘丽晶, 范干群, 张妙彬, 等. 石斛兰DFR基因植物表达载体的构建[J]. 生物技术通报, 2009, 25(8): 71-75. |
| [28] | 王景雪, 孙 毅, 徐培林, 等. 植物功能基因组研究进展[J]. 生物技术通报, 2004, 20(1): 18-22. |
| [29] | Andy P, Brandle S, Kehr J, et al. Amino acid analysis in five pooled single plant cell samples using capillary electrophoresis coupled to laser induced fluorescence detection[J]. Transgenic Res, 2000, 9: 243-260. |
 2014, Vol. 45
2014, Vol. 45


