2. 河北医科大学药学院, 河北 石家庄 050017
2. College of Chemical Engineering, Shijiazhuang College, Shijiazhuang 050017, China
自然界生物在其漫长的进化过程中合成了许多结构新颖、各异的次生代谢产物,这些次生代谢产物结构的多样性使其不仅具有各种各样不同的生物活性,还常常被发现有全新的作用机制。临床上应用的许多药物都直接或间接来源于天然产物,天然产物已成为发现治疗重大疾病药物或重要先导化合物的主要源泉。天然产物在人类发展史上扮演着十分重要的角色,曾发现了一些影响人类历史进程和命运的重要分子,如紫杉醇、银杏内酯、岩沙海葵毒素[1, 2, 3]。河豚毒素(tetrodotoxin,TTX)是具有非常复杂且新颖、奇特结构以及特殊生物活性的著名小分子天然产物[4],其结构的确定、不对称全合成被科学界公认为是20世纪天然产物研究的伟大成就之一。本文主要回顾著名的天然产物河豚毒素的发现与研究历史,以纪念这一伟大发现以及为此研究做出贡献的科学家,同时期望为有关科技工作者以启示。
1 河豚鱼简介河豚Musculus fugu(puffer fish,globefish,balloonfish,图 1),学名河鲀,在中国的俗称为肺鱼、刺豚鱼、气鼓鱼、气泡鱼、吹肚鱼、鸡泡鱼、青郎君等。河豚鱼的种类很多,一般泛指鲀形目(Tetraodontiformes)中东方鲀属Takifugu的鱼类,属下有25种,从北纬45°到南纬45°都有分布,此属鱼类遇到危险时,会以TTX抵抗敌人。很久以前人们就发现河豚鱼味道鲜美,但是食用后很可能会导致食用者死亡,所以在中国、日本等地是禁止食用的。很多海洋食品中毒事件都与TTX有关,河豚中毒是鱼类中毒中最为严重的一种。含有TTX相关器官的毒性强弱也有差异:卵巢>肝脏>脾脏>血液>鳃>皮>精巢[5]。河豚一般在冬春季节产卵,此时河豚的肉味最鲜美,但是TTX的量也最高。TTX中毒后的主要症状一般先是感觉神经麻痹,血压下降、脉搏迟缓、呼吸困难,继而运动神经麻痹,使肢体无力甚至不能运动,严重者因中枢麻痹导致呼吸停止而死亡。据调查,TTX中毒的死亡率约为60%,且死亡多发生在中毒后6~24 h内,若能存活24 h以上则预后良好。据研究,河豚是利用体内产生的TTX来抵御其他生物的侵食或者捕食其他的生物,但是TTX是如何在这些生物体内产生或积聚的,目前仍未能确定[6, 7]。

|
图1 TTX的化学结构 Fig. 1Chemical structure of TTX |
1909年,日本科学家田原良纯(Yoshizumi Tahara)博士发现并首次分离得到TTX[6]。1955年日本的平田义正(Hirata Yoshimasa)教授从河豚鱼中成功分离出纯品TTX[8]。TTX粗品的提取方法基本流程是先使用水浸泡、酸提取、盐沉淀除杂质,再用氨水沉淀,得到TTX粗品。随着科学的发展和技术的更新,TTX纯化工艺有很大改进,主要是采用氧化铝柱色谱、活性炭柱色谱、大孔树脂、离子交换树脂或高效液相色谱等方法。
TTX为无色棱柱状晶体,对热不稳定,难溶于水,可溶于弱酸的水溶液,在碱性溶液中易分解,在酸性较强溶液中也不稳定。将TTX加热到220 ℃以上会发生炭化。目前已经从多种不同属种生物中分离出TTX,除河豚外,还在如蝾螈(western newts)、蟾蜍(toads)、蓝圈章鱼(blue-ringed octopuses)、海星(sea stars)、天使鱼(angelfish)、巨扁虫(polyclad flatworm)、箭虫(arrow worms)、蠕虫(ribbonworms)、蟹类(xanthid crabs)等生物中发现TTX[9, 10, 11] 。
3 TTX的结构确定20世纪60年代天然产物研究的伟大成就之一就是完成了TTX的结构确定。1964年以前日本和美国学者对TTX的结构进行了深入的研究,报道了多个TTX的可能结构和部分结构。1964年在日本京都召开的第3届IUPAC国际天然产物化学大会上,日本的平田义正(Hirata Yoshimasa)[12]和津田恭介(Tsuda Kyosuke)[13]、美国的Woodward[14, 15]等3个研究团队同时报道了TTX的正确结构,震惊了世界。
TTX的分子式C11H17N3O8,相对分子质量为319,IUPAC化学名称为 (4R, 4aR, 5R, 6S, 7S, 8S, 8aR, 10S, 12S)-2-azaniumylidene-4, 6, 8 12-tetrahydroxy- 6-(hydroxymethyl)-2, 3, 4, 4a, 5 6, 7, 8-octahydro- 1H-8a, 10-methano-5, 7-(epoxymethanooxy) quinazolin- 10-olate。虽然TTX的分子并不大,但由于其结构新颖特殊,在有机溶剂和水中都不易溶解而仅溶于醋酸等酸性溶剂,并且在碱性和强酸性溶剂中不稳定,加之核磁共振技术在20世纪60年代刚刚开始应用,给TTX的结构鉴定带来了相当大的困难。为了确定其结构,平田、津田和Woodward3个研究团队均分别采用制备衍生物及进行X衍射实验方法等,研究历经达15年之久。TTX是一种结构很复杂的笼形原酸酯类生物碱[16],分子中几乎所有的碳原子均有不对称取代,在游离状态下以3种形态相互平衡的混合物存在(图 1)[17]。
4 TTX的生物活性TTX是在自然界中发现的毒性较高的物质之一,也是发现最早的小分子海洋毒素,研究表明[18, 19],小鼠po的LD50为334 μg/kg、im的LD50为8 μg/kg,其毒性约是氰化钠(NaCN)的100倍。研究表明,TTX属小分子非蛋白类成分神经毒素,服用后首先迅速由胃肠道吸收,然后进入血液中,迅速抑制中枢神经和末梢神经系统,引发神经传导阻滞,造成神经麻痹,严重的会引发脑干神经麻痹导致呼吸循环衰竭而死亡,具有潜伏期短、死亡率高的特点。深入药理研究表明,TTX是一种电压敏感的钠通道(voltage gated sodium channels,VGSC)[20]外口特异性阻滞剂,在较低浓度(1×10-8 mol/L)下就能通过与细胞膜上受体(RTOX)结合,再通过关闭机制(gating mechanism)使钠离子通道h闸门(h-gate)关闭,即选择性抑制钠离子通过神经细胞膜而允许钾离子、氯离子通过,具有高度专一性,使细胞膜失去可极化状态,从而抑制甚至阻断了神经-肌肉的兴奋与传导过程,导致神经肌肉活动障碍,严重者可发生麻痹状态并可引起呼吸中枢麻痹、血压下降、脉搏迟缓,最终可能因呼吸停止和循环衰竭而死亡[21]。TTX是一种电压敏感的Na+通道外口特异性阻滞剂,其麻醉作用是普鲁卡因(Procaine)的4 000倍,可代替吗啡、杜冷丁起镇痛作用,且不成瘾,并有解痉、降压、抗心律失常等作用。在医学方面,TTX通过阻断快速钠离子通道来治疗某些心律失常具有潜在可能性。最新研究表明TTX是神经生理学、肌肉生理学和钠离子通道药理学研究的非常有用的工具。已经证明TTX可有效治疗某些疾病如癌症晚期[22]造成的疼痛等。虽然TTX是重要的选择性钠离子通道抑制剂,然而最近的研究表明,TTX也表现出对犬类心脏细胞L型钙离子通道的阻断作用[23]。TTX的更多应用也在不断研究开发中。
5 结构与生物活性的构-效关系TTX的分子结构中有一个胍基(guanidyl),是其活性所必须的基团[24, 25]。胍基是重要的正电中心,与受体作用时发挥接受电子的重要作用,胍基在生理条件下通过质子化形成正电活性区域,与专一受体蛋白的负性羟基结合。有证据表明,TTX的胍基对阻断钠离子通道起决定性作用。胍基附近C-4位上的羟基也是供电子的主要负电部位,当其被烷氧基、氨基或氢等基团取代时,会使TTX的生物活性降低。另外,C-10能与周围的3个氧原子形成的半缩醛内酯环结构,是另一个接受电子的区域,缺少这一内酯环结构将使毒性明显降低[26]。
6 TTX的全合成TTX独特复杂的结构和显著的生物活性吸引了大批有机合成化学家的目光,被认为是一个极富挑战性和吸引力的研究课题,同时也是非常令人可畏的全合成目标。1972年,当时日本名古屋大学(Nagoya University)的岸义仁教授(现哈佛大学终身教授)和他的博士生福山透(Tohru Fukuyama)首先报道完成了TTX外消旋体的全合成。随着不对称合成(asymmetric synthesis)的迅速发展,在2003年,美国斯坦佛大学(Stanford University)的Du Bois教授和日本名古屋大学的矶部稔(Minoru Isobe)教授(现为台湾清华大学教授)分别采用不同的路线完成了TTX的不对称全合成。特别提出的是,他们都事先应用逆合成分析(retrosynthetic analysis)设计了合成路线[27]。
岸义仁教授在全合成TTX时,以对-苯二醌取代的乙酮肟和丁二烯为初始底物,先采用Diels-Alder [4+2] 环加成反应构建2个六元环骨架(图 2)[28, 29]。Du Bois教授首先采用的是Diels-Alder
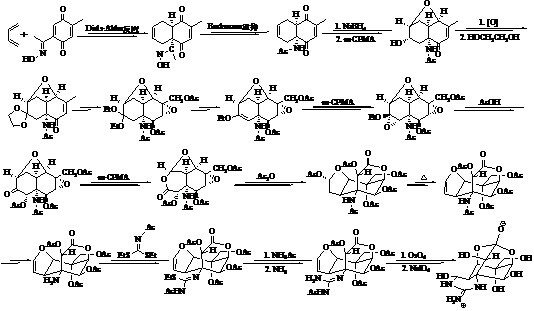
|
图 2 岸义仁全合成路线 Fig. 2 Kishi’s total synthesis route |
加成反应路线(图 3)[30],并在合成中成功发现并应用了金属铑(Rh)催化剂对C-H键转化为胺基的转化反应,并揭示了这种金属催化剂在复杂天然产物全合成中更可能多的潜在应用。矶部稔教授[31, 32, 33]首先以乙酰氧基-D-葡萄烯糖(2-acetoxy-tri-O- acetyl-D-glucal)作为手性起始物,通过Claisen重排和选择性羟基化反应构建高度羟基化的环已烷环。通过含有氨基甲酸酯(carbamate)和不饱和酯的分子内的共轭加成反应构建含氮结构。通过高选择性的立体反应,以及在模拟可能的生物有机合成过程中羟基被特定保护,从而控制TTX分子中所有立体中心(图 4)。
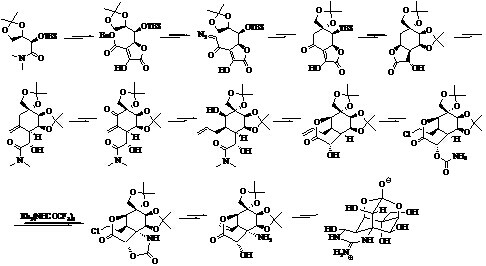
|
图 3 Du Bois教授不对称全合成路线 Fig. 3 Du Bois’s asymmetric total synthesis route |
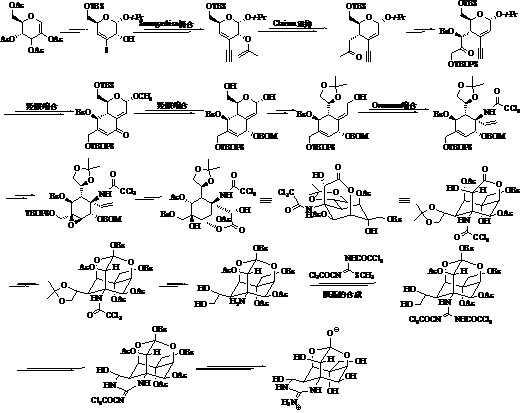
|
图 4 矶部稔不对称全合成路线 Fig. 4 Isobe’s asymmetric total synthesis route |
随后又有采用不同的合成路线完成了TTX的不对称全合成的报道,如从肌醇(myo-inositol)和葡萄糖出发通过立体控制反应合成了TTX[34, 35, 36]。TTX的不对称全合成的成功曾被称为有机合成化学的伟大突破和伟大成就之一。
7 结语天然产物结构的多样性和生物活性的多样性不仅可以直接提供新药或药物先导化合物,更可以为化学合成和结构修饰提供灵感,天然产物在抗癌、抗感染、免疫和中枢神经系统药物研发等方面已经显示具有很大的优势。大自然是最优秀的合成化学家,仅以少数几个结构单元以及温和的条件就可以合成数量无限、结构复杂性和多样性远远超出想象的立体化学专一的天然化合物,向大自然学习已逐渐成为科学家们的共识[37, 38]。随着对天然产物越来越深入的研究,天然产物必将为人类的健康与发展做出新的更大的贡献。
| [1] | 史清文. 天然药物化学史话: 紫杉醇[J]. 中草药, 2011, 42(10): 1878-1884. |
| [2] | 郭瑞霞, 李 骘, 李力更, 等. 天然药物化学史话: 银杏内酯[J]. 中草药, 2013, 44(6): 641-645. |
| [3] | 李 骘, 刘 诣, 李力更, 等. 天然药物化学史话: 岩沙海葵毒素的全合成[J]. 中草药, 2013, 44(18): 2630-2633. |
| [4] | Narahashi T, Moore J W, Frazier D T. Dependence of tetrodotoxin blockage of nerve membrane conductance on external pH[J]. J Pharmacol Exp Ther, 1969, 169(2): 224-228. |
| [5] | 程苏云, 丛黎明, 蒋贤根, 等. 浙江省沿海河豚鱼生态分布和毒素检测[J]. 浙江预防医学, 2003(10): 1-2. |
| [6] | Chau R, Kalaitzis J A, Neilan B A. On the origins and biosynthesis of tetrodotoxin[J]. Aquat Toxicol, 2011, 104: 61-72. |
| [7] | Clark R F, Williams S R, Nordt S P, et al. A review of selected seafood poisonings[J]. Undersea Hyperb Med, 1999, 26(3): 175-84. |
| [8] | 平田义正. 天然物有机化学[M]. 东京: 岩波书店, 1981. |
| [9] | Skye K, Azadeh F. Tetrodotoxin and Maculotoxin[M]. Albuquerque: University of New Mexico, 2007. |
| [10] | Noguchi T, Arakawa O, Takatani T. TTX accumulation in pufferfish[J]. Comp Biochem Physiol Part D: Genom Proteom, 2006, 1(1): 145-152. |
| [11] | Noguchi T, Hashimoto Y. Isolation of tetrodotoxin from a goby Gobius criniger[J]. Toxicon Off J Int Soc Toxinol, 1973, 11(3): 305-307. |
| [12] | Goto T, Kishi Y, Takahashi S, et al. Tetrodotoxin. XI[J]. Tetrahedron, 1965, 21: 2059-2088. |
| [13] | Tsuda K, Ikuma S, Kawamura M, et al. Tetrodotoxin. VⅡ. On the structures of tetrodotoxin and its derivatives[J]. Chem Pharm Bull, 1964, 12: 1357-1374. |
| [14] | Woodward R B. The structure of tetrodotoxin[J]. Pure Appl Chem, 1964, 9: 49-74. |
| [15] | Woodward R B, Gougoutas J Z. The structure of tetrodotoxin[J]. J Am Chem Soc, 1964, 86(22): 5030. |
| [16] | Bower D J, Hart R J, Matthews P A, et al. Nonprotein neurotoxins[J]. Clin Toxicol, 1981, 18(7): 813-863. |
| [17] | Mosher H S. The chemistry of tetrodotoxin[J]. Ann N Y Acad Sci, 1986, 479: 32-43. |
| [18] | Hwang D F, Jeng S S. Bioassay of tetrodotoxin using ICR mouse strain[J]. J Chin Biochem Soc, 1991, 20(2): 80-86. |
| [19] | Hwang D F, Noguchi T. Tetrodotoxin poisoning[J]. Adv Food Nutr Res, 2007, 52: 141-236. |
| [20] | Narahashi T, Moore J W, Scott W R. Tetrodotoxin blockage of sodium conductance increase in lobster giant axons[J]. J Gen Physiol, 1964, 47: 965-974. |
| [21] | Su X, Castle N A, Antonio B, et al. The effect of κ-opioid receptor agonists on tetrodotoxin-resistant sodium channels in primary sensory neurons[J]. Anesth Analgesia, 2009, 109(2): 632-640. |
| [22] | Hagen N A, du Souich P, Lapointe B, et al. Tetrodotoxin for moderate to severe cancer pain: A randomized, double blind, parallel design multicenter study[J]. J Pain Symptom Manage, 2008, 35(4): 420-429. |
| [23] | Hegyi B, Komaromi I, Kistamas K, et al. Tetrodotoxin blockade on canine cardiac L-type Ca2+ channels depends on pH and redox potential[J]. Marine Drugs, 2013, 11: 2140-2153. |
| [24] | Geffeney S L, Ruben P C. The structural basis and functional consequences of interactions between tetrodotoxin and voltage-gated sodium channels[J]. Mar Drugs, 2006, 4: 143-156. |
| [25] | Chau J, Ciufolini M A. The chemical synthesis of tetrodoxin: an ongoing quest[J]. Mar Drugs, 2011, 9(10): 2046-2074. |
| [26] | 陈常英, 丁晓琴, 潘心富, 等. 河豚毒素 (TTX) 及其衍生物的电子结构和构效关系及与石房蛤毒素 (STX) 的比较研究[J]. 化学学报, 1998, 56(2): 109-116. |
| [27] | Ulrich K. Synthesis of tetrodotoxin[J]. Angew Chem Int, 2004, 43(42): 5572-5576. |
| [28] | Kishi Y, Aratani M, Fukuyama T, et al. Synthetic studies on tetrodotoxin and related compounds. Ⅲ. A stereospecific synthesis of an equivalent of acetylated tetrodamine[J]. J Am Chem Soc, 1972, 94(26): 9217-9219. |
| [29] | Kishi Y, Fukuyama T, Aratani M, et al. Synthetic studies on tetrodotoxin and related compounds. IV. Stereospecific total syntheses of DL-tetrodotoxin[J]. J Am Chem Soc, 1972, 94(26): 9219-9221. |
| [30] | Hinman A, Du Bois J. A stereoselective synthesis of (-)-tetrodotoxin[J]. J Am Chem Soc, 2003, 125(38): 11510-11511. |
| [31] | Ohyabu N, Nishikawa T, Isobe M. First asymmetric total synthesis of tetrodotoxin[J]. J Am Chem Soc, 2003, 125(29): 8798-8805. |
| [32] | Nishikawa T, Urabe D, Isobe M. Natural product synthesis: An efficient total synthesis of optically active tetrodotoxin[J]. Angew Chem Int Edit, 2004, 43(36): 4782-4785. |
| [33] | Urabe T, Nishikawa T, Isobe M. An efficient total synthesis of optically active tetrodotoxin from levoglucosenone[J]. Chem Asian J, 2006, 1(1/2): 125-135. |
| [34] | Sato K, Asak S, Sugita N, et al. Novel and stereocontrolled synthesis of (±)-tetrodotoxin from myo-inositol[J]. J Org Chem, 2005, 70(19): 7496-7504. |
| [35] | Akai S, Seki H, Sugita N, et al. Total synthesis of (-)-tetrodotoxin from D-glucose: a new route to multi-functionalized cyclitol employing the Ferrier (Ⅱ) reaction toward (-)-tetrodotoxin[J]. B Chem Soc Jpn, 2010, 83(3): 279-287. |
| [36] | Sato K, Akai S, Yoshimura J. Stereocontrolled total synthesis of tetrodotoxin from myo-inositol and D-glucose by three routes: aspects for constructing complex multi-functionalized cyclitols with branched-chain structures[J]. Nat Prod Commun, 2013, 8(7): 987-998. |
| [37] | 史清文, 李力更, 霍长虹, 等. 天然药物化学研究与新药开发[J]. 中草药, 2010, 41(10): 1583-1589. |
| [38] | 史清文, 李力更, 霍长虹, 等. 天然药物化学学科的发展以及与相关学科的关系[J]. 中草药, 2011, 42(8): 1457-1463. |
 2014, Vol. 45
2014, Vol. 45


