紫背金盘Ajugae nipponensis Makino为唇形科筋骨草属Ajuga Linn. 1或2年生草本植物,又名白毛夏枯草、破血丹、筋骨草[1],紫背金盘广泛分布于欧、亚大陆温带地区,在我国主要分布在东部、南部及西南各省[2,3]。紫背金盘全草入药,具有清热解毒、凉血散瘀、消肿止痛之功效,有收缩血管、降血糖、调血脂、降压、抗肿瘤、抗炎、抑菌、抗病毒和促进创伤愈合等药理作用[4]。
紫背金盘作为一种常用药草,全草所含成分为二萜类、环烯醚萜类、植物蜕皮甾酮类以及其他类成分[5,6,7]。目前国内对紫背金盘的研究主要是紫背金盘提取物,如挥发油、水提物和醇提物的研究[8],还有关于次生产物对昆虫影响的研究[9],另有学者从形态学的角度,对紫背金盘叶表皮性状开展了相关研究[10],然而尚未见有关紫背金盘的组织培养研究的报道。本研究以紫背金盘不同外植体为材料,设计了不同的激素组合,筛选出适宜紫背金盘愈伤组织诱导的外植体类型、培养基类型及激素组合配方,建立了紫背金盘愈伤组织诱导及植株再生技术体系,为保护紫背金盘野生资源和发展人工栽培奠定了良好基础,也为遗传转化研究提供重要的科学依据。
1 材料供试材料于2012年3月采集于湖南省湘西自治州德夯,引种于吉首大学植物资源保护与利用湖南省高校重点实验室实验地内,经湖南吉首大学张代贵副教授鉴定为紫背金盘Ajugae nipponensis Makino,选取其茎尖、茎段和花序作为外植体。
2 方法 2.1 外植体的选择与处理选取健康紫背金盘植株的茎尖、茎段和花序为外植体,用10%洗衣粉溶液浸泡10 min后流水冲洗30 min,置于超净工作台。75%乙醇溶液处理10~15 s,再经0.1%汞水溶液消毒7 min,最后无菌水冲洗10次,每次不低于2 min。
2.2 培养基 2.2.1 基本培养基及激素以MS为基本培养基,蔗糖3%(30 g/L),琼脂4.5 g/L,培养基pH 5.8~6.0。3种植物激素2,4-D、6-BA和NAA的母液质量浓度均为0.1 mg/mL。培养基在121 ℃灭菌22 min。
2.2.2 愈伤诱导培养基添加不同质量浓度6-BA和2,4-D,采用完全组合实验,外植体分别接于不同激素浓度及配比的培养基(C01~C13)中。
2.2.3 丛生芽增殖培养基添加不同质量浓度6-BA和NAA,采用完全组合实验,将愈伤组织诱导出的丛生芽分割成适当大小(含3~5个芽点),分别接于不同激素质量浓度及配比的培养基(P01~P13)中,每种培养基接种30个丛生芽。
2.2.4 生根培养基扦插预实验结果表明,使用NAA效果优于其他植物激素或组合(未发表资料),故本实验以1/2 MS为基本培养基,采用单因子NAA不同浓度进行瓶苗生根实验。丛芽增殖培养30 d后,选取长势健壮,4~5 cm高的新芽,修剪切割后转入不同浓度NAA的生根培养基(R01~R05)上,每种培养基接种30个分割好的丛苗(1~3株为一丛)。
2.3 培养条件培养室温度控制在(22±1)℃,光照度1 500~2 000 lx,光照时间12 h/d。每隔7 d记录不同处理的生长状况。
2.4 炼苗移栽生根培养21 d苗壮根粗时,将瓶盖打开,置于自然光下,5 d后取出生根苗,小心洗尽残余培养基后转种到经0.1%甲醛消毒的细河沙中,保温保湿培养25 d(温度20~25 ℃、湿度70%左右)后即可转入户外种植。
2.5 统计指标所得数据采用Excel和SPSS12.0软件处理分析。
愈伤组织诱导率=产生愈伤组织的外植体数 / 接种外植体总数
丛生芽再生率=产生丛生芽愈伤组织数 / 接种愈伤组织总数
丛生芽再生系数=丛生芽成苗数 / 接种带丛生芽愈伤组织总数
生根率=产生不定根的丛苗数 / 接种丛苗总数
3 结果与分析 3.1 愈伤组织诱导将茎尖、带芽茎段和花序3种外植体(图 1)消毒后接种于不同的愈伤诱导培养基中,诱导效果存在明显差异。将外植体接入培养基中约7 d后,2种外植体(带芽茎段除外)在所有培养基中均出现少量较致密的浅黄色愈伤组织,带芽茎段不出现愈伤组织而发生腋芽萌动现象;14 d观察统计后发现,在C05号培养基中茎尖外植体诱导出的愈伤组织较为松散、呈水泡状,难以分化成丛生芽(图 2-A);带芽茎段外植体则继续腋芽生长(图 2-B),只有少量材料从切口处发生白色膨大形成愈伤组织;而花序外植体诱导出的愈伤组织体积迅速增大,质地紧密并伴随着绿色小芽点的出现(图 2-C)。
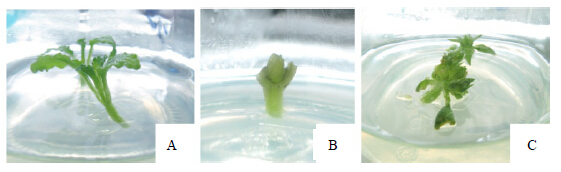 | A-茎尖 B-带芽茎段 C-花序 A-stem tip explant B-stem with bud explant C-inflorescence explant图 1 3种不同的外植体接种于同一培养基中启动培养 Fig. 1 Three different explants cultured on same medium |
 | A-由茎尖诱导出的淡黄色松软型愈伤组织 B-腋芽萌动 C-由花序诱导出的绿色紧密型愈伤组织 A-yellowish green soft callus from stem tip B-bud sprouting C-compact green callus from inflorescence图 2 3种外植体在C05号培养基中的诱导情况 Fig. 2 Induction results of three explants on medium C05 |
实验结果表明,茎尖和花序外植体均可诱导出愈伤组织,而带芽茎段只出现腋芽萌动,少见产生愈伤组织。茎尖诱导出的愈伤组织大多淡黄色或灰白色,培养中很难分化出不定芽丛;花序在C05号培养基即MS+6-BA0.1 mg/L+2,4-D 1.5 mg/L中,愈伤组织诱导率100%,诱导出的愈组织呈绿色,结构紧密,14 d后即分化出大量不定芽丛(表 1)。
|
|
表 1 不同激素组合对不同外植体愈伤组织诱导率的影响 Table 1 Callus induction rates from different hormone combination and explants |
将花序诱导出的愈伤组织(图 3-A)转入继代增殖培养基7 d后开始分化出不定芽丛(图 3-B),随后丛生芽大量繁殖(图 3-C),28d天后统计丛生芽再生率、再生系数,结果见表 2。从表 2中可以看出,用花序诱导出的愈伤组织在转接至分化增殖(P号培养基)中均能较好地分化出丛生芽。其中,P09号培养基即MS+6-BA 2.0 mg/L+NAA 0.5 mg/L中,丛生芽诱导率达100%,接种29个愈伤组织块共发生芽数119个,再生系数为4.10,再次转接时的增殖倍数达到5.0以上。实验表明,在一定范围内,紫背金盘丛生芽再生主要受6-BA质量浓度的影响,当质量浓度达2.0 mg/L时,丛生芽数量和质量达最佳(图 3-C、D)。与花序诱导的愈伤组织相比,茎尖亦能较好地诱导出愈伤组织(图 4-A),但转接进丛生芽分化培养基中其再分化能力较差。随着培养时间的延长,愈伤组织表面积聚的色素成分逐渐增多(图 4-B),虽经改变激素配比,始终无不定芽丛的分化,最后老化死亡(图 4-C)。
 | A-刚接种的愈伤组织 B-转接7 d后丛生芽发生 C-丛生芽生长与增殖 D-丛生芽 A-just inoculated callus B- adventitious buds induced after 7 d inoculation C-growth and proliferation of adventitious buds D-clustered buds 图 3 丛生芽的诱导和增殖 Fig. 3 Induction and proliferation of clustered buds |
|
|
表 2 不同处理对丛生芽诱导的影响 Table 2 Effects of different treatments on induction of clustered buds |
 | A-刚转接的愈伤组织 B-培养21d后愈伤组织表面的色素积聚,未见芽丛发生 C-培养30 d后,愈伤组织逐渐老化死亡 A-just inoculated callus B-accumulation of pigment on callus and no buds after 21 d of culture C-callus aging death after 30 d of culture 图 4 茎尖诱导的愈伤组织生长情况 Fig. 4 Growth of callus from stem tip induction |
生根培养28 d后统计根系的分化率见表 3。从表 3中可以看出,紫背金盘无菌苗在附加不同质量浓度NAA的1/2 MS培养基上均可生根,甚至在空白对照(CK)上亦有一定的生根率。除空白对照外,各组间在生根率上无显著性差异,但在根系质量上却存在差异。NAA的3个质量浓度水平0.5、1.0和1.5 mg/L,均能很好地诱导出不定根,但在根毛数量上存在较明显差异。在附加NAA 1.0 mg/L培养基上培养28 d后长出的不定根,根长且粗壮,多根毛(图 5-A、B、C);在附加NAA 0.5、1.5 mg/L培养基上培养28 d后长出的不定根,根长较粗但根毛少(图 5-D)。由实验结果分析可得出紫背金盘较适宜的生根培养基配方为1/2 MS+NAA 1.0 mg/L。
|
|
表 3 不同质量浓度NAA对丛生芽生根培养的影响 Table 3 Effects of NAA different at concentration on rooting of clustered buds |
 | A-R04培养基中培养28 d后的生根苗 B-根毛 C-瓶底根系 D-R05培养基中培养28 d后的生根苗 A-rooting plants on medium R04 after 28 d of culture-robust plants,root length and strong B-root hairs of A C- bottom roots of A D-rooting plants on medium R05 after 28 d of culture-roots long and strong,less hairs 图 5 丛生芽诱导生根 Fig. 5 Roots induced from regenerated adventitious buds |
生根苗驯化移栽10 d(温度20~25 ℃、湿度70%左右)后即有不定根长出(图 6-A),待小苗长出2~3片新叶便可移栽至室外。组培苗经过驯化后,移栽至室外的成活率较高,可达90%以上,植株生长正常(图 6-B)。
 | A-驯化苗,箭头示新发生的不定根 B-移栽苗 A-domesticated plantlet,arrow showing adventitious root just happened B-transplanted plantlets图 6 生根苗驯化与移栽 Fig. 6 Domestication and transplanting of rooting plants |
本实验选取了紫背金盘茎尖、带芽茎段和花序3种材料作为诱导愈伤组织的外植体,结果表明花序是诱导愈伤组织最有效的外植体,诱导率高,诱导产生的愈伤组织质地紧密且分化系数高,这与一些菊科植物类似[11]。较适宜的诱导培养基为MS+6-BA 0.1 mg/L+2,4-D 1.5 mg/L,1周内可诱导出愈伤组织,2周后即分化出绿色小芽丛。本研究小组在前期的研究中发现,在不添加任何激素的C01号培养基上未能诱导出愈伤组织,单独使用6-BA或NAA同样未获得愈伤组织,而2,4-D单独使用时却有少量的愈伤组织形成,说明2,4-D是紫背金盘愈伤组织形成的关键因素。其中以2,4-D 1.5 mg/L的促进作用最大,且在一定浓度范围内愈伤组织的诱导率随着2,4-D浓度的增加而增加,浓度过高时又会抑制愈伤组织的发生。
本实验以6-BA配合低质量浓度NAA使用时,随着6-BA质量浓度的增加,增殖倍数增大,当质量浓度为2.0 mg/L时达到最大;继续增加其质量浓度,增殖倍数变化不大,反而有下降的趋势,并出现叶片畸形、组织玻璃化等现象。紫背金盘较适宜的丛生芽增殖培养基为:MS+6-BA 2.0 mg/L+NAA 0.5 mg/L,愈伤组织芽丛再生率高达100%,再生系数为4.10,4周后增殖倍数5.0以上。与水半夏相似[12],这一阶段的生长过程中有明显的“芽繁芽”现象。在实际扩繁过程中,可以利用这一特点,不断进行幼小芽丛的分割,从而节省诱导愈伤组织时间,大大提高繁殖速度。
研究发现,茎尖和带芽茎段亦可诱导出愈伤组织,但在下一步的丛生芽诱导和增殖实验中虽经改变多种激素浓度组合却无法获得丛生芽。此现象在本研究小组以往其他物种的实验中从未发生,具体原因有待进一步研究。此外,在丛生芽增殖和生根培养中,空白对照也有一定的生根率,初步推测紫背金盘在外源激素的刺激下,其愈伤组织和丛生芽在生长过程中可以将一定比例的外源激素积聚为内源激素。
紫背金盘丛生芽在附加不同质量浓度NAA的1/2 MS培养基上均可生根,其中较适宜的生根培养基为:1/2 MS+NAA 1.0 mg/L,3周后即可获得再生植株,生根率100%。紫背金盘生根培养时,基本不产生愈伤组织,根大多起源于茎基部节处,根维管束与茎维管束相连,这可能也是紫背金盘移栽成活率高的原因之一。
本研究结果为保护紫背金盘野生资源和发展人工栽培奠定了良好基础,也为遗传转化研究提供重要的科学依据。
| [1] | 吴征镒, 李锡文. 中国植物志 [M]. 北京: 科学出版社, 2010. |
| [2] | 国家中药管理局《中华本草》编委会. 中华本草 [M]. 上海: 上海科学技术出版社, 1998. |
| [3] | 中国科学院植物研究所主编. 中国高等植物图鉴 (第3册) [M]. 北京: 科学出版社, 1980. |
| [4] | 李云耀, 易刚强, 陈晓阳, 等. 中草药紫背金盘研究现状与展望 [J]. 湖南中医药大学学报, 2010, 30(8): 64-77. |
| [5] | 刘 斌, 石任兵, 葛小侠. 筋骨草属植物化学成分与药理活性 [J]. 国外医药: 植物药分册, 2001, 16(3): 96-101. |
| [6] | 陈小霞. 闽产苦草的生药学研究 [D]. 福州: 福建中医学院, 2005. |
| [7] | 李卫文, 吴文玲, 刘守金, 等. 筋骨草属植物的化学成分 [J]. 安徽医药, 2009, 13(3): 329-336. |
| [8] | 易刚强, 李云耀, 李晓龙, 等. 紫背金盘水提物和醇提物解热作用的研究 [J]. 湖南中医药大学学报, 2010, 30(11): 26-27. |
| [9] | 徐 迪, 钟耀垣, 曾 玲, 等. 紫背金盘 (Ajuga nipponensis) 次生物质对桔全爪螨 (Panonychus citri) 的驱避作用 [J]. 生态学报, 2008, 28(8): 3829-3847. |
| [10] | 吕海亮, 张文澄, 张遂申. 四棱草属比较形态及其分类系统位置的研究 [J]. 西北植物学报, 1996, 16(3): 245-250. |
| [11] | 黄衡宇, 李 鹂, 党承林. 药用植物灯盏花的组织培养 [J]. 广西植物, 2008, 28(5): 685-689. |
| [12] | 丁 伟, 张立红, 潘晟昊, 等. 水半夏组培快繁体系的建立 [J]. 中草药, 2011, 42(3): 585-588. |
 2014, Vol.45
2014, Vol.45 


