2. 黔南民族医学高等专科学校, 贵州 都匀 558003;
3. 山西师范大学, 山西 临汾 041004
2. Qiannan Medical College for Nationalities, Duyun 558003, China;
3. Shanxi Normal University, Linfen 041004, China
鲨烯合酶[squalene synthase (EC 2.5.1.21)] 能够催化2分子法呢基焦磷酸(farnesyl pyrophosphate,FPP)首尾聚合生成三萜和甾体类化合物的前体物质鲨烯,是植物三萜和甾体类化合物生物合成过程中的关键酶之一。由于植物三萜类化合物多具有重要药用价值,人们对药用植物的鲨烯合酶基因较为关注,包括人参、甘草、积雪草、金铁锁、蛇足石杉在内的多种药用植物的鲨烯合酶基因已经得到了克隆[1,2,3,4,5]。迄今为止,还未见丹参鲨烯合酶基因研究报道。为了研究丹参三萜和甾体类化合物生物合成途径,本课题组克隆了2个丹参鲨烯合酶基因(SmSQS1和SmSQS2),鉴定了这2个基因及其编码多肽的序列特征,还分析了这2个基因的表达模式。研究结果表明,这2个丹参鲨烯合酶基因具有不同的基因结构特征和表达模式,可能在丹参甾体和三萜类化合物生物合成过程中具有不同作用。
1 材料 1.1 植物材料丹参Salvia miltiorrhiza Bunge品系993的田间材料由药用植物研究所李先恩研究员鉴定并惠赠。于2012年6月8日进行取材,分别将丹参的根、茎、叶和花用锡箔纸包好后液氮冻存,作为分析丹参鲨烯合酶基因组织特异性表达的材料。丹参鲨烯合酶基因时间特异性表达的18株丹参小苗由丹参田间材料通过组培扩增得来。首次取材于2012年6月11日16︰00,取3株丹参小苗叶片液氮冻存。然后每隔4 h再同样取1次样本,直到取得6个样本。
1.2 试剂所用试剂包括LA Taq酶(TAKARA公司),pMD18T载体(TAKARA公司),SYBR premix Ex TaqTM实时定量试剂盒,Super SMARTTM PCR cDNA Synthesis Kit(Clontech公司)。通用植物RNA提取试剂盒(百泰克公司)、Power M-MLV反转录酶(百泰克公司)。引物合成与DNA测序由三博远志公司完成。
2 方法 2.1 基因克隆将拟南芥鲨烯合酶基因At4g34640和At4g34650应用Blastn程序在本地服务器上与丹参基因组序列进行比对,将所得到的同源性序列提交Genscan网站(http://genes.mit.edu/GENSCAN.html)进行编码基因预测。根据预测的鲨烯合酶基因序列设计引物,引物为SmSQS1-F、SmSQS1-R、SmSQS2-F和SmSQS2-R(表 1),应用Super SMA- RTTM PCR cDNA Synthesis Kit合成丹参cDNA,通过RT-PCR方法对丹参鲨烯合酶基因进行了扩增,连入pMD-18T载体进行测序。
|
|
表 1 基因克隆及RT-qPCR所用引物 Table 1 Primers used for gene clone and RT-qPCR |
将测序得到的基因编码区序列与基因组序列一并提交GSDS网站(http://gsds.cbi.pku. edu.cn/index.-php),进行基因结构分析。将克隆的2个丹参鲨烯合酶基因序列提交到Genebank网站应用BLASTx程序进行序列比对(http://blast.ncbi.nlm.nih. gov/ Blast.cgi),选取有代表性的植物鲨烯合酶基因,下载编码蛋白,用VectorNTI 11.0程序包中的AlignX进行多序列比对,并应用GeneDoc程序进行编辑[6]。应用生物软件MEGA5.0构建Neighbor-joining系统发育树。通过TMHMM网站预测(http://www.cbs.dtu.dk/services/TMHMM-2.0/)2个丹参鲨烯合酶基因编码蛋白的跨膜区[7]。利用ExPASy蛋白分析系统(http://web.expasy.org/compute_pi/)预测2个丹参鲨烯合酶基因编码多肽的理论等电点/相对分子质量(pI/Mw)。
2.3 实时定量PCR分析丹参基因表达模式实时定量PCR根据SYBR premix Ex TaqTM试剂盒的使用说明进行操作,具体步骤可参考Ma等[8]报道。以SmUBQ10作为内对照,SmUBQ10引物的序列为SmUBQ-F和SmUBQ-R,2个丹参鲨烯合酶基因SmSQS1和SmSQS2的实时定量RT-PCR的引物为RT-SQS1-L、RT-SQS1-R、RT-SQS2-L和RT-SQS2-R(表 1)。
3 结果与分析 3.1 丹参鲨烯合酶的基因克隆与序列提交通过将拟南芥鲨烯合酶基因同丹参基因组进行序列同源性比对,本课题组获得了一些与拟南芥鲨烯合酶基因(At4g34640和At4g34650)具有较高同源性的丹参基因组片段。基于这些基因组片段,预测其中2个基因组片段能够编码丹参鲨烯合酶基因全长。根据预测的丹参鲨烯合酶基因全长编码区序列,本课题组设计引物通过RT-PCR方法扩增得到了2个丹参鲨烯合酶基因的全长编码区,并将这2个鲨烯合酶基因命名为SmSQS1和SmSQS2。经过测序,SmSQS1基因编码区全长1242 bp。SmSQS2基因编码区全长1245 bp。将SmSQS1的编码区序列提交到Genbank核酸数据库进行比对,结果表明SmSQS1高度相似于1个从商洛丹参中获得的鲨烯合酶基因(Genbank 登录号为FJ768961.1),而SmSQS2是1个新基因,它的编码区与FJ768961.1仅有83%的序列相似性。
将这2个基因的编码区都提交到GSDS网站上进行外显子/内含子结构预测,发现这2个基因的编码区都包含13个外显子和12个内含子,2个基因的内含子相位(即内含子在基因内相对于遗传密码的3个核苷酸的位置)有相似之处。这2个基因的外显子/内含子组织形式与拟南芥相似,但是丹参鲨烯合酶基因的内含子要比拟南芥鲨烯合酶基因的内含子序列长很多(图 1)。编码这2个丹参鲨烯合酶基因的基因组片段已提交到了Genbank数据库(SmSQS1的基因组片段序列的Genbank 登录号为JQ763409,SmSQS1的基因组片段序列的Genbank 登录号为JQ763410)。
 | 黑色实心方块代表外显子,黑线代表内含子,外显子右上角的数字代表内含子相位 Black solid blocks represent exons,black lines represent introns. Figures at the top right corner of exon represent intron phase图 1 拟南芥与丹参鲨烯合酶基因外显子/内含子组织形式示意图 Fig. 1 Diagram of exon/intron structures of thaliana squalene synthase genes from Arabidopsis thaliana and S. miltiorrhiza |
应用多种生物信息学方法分析了这2个丹参鲨烯合酶基因序列特征。经过ExPASy服务器预测,SmSQS1编码一个包括413个氨基酸的多肽(理论pI/Mw:6.60/47 351.96),SmSQS2编码一个推断的包括414个氨基酸的多肽(理论pI/Mw:7.16/47 158.93)。将2个基因提交到Genebank网站应用BLASTp程序进行序列比对,SmSQS1和SmSQS2编码多肽与假马齿苋Bacopa monnieri (L.) Wettst. 鲨烯合酶(Genbank ID,ADX01171)具有85%和87%的一致性,都具有反式异戊烯基焦磷酸合酶的保守结构域(Trans_IPPS_HH),这说明这2个基因都可能编码鲨烯合酶。
将SmSQS1(Genbank登录号JQ763409.1)和SmSQS2(Genbank登录号JQ763410.1)编码的鲨烯合酶与拟南芥和光果甘草的鲨烯合酶(Genbank的登录号分别为AtSQS1、At4g34640、AtSQS2、At4g34650、GgSQS1、D86410.1、GgSQS2、D86409.1)进行比较,发现它们都具有保守的结构域A、B、C,以及保守的天冬氨酸丰富区(DXXXD)(图 2)。根据以往的报道,鲨烯合酶是一种结合在内质网上的膜结合酶[9]。通过在T MHMM网站进行预测,丹参SmSQS1编码鲨烯合酶包含1个跨膜结构域,位于386~408位置。丹参SmSQS1编码鲨烯合酶具有2个跨膜区,第1个跨膜区在281~303位置,第2个跨膜区在387~409位置。应用MEGA软件对不同植物中的鲨烯合酶序列进行系统进化分析,包括西洋参鲨烯合酶PgSQS1(AB115496)、PgSQS2(GQ468527.2)和PgSQS3(GU183406.1);丹参鲨烯合酶SmSQS1(JQ763409.1)和SmSQS2(JQ763410.1);光果甘草鲨烯合酶GgSQS1(D86410.1)和GgSQS2(D86409.1);拟南芥鲨烯合酶AtSQS1(At4g34640)和AtSQS2(At4g34650)以及水稻鲨烯合酶OsSQS(AB007501.1)。研究结果表明,拟南芥、甘草、丹参和西洋参中都包含2或3个鲨烯合酶,同一物种的鲨烯合酶聚为一支,这说明拟南 芥、 甘草、丹参和西洋参鲨烯合酶的基因都可能是“平行同源”基因,也就是在同一物种内由同一基因复制而来的基因,所以同一物种的鲨烯合酶之间要比不同物种的鲨烯合酶相似度高(图 3)。
 | 鲨烯合酶保守的结构域A、B和C用“—”标出,介导异戊烯基磷酸结合的保守天冬氨酸丰富区(DXXXD)用“*”标出 Squalene synthase conserved domain A,B,and C are underlined by “—”,and two aspartate-rich regions (DXXXD) that mediate binding of prenyl phosphates are marked out by “*” 图 2 丹参、拟南芥和光果甘草鲨烯合酶氨基酸序列同源性比对 Fig. 2 Homological alignment of amino acids in squalene synthases from S. miltiorrhiza,A. thaliana,and G. glabra. |
 | 图 3 植物的鲨烯合酶系统进化分析 Fig. 3 Phylogenetic analysis of plant squalene synthases |
将丹参的不同组织的样品提取RNA、反转录和进行实时定量RT-PCR 检测。结果表明SmSQS1在不同组织中的表达量高低依次为花>茎>叶>根,在花中的最高表达量比在根中的最低表达量要高出将近9倍。SmSQS2在不同组织中的表达量依次为茎>根>叶>花,SmSQS2在茎、根、和叶中的表达量相差不多,都远远大于在花中的表达量。2个基因相比较,在丹参根部,SmSQS1的表达水平比SmSQS2稍低。而在丹参茎、叶和花等部位,SmSQS1的表达水平都要高于SmSQS2。SmSQS1在花中具有最高的表达水平,而SmSQS2在花中表达水平最低(图 4)。以上研究表明,SmSQS1和SmSQS2具有不同的组织特异性表达模式,可能在丹参甾体或三萜类物质的生物合成途径中起着不同作用。将1天中6个不同时间点的丹参小苗叶片样品提取RNA、反转录和进行实时定量PCR检测。结果表明,这2个丹参SQS基因在叶片中尽管表达水平有所不同,但具有相似的时间表达曲线。在每个时间点,SmSQS1的表达量都高于SmSQS2。在取材的当天,经观测,日出时间大概在4︰30,而SmSQS1和SmSQS2的表达量在4︰00到8︰00显著增加,2个基因的表达量都在大约8︰00达到最高值。因此,这2个基因可能受到早晨的光照诱导或具有相似的生物钟现象(图 5)。
 | 将SmSQS2在花中的表达水平设定为1,Y轴代表基因相对于SmSQS2在花中表达水平的倍数 Y axes represent the fold levels of gene expression relative to SmSQS2 gene expression level in flowers that arbitrary set to 1 图 4 丹参鲨烯合酶的组织特异性表达模式( 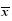 ±s,n=3)
Fig. 4 Tissue-specific expression patterns of S. miltiorrhiza squalene synthase genes ( ±s,n=3)
Fig. 4 Tissue-specific expression patterns of S. miltiorrhiza squalene synthase genes (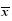 ±s,n=3) ±s,n=3)
|
 | 将SmSQS1在0:00的表达水平设为1,Y轴代表基因相对于SmSQS1在0:00表达水平的倍数 Y axes represent fold levels of gene expression relative to SmSQS1 gene expression level in 0:00 that arbitrary set to 1 图 5 丹参鲨烯合酶基因在不同时间点小苗叶片中的表达模式 ( 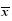 ±s,n=3)
Fig. 5 Expression patterns of S. miltiorrhiza squalene synthase genes in seedling leaves at different time points in a day ( ±s,n=3)
Fig. 5 Expression patterns of S. miltiorrhiza squalene synthase genes in seedling leaves at different time points in a day (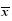 ±s,n=3) ±s,n=3)
|
丹参为鼠尾草属重要的药用植物,其根部含有二萜丹参酮类和酚酸类等多种活性物质。此外,研究表明,丹参地上部分包含有多种脂溶性的甾体化合物和三萜类化合物,其中的甾体化合物有γ-谷甾醇、β-谷甾醇等,具有多种生物活性[10]。丹参地上部分的三萜类化合物成分也十分丰富,这些成分包括熊酸和齐墩果酸等,丹参地上部分富含三萜的提取物可能具有抗动脉粥样硬化的药理活性[11,12]。丹参地上部位三萜类及甾体成分的研究和开发,对于丹参资源的综合利用具有重要意义。然而,迄今为止,丹参三萜类和甾体化合物的生物合成途径尚不清楚。
在本研究中,通过同源基因预测以及RT-PCR等方法,从丹参基因组中发现了2个可能编码鲨烯合酶的基因,根据基因序列结构比较以及系统进化分析,这2个基因可能是通过基因复制而来的“平行同源”基因。据报道,“平行同源”基因能够有不同的表达模式和产物特异性[13]。在本研究中,2个丹参鲨烯合酶基因在不同组织的表达模式也有所不同。在丹参的茎、叶和花等是包含三萜和甾体类化合物较多的部位,SmSQS1的表达量比SmSQS2高。这2个基因还具有不同的时间表达模式,但都受光照诱导。拟南芥具有不同表达模式的2个鲨烯合酶基因(At4g34640和At4g34650)中,只有一个基因能够编码有活性的鲨烯合酶[14]。西洋参、苜蓿和甘草等三萜量较为丰富的植物中,也有多个具有不同表达模式的鲨烯合酶基因
志谢:中国医学科学院药用植物研究所栽培中心李先恩研究员提供丹参材料,资源中心研究人员提供丹参基因组高通量测序数据。
| [1] | 罗志勇, 陆秋恒, 刘水平, 等. 人参植物皂苷生物合成相关新基因的筛选与鉴定 [J]. 生物化学与生物物理学报, 2003, 35(6): 554-560. |
| [2] | 卢虹玉, 刘敬梅, 阳文龙, 等. 甘草鲨烯合成酶基因的分离及植物表达载体的构建 [J]. 药物生物技术, 2007, 14(4): 255-258. |
| [3] | Kim O T, Seong N S, Kim M Y, et al. Isolation and characterization of squalene synthase cDNA from Centella asiatica (L.) Urban [J]. J Plant Biol, 2005, 48(3): 263-269. |
| [4] | 戴住波, 钱子刚, 胡运乾, 等. 金铁锁鲨烯合酶cDNA的克隆和功能鉴定 [J]. 药学学报, 2008, 43(12): 1245-1250. |
| [5] | 殷秀梅, 白志川, 牛云云, 等. 蛇足石杉鲨烯合酶HsSQS1基因克隆和序列分析 [J]. 药学学报, 2012, 47(8): 1079-1084. |
| [6] | Nicholas K B, Nicholas H B Jr, Deerfield D W II. GeneDoc: analysis and visualization of genetic variation [J]. Embnew. News, 1997, 4: 14. |
| [7] | Krogh A, Larsson B, von Heijne G, et al. Predicting transmembrane protein topology with a hidden Markov model: application to complete genomes [J]. J Mol Biol, 2001, 305(3): 567-580. |
| [8] | Ma Y M, Yuan L C, Wu B, et al. Genome-wide identification and characterization of novel genes involved in terpenoid biosynthesis in Salvia miltiorrhiza [J]. J Exp Bot, 2012, 63(7): 2809-2823. |
| [9] | Kribii R, Arro M, Del Arco A, et al. Cloning and characterization of the Arabidopsis thaliana SQS1 gene encoding squalene synthase involvement of the C-terminal region of the enzyme in the channeling of squalene through the sterol pathway [J]. Eur J Biochem, 1997, 249(1): 61-69. |
| [10] | 杨黎彬, 刘少静, 魏彩霞, 等. 丹参地上部分脂溶性成分研究 [J]. 儿科药学杂志, 2011, 17(4): 7-9. |
| [11] | Liu P, Hu P, Deng R X, et al. Triterpenoids from the flowers of Salvia miltiorrhiza [J]. HCA, 2011, 94(1): 136-141. |
| [12] | Zhang Q, Chang Z, Yang J, et al. Antiatherogenic property of triterpenoids-enriched extract from the aerial parts of Salvia miltiorrhiza [J]. Phytother Res, 2008, 22(8): 1040-1045. |
| [13] | Lin H, Ouyang S, Egan A, et al. Characterization of paralogous protein families in rice [J]. BMC Plant Biol, 2008, 8: 18. |
| [14] | Busquets A, Keim V, Closa M, et al. Arabidopsis thaliana contains a single gene encoding squalene synthase [J]. Plant Mol Biol, 2008, 67: 25-36. |
| [15] | Naoumkina M A, Modolo L V, Huhman D V, et al. Genomic and coexpression analyses predict multiple genes involved in triterpene saponin biosynthesis in Medicago truncatula [J]. Plant Cell, 2010, 22(3): 850-866. |
| [16] | Hayashi H, Hirota A, Hiraoka N, et al. Molecular cloning and characterization of two cDNAs for Glycyrrhiza glabra squalene synthase [J]. Biol Pharm Bull, 1999, 22(9): 947-950. |
| [17] | Kim T D, Han J Y, Huh G H, et al. Expression and functional characterization of three squalene synthase genes associated with saponin biosynthesis in Panax ginseng [J]. Plant Cell Physiol, 2011, 52(1): 125-137. |
 2014, Vol.45
2014, Vol.45 


