雷公藤Tripterygium wilfordii Hook. f. 为卫矛科植物,具有免疫抑制、抗炎、抗肿瘤和抗菌作用,临床上常用于治疗风湿及类风湿性关节炎、肾小球肾炎、肾病综合征、哮喘等免疫性疾病[1]。但由于其成分复杂、作用机制不清、毒副作用大、临床应用受到极大限制。雷公藤多苷是从雷公藤中分离得到的主要抗炎成分,去除了多种毒性成分,保留了雷公藤生药的免疫抑制作用。变应性鼻炎(allergic rhinitis,AR)是发生在鼻黏膜的典型变态反应性疾病,其发病机制主要表现为辅助性T细胞因子Th1/Th2失衡所致的I型变态反应,AR患者近1/3最终发展为哮喘,AR与哮喘称为“同一气道、同一疾病”[2]。本研究拟应用卵清蛋白制备AR动物模型,施加雷公藤多苷干预,探讨AR发病过程中TLR-NF-κB信号通路的机制,并进一步探讨雷公藤多苷干预免疫的机制。
1 材料与方法 1.1 实验动物及分组Wistar大鼠100只,体质量250~300 g,由福建医科大学实验动物中心提供,动物使用许可证号SYXK(闽)2008-0001。随机分为4组,对照组、模型组、雷公藤多苷组、倍氯米松阳性组,每组25只。
1.2 主要试剂及仪器雷公藤多苷片(10 mg/片,批号090302,福建汇天生物药业有限公司);倍氯米松,潍坊中狮制药有限公司;卵清白蛋白(OVA,Sigma),NF-κB p50抗体(Santa Cruz),兔抗大鼠TLR4多克隆抗体、兔抗大鼠免疫球蛋白(IgE)多克隆抗体(Bosd);PCR仪(A&B Singapore),Leica CM1850冰冻切片机(德国),Nikon摄像机(日本),XS—T10解剖显微镜。
1.3 模型的制备及给药大鼠分组后,先适应性喂养1周。除对照组外,其他各组大鼠即开始初次全身基础致敏,大鼠于第1、3、5、7、9、11、13天ip给予OVA 0.3 mg/mL(OVA 0.3 mg加Al(OH)3 30 mg混于1 mL生理盐水中);第15天开始每侧鼻孔各滴入OVA(0.1 mg/μL)50 μL鼻腔激发强化致敏,每天滴鼻,连续7 d[3]。对照组ip及滴鼻生理盐水;每天滴鼻激发致敏的同时,雷公藤多苷组ig给予雷公藤多苷30 mg/kg;倍氯米松组滴鼻50 μL 倍氯米松。
1.4 鼻黏膜组织学光镜观察各组大鼠末次滴鼻后,10%水合氯醛(100 μL/g)麻醉,从鼻正中缝处开裂鼻腔剥离鼻黏膜组织,一侧鼻黏膜投入4 ℃ 10%中性多聚甲醛中固定以备切片,每一标本选8张切片进行HE染色及免疫组织化学染色,光学显微镜观察鼻黏膜组织变化,并计数炎性细胞的浸润数。
1.5 免疫组化测定鼻黏膜组织细胞因子的表达鼻黏膜组织切片入0.01 mol/L柠檬酸抗原修复液,微波修复抗原并消除内源性过氧化物酶活性,滴加一抗:肿瘤坏死因子(TNF-α)1∶200、白细胞介素(IL-5)1∶200、IgE 1∶200,4 ℃过夜,滴加试剂1及试剂2,DAB液显色,苏木素复染封片。光镜下见阳性反应物质呈棕黄色,阴性对照不着色。采用Image-Pro Plus 6.0图像分析软件测定平均吸光度值。
1.6 实时定量PCR检测鼻黏膜组织TLR4和核因子-κB(NF-κB)水平取鼻黏膜组织,用Trizol一步法提取总RNA。TLR4:正向引物5’-CAGAACTTCAGTGGCTGGA- 3’,反向引物 5’-ATTTTGTCTCCACAGCCACC-3’,产物长度180 bp;NF-κB p65:正向引物5’-GCTC- GGCTGAATGAATCTACCA-3’,反向引物 5’-GTC TCCACGTATTTCCGCAACT-3’,产物长度168 bp;内参照β-actin正向引物5’-CCTTCCGTG- TTCCTACCCC-3’,反向引物 5’-GCCCAAGATG- CCCTTCAG-3’&l t;/ span>,产物长度130 bp。应用SYBR Green I荧光染料技术进行实时定量PCR反应,PCR反应体系20 μL,获取各组标本的扩增曲线和溶解曲线,计算机分析Ct值。目的基因mRNA的相对表达量为2-ΔCt,目的基因ΔCt=目的基因Ct-内参照基因Ct。
1.7 Western blotting检测鼻黏膜组织TLR4和NF-κB蛋白表达取鼻黏膜组织,按蛋白抽提试剂盒程序提取并行蛋白定量和变性后分离电泳,PVDF转膜,一抗孵育(TLR4 1∶200,NF-κB 1∶200),4 ℃孵育过夜。二抗(1∶10 000)4 ℃孵育过夜。发光鉴定,见淡绿色荧光条带盖上胶片进行曝光,漂洗定影,标定Marker,进行扫描分析。Quantity One图像分析软件测定各组TLR4、NF-κB蛋白以及内参GAPDH蛋白平均灰度值,两者相除得到TLR4、NF-κB蛋白表达相对量。
1.8 统计学处理数据用表示,用SPSS 13.0统计软件包进行统计学分析,各实验组间差异的显著性检验均采用方差分析和重复测量,方差齐时用LSD法进行两两比较,方差不齐时用Tamhane’T2法进行两两比较。
2 结果 2.1 HE染色结果对照组鼻黏膜组织为假复层纤毛柱状上皮,由假复层纤毛柱状上皮细胞、杯状细胞、支持细胞、基底细胞等组成,黏膜上皮结构完整,排列整齐,纤毛粗细一致,黏膜下层的致密纤维结缔组织很薄,未见明显炎性细胞浸润;模型组鼻黏膜组织上皮不完整,有脱落现象,黏膜固有层见大量嗜酸性粒细胞及肥大细胞浸润;雷公藤多苷组及倍氯米松组鼻黏膜上皮结构亦不完整、有脱落,并有少量炎性细胞浸润,主要为中性粒细胞。结果见图 1。
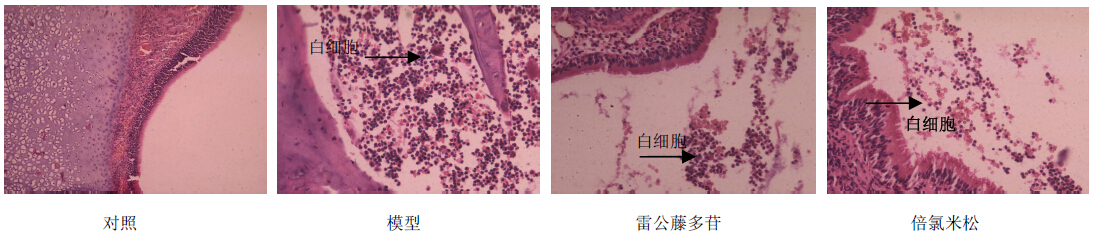 | 图 1 各组大鼠鼻黏膜组织学变化及炎性细胞浸润 Fig. 1 Changes of nasal mucosa tissues and inflammatory cell infiltration in each group of rats |
模型组平均嗜酸性粒细胞和中性粒细胞计数明显较对照组增多(P<0.05);雷公藤多苷组与倍氯米松组平均嗜酸性粒细胞计数较模型组降低(P<0.05),但高于对照组(P<0.05);雷公藤多苷组与倍氯米松组相比无明显差异(P>0.05)。结果见表 1。
|
|
表 1 各组大鼠鼻黏膜炎性细胞计数结果 (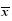 ±s,n=25)
Table 1 Neutrophil and eosinophil count in each group of rats ( ±s,n=25)
Table 1 Neutrophil and eosinophil count in each group of rats (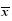 ±s,n=25) ±s,n=25)
|
TNF-α、IL-5、IgE在各组中主要分布在鼻黏膜假复层纤毛柱状上皮和固有层的腺体细胞内,在胞核和胞质内也见TNF-α、IL-5、IgE的表达,呈棕黄色,结果见图 2。各组TNF-α、IL-5、IgE表达的平均积分吸光度值见表 2,模型组与对照组相比IL-5、IgE、TNF-α的平均积分吸光度值明显增高(P<0.05);雷公藤多苷组、倍氯米松组与模型组比较IL-5、IgE的表达明显降低(P<0.05),而TNF-α的表达反而增高,TNF-α/IL-5较模型组明显增大(P<0.05)。
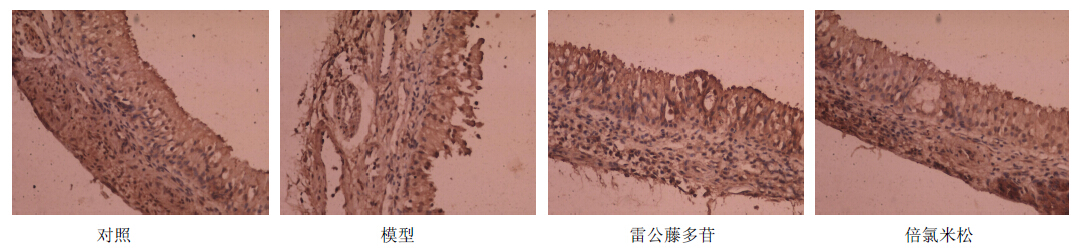 | 图 2 IL-5在各组大鼠鼻黏膜组织的表达 Fig. 2 Expression of IL-5 in nasal mucosa tissues in each group of rats |
|
|
表 2 各组鼻黏膜组织TNF-α、IL-5、IgE表达平均积分吸光度值 (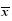 ±s,n=25)
Table 2 Expression of IL-5,TNF-α,and IgE in nasal mucosa tissues in each group of rats ( ±s,n=25)
Table 2 Expression of IL-5,TNF-α,and IgE in nasal mucosa tissues in each group of rats (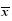 ±s,n=25) ±s,n=25)
|
模型组与对照组比较TLR4和NF-κB的mRNA表达值明显增高(P<0.05);雷公藤多苷组、倍氯米松组与模型组比较TLR4和NF-κB的mRNA表达明显降低(P<0.05)。结果见表 3。
|
|
表 3 各组大鼠鼻黏膜组织TLR4和NF-κB的mRNA表达值 (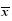 ±s,n=25)
Table 3 mRNA expression of TLR4 and NF-κB in nasal mucosa tissues in each group of rats ( ±s,n=25)
Table 3 mRNA expression of TLR4 and NF-κB in nasal mucosa tissues in each group of rats (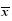 ±s,n=25) ±s,n=25)
|
各组TLR4和NF-κB的蛋白表达,结果见图 3和表 4。模型组与对照组比较TLR4和NF-κB的蛋白表达明显增高(P<0.05);雷公藤多苷组、倍氯米松组与模型组比较TLR4和NF-κB的蛋白表达明显降低(P<0.05)。
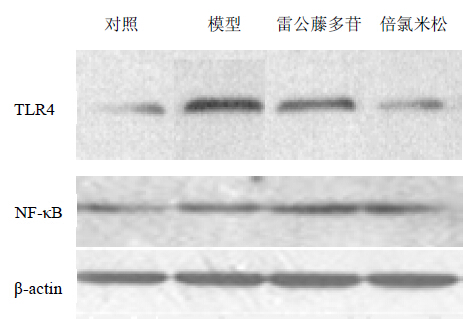 | 图 3 各组大鼠TLR4和NF-κB的蛋白表达 Fig. 3 Protein expression of TLR4 and NF-κB in nasal mucosa tissues in each group of rats |
|
|
表 4 各组大鼠鼻黏膜组织TLR4和NF-κB蛋白表达相对量 ( ±s,n=25)
Table 4 Protein expression of TLR4 and NF-κB in nasal mucosa tissues in each group of rats ( ±s,n=25)
Table 4 Protein expression of TLR4 and NF-κB in nasal mucosa tissues in each group of rats ( ±s,n=25) ±s,n=25)
|
AR是一种典型的变应性疾病,其发病机制复杂,涉及众多炎性因子的网络反应。目前,变应性炎症发病机制中的TLR-NF-κB信号通路[4]研究备受关注。Toll样受体广泛表达于呼吸道鼻黏膜的树突状细胞表面,它们识别致病原中一些特定的保守结构,从而激活一系列信号通路,活化NF-κB,转录相关炎性因子的生成,引起抗微生物感染的免疫应答,介导固有免疫向获得性免疫转换。NF-κB的表达不同程度地调控CD4+T细胞,在AR发生发展中,辅助性T细胞分化为Th2细胞,产生Th2细胞因子如IL-4、5、6、9、10、13等,IL-4、5为IgE增强因子,是促进B淋巴细胞合成Ig E的主要细胞因子,调节B淋巴细胞向合成IgE的方向转化,主要介导体液免疫[5];辅助性T细胞中的Th1细胞主要分泌IL-2、TNF-α和γ-干扰素(IFN-γ)等Th1细胞因子,TNF-α可抑制IgE合成,主要介导细胞免疫;TNF-α、IFN-γ和IL-4、IL-5在IgE的合成调节中较为重要,是AR发病的关键Th因子[6],这些炎性因子的生成受到多种信号通路如TLR-NF-κB信号通路的调控[7]。Th1/Th2的平衡调节是变应性炎症的关键。本实验应用OVA,结合TLR4,通过接头蛋白髓样分化蛋白(mteloid differentiation protain,MyD88),使IL-1受体相关激酶(IRAK)、TNF-α肿瘤坏死因子受体相关因子-6(TRAF-6)、MAPKKK家族的顺序激活,最终激活NF-κB诱导激酶(NIK)、I-κB激酶(IKK),NF-κB解除抑制作用转入胞核,NF-κB转录、诱导不同Th因子的合成和释放。干预病原与TLR的结合、调控NF-κB的转录,调节Th因子的释放、影响Th1/Th2的平衡将干预变应性炎症的发生发展[8]。
倍氯米松是脂溶性的皮质类固醇激素,可穿透靶细胞膜进入细胞浆,与糖皮质激素受体结合,在分子水平发挥作用[9]。倍氯米松较地塞米松有较大的应用优势,倍氯米松有较高的脂溶性,更容易被鼻黏膜局部吸收,从而更长时间地在鼻黏膜局部停留,并进入靶细胞发挥药理作用,改善鼻黏膜局部的过敏症状。因此本实验选择倍氯米松作为阳性对照药物。
本实验雷公藤多苷组表现为TLR4的mRNA水平的急剧降低,TLR4蛋白表达也相应减少,同时NF-κB p50的表达下调,IL-5因子生成减少,IgE的表达量也较模型组明显减少,嗜酸性粒细胞数明显降低,鼻部炎症表现明显改善。结果提示雷公藤多苷亦可以有效降低TLR对外来抗原的敏感性、反应性,提高TLR的耐受性而干预变应性疾病。研究同时也表明雷公藤多苷可下调NF-κB p50的表达,减少Th2因子释放[10]。雷公藤多苷通过干预TLR-NF-κB信号传导通路发挥免疫抑制作用。
变应性炎症常用皮质醇激素抗炎、H1组胺受体抑制剂抑制肥大细胞释放颗粒介质等,都有毒副作用[11]。雷公藤多苷对于变应性鼻炎伴哮喘的患者,从降低TLR表达,抑制NF-κB p50转录细胞因子的角度,应用毒性更低,成分更纯的雷公藤多苷治疗,可降低治疗成本,减少毒副反应。
| [1] | 官 杰, 孙 艳, 王 琪. 雷公藤多苷与激素联合应用对哮喘病人血清中IL-5的影响 [J]. 中国基层医药, 2002, 9(7): 611-612. |
| [2] | 程 雷, 称育智, ARIA工作组. 变应性鼻炎及其对哮喘的影响 (ARIA) 指南十年回顾及展望 [J]. 中华耳鼻咽喉头颈外科杂志, 2012, 47(8): 619-622. |
| [3] | 宋建明, 黄秀清, 林燕惠, 等. 变应性鼻炎大鼠模型的建立 [J]. 吉林大学学报, 2012, 38(6): 1152-1155. |
| [4] | 张 敏, 郑 鸣. TLR-NF-κB信号通路在大鼠变应性鼻炎发病中的作用及雷公藤多苷干预机制的研究 [D]. 福州: 福建医科大学基础医学院. 2012. |
| [5] | Sogut A, Yilmaz O, Kirmaz C. Regulatory-T, T-Helper 1, and T-Helper 2 Cell Differentiation in Nasal Mucosa of Allergic Rhinitis with Olive Pollen Sensitivity [J]. Int Arch Allergy Immunol, 2011, 157(4): 349-353. |
| [6] | Yoshimura T, Takahashi M. IFN-gamma-mediated survival enables human neutrophils to produce MCP-1/CCL2 in response to activation by TLR ligands [J]. Immunology, 2007, 179(3): 1942-1949. |
| [7] | 胡庆华, 繆明星, 卢 国, 等. 槲皮素对尿酸性大鼠肾脏NLRP3和TLRs表达的影响 [J]. 中草药, 2013, 44(24): 3496-3502. |
| [8] | Tsuji R F, Hoshino K, Noro Y. Suppression of allergic reaction by lambda carrageenan: toll-like receptor 4/MyD88-dependent and independent modulation of immunity [J]. Clin Exp Allergy, 2003, 33(2): 249-258. |
| [9] | Blaiss M S. Safety update regarding intranasal corticosteroids for the treatment of allergic rhinitis [J]. Allergy Asthma Proc, 2011, 32(6): 413-418. |
| [10] | 邱健敏, 蔡爱英, 陈青树, 等. 雷公藤多苷对实验性自身免疫性脑脊髓炎核因子-κB和IL-2的影响 [J]. 山西医科大学学报, 2011, 42(11): 869-872. |
| [11] | Kupczyk M, Dahlén B, Dahlén S E. Which anti-inflammatory drug should we use in asthma? [J]. Pol Arch Med Wewn, 2011, 121(12): 455-459. |
 2014, Vol. 45
2014, Vol. 45


