松果菊苷(echinacoside,ECH),又称海胆苷(误名)、紫锥花苷,为苯乙醇苷类化合物,是管花肉苁蓉的有效成分之一。研究表明,ECH具有明显的神经保护作用,主要表现为抗活性氧自由基损伤。同时,其具有抗神经细胞凋亡、保护肝脏、抗炎、抗肿瘤、延缓衰老、促血管舒张活性、促进组织愈合、改善免疫调节等功能[1,2],其分子式为C35H46O20。目前,ECH与血清白蛋白(serum albumin,SA的相互作用研究尚未见文献报道。
SA是血浆中量最丰富的蛋白质,具有贮运内源代谢产物和外源药物分子等重要生理功能[3]。SA相对分子质量较小,溶解性较大、稳定性较好、与配体具有较好的亲和性,比较易于分离、提纯,可大量制备,且其三级结构已被人类所探知,常作为药物与蛋白质分子相互作用研究中的模型大分子。不同动物种类SA的分子结构、功能有差别,人血清白蛋白(human serum albumin,HSA)与牛血清白蛋白(bovine serum albumin,BSA)的氨基酸序列高度相似,BSA及HSA与药物的相互作用具有共性特征,而BSA价廉易得,因此,BSA是理想的模型蛋白质分子。BSA[4,5,6]是由582个氨基酸残基组成的单肽链蛋白质,其空间结构由3个结构域组成,每个结构域由2个亚结构域以槽口相对的方式形成圆筒结构,几乎所有的疏水性氨基酸残基都分布于圆筒的内部构成3个疏水腔。HSA是由585个氨基酸组成的单肽链蛋白质,由3个相似结 构域组成(I~III):结构域I(残基1~195),结构域II(残基196~383),结构域III(残基384~585),每个结构域又包含2个相似螺旋结构的亚域(A和B),6个亚域聚集在一起,形成不对称的心型分子,HSA分子内含有18个酪氨酸残基,唯一的色氨酸残基(Trp214)位于亚结构域II-A。与HSA不同的是,BSA缺失HSA氨基酸序列的116位和 585位残基,以及BSA在134位及213位各含1个色氨酸残基。BSA与HSA均具有广泛的应用价值,分析生理条件下药物与BSA的相互作用,可以获得药物的药效学信息,深入阐明药物结合机制,也有助于为HSA-药物结合机制的深入分析提供理论参考。
本实验基于光谱法结合分子模拟技术研究了中药活性成分ECH与BSA的相互作用,从获得的光谱数据确定了它们的结合反应常数、热力学常数及药物对蛋白质构象的影响,从分子水平上阐释ECH和BSA相互作用的机制,进而为分析ECH的药效作用机制提供参考。
1 实验部分 1.1 试剂与仪器BSA(质量分数≥98%)、三羟甲基氨基甲烷(Tris,GR),上海华美生物工程公司;ECH(质量分数≥98%),上海浩然生物技术有限公司;其他试剂均为分析纯,实验用水为亚沸蒸馏去离子水。配制浓度为0.1 mol/L pH 7.4的Tris-HCl缓冲溶液(内含0.10 mol/L NaCl维持离子强度),用此缓冲溶液配制浓度为10.0 μmol/& lt; /span>L BSA和浓度为1.0 mmol/L ECH贮备溶液。
ZD—2型精密酸度计,上海雷磁仪器厂;F—4500型荧光光度计,日本Hitachi公司;UV—2450型紫外-可见分光光度计,日本Shimadzu公司;SGI O2计算机图形工作站,DOCK软件(4.02版本)。
1.2 分子模拟利用SGI O2工作站的DOCK 4.02程序包建立药物与蛋白质相互作用模型,进行分子模拟计算。受体蛋白BSA的晶体结构来源于PDB蛋白质晶体数据库,编码4F5S。ChemDraw构建ECH的分子结构,基于分子力学MM2力场优化后利用Ganssian量化计算优化生成实验分子模型,分子对接预处理时使用AutoDock Toolkit(ADT)进行受体与配体的优化处理。分子对接技术对配体的不同取向进行定位,以经验势能函数作为评价函数,找到配体与受体的最佳结合方式,进而确认BSA活性部位[7]。
1.3 实验方法 1.3.1 BSA与ECH溶液的荧光光谱及ECH溶液的吸收光谱测定移取2.5 mL BSA溶液于1 cm的石英比色皿中,微量进样器逐次加入1.0 mmol/L ECH溶液进行荧光滴定(滴定剂累加体积≤100 μL),缓冲溶液进行荧光空白校正,测定时荧光发射与激发狭缝宽度均为2.5 nm,波长扫速1 200 nm/min,固定激发波长282 nm,室温下绘制250~900 nm的发射光谱;荧光光谱仪扫描激发波长和发射波长之间的波长差(Δλ)分别为15、60 nm的上述溶液体系的同步荧光光谱。发射与激发狭缝宽度同上,扫速240 nm/min,Tris-HCl缓冲溶液进行荧光空白校正。
1.3.2 荧光偏振光谱测定固定激发波长为282 nm,先以垂直偏振光激发样品,分别检测荧光的垂直偏振分量(IVV)和水平偏振分量(IVH);再以水平偏振光激发样品,检测荧光的垂直偏振分量(IHV)和水平偏振分量(IHH);室温下绘制250~900 nm的荧光偏振光谱。移取2.5 mL Tris-HCl缓冲溶液于1 cm石英比色皿中,微量进样器加入1.0 mmol/L ECH溶液,使其浓度为10.0 μmol/L,测定500~190 nm紫外吸收光谱,扫速60 nm/min扫描,狭缝宽度2.5 nm,缓冲溶液定基线。
2 结果与讨论 2.1 分子模拟研究分子模拟构建ECH与BSA相互作用的结合反应模型时,分别考虑BSA的Sudlow’s sites I、sites II[8]、6个脂肪酸结合位点及triethylene glycol药物结合位点进行ECH分子对接的模拟计算工作。分子对接ECH与BSA的结合模型见图 1。
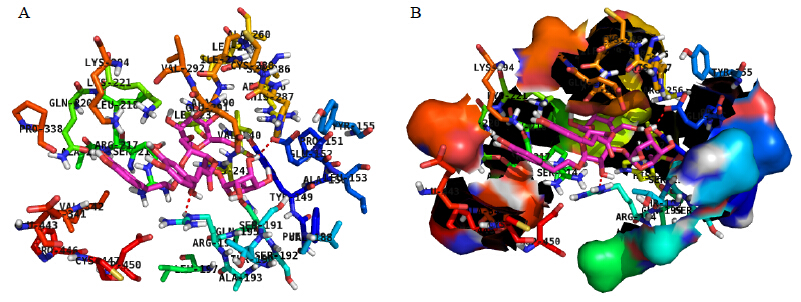 | 只显示配体周围1.00 nm的残基,BSA与配体结构用棍棒模型表示,其中红色的代表氧,红色虚线代表配体和蛋白质之间的氢键 only residues around 1.00 nm of theligand are displayed. The residues ofBSA and the ligand structure are representedusing stick model,there into red sticks represented oxygen.The hydrogen bond between the ligand andthe protein is represented using red dashedline图 1 ECH与BSA相互作用的分子对接图 (A) 及疏水表面图 (B) Fig. 1 Molecular docking mode (A) and hydrophobic surface map (B) of interation between ECH and BSA |
由图 1可见,ECH分子结合在BSA的表面活性口袋处。ECH分子距BSA酪氨酸残基(Tyr149和Tyr155)和苯丙氨酸(Phe148)很近,这解释了ECH猝灭BSA内源荧光现象。同时,ECH分子与BSA结合过程中,ECH分子中B环上与C环对位的羟基氧原子与Glu152发生氢键相互作用,C环上的羟基氧原子与Arg194发生氢键相互作用;另一方面,ECH非共价结合在BSA活性位点域,其结合口袋周围主要由Leu153、Leu197、Leu218、Leu237、Leu259、Ala150、Ala193、Ala216、Ala260、Ala290、Ala341、Phe148、Val188、Val240、Val292、Val342、Ile289、Pro151、Pro338、Pro446氨基酸残基形成疏水区域,由分子模拟结果可知氢键及范德华力起主要作用,是该药物与蛋白质分子结合的主要驱动力,同时也兼有疏水作用的存在。
由分子模拟结果可知,ECH与BSA的主要作用力为氢键和范德华力,兼有疏水作用力的存在,为验证ECH与BSA的键合机制和键合方式,通过光谱实验来进一步证实分子模拟的合理性。
2.2 BSA与ECH相互作用荧光光谱及结合反应机制图 2为BSA、ECH及二者以等物质的量混合体系的荧光光谱。在282 nm激发波长下,BSA最大发射波长为342 nm,而由ECH-BSA体系荧光光谱可以看出,药物的加入使BSA的荧光强度(F)降低,表明药物与BSA间存在着相互作用,发生了能量转移。
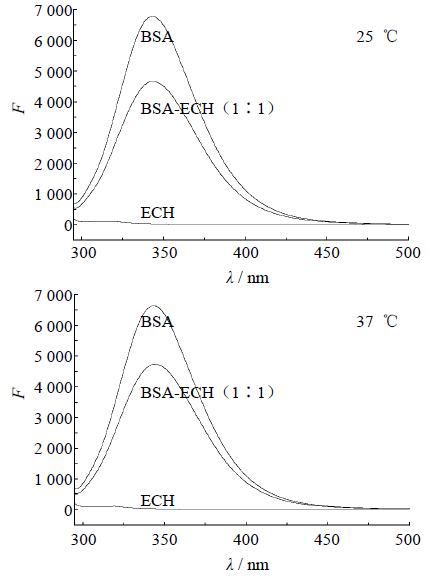 | 图 2 BSA-ECH体系中各试样的荧光图谱 Fig. 2 Fluorescence emission spectra of BSA-ECH solution system |
图 3为ECH-BSA的紫外吸收差谱,可以发现BSA的紫外吸收曲线及BSA-ECH等摩尔混合物与ECH的差谱几乎完全重合,表明ECH的加入并未使BSA的紫外吸收发生变化。同时由图 2可见,ECH在282 nm激发波长及342 nm发射波长下没有吸收,因此,可不考虑内滤光效应。
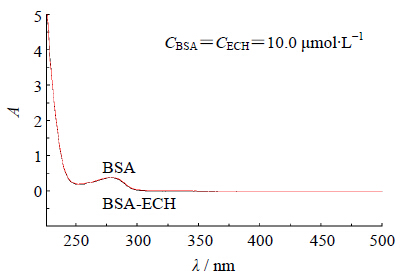 | 图 3 ECH-BSA的紫外吸收差谱 Fig. 3 UV absorption difference spectrum of ECH-BSA |
图 4为BSA荧光发射谱随ECH浓度的变化图。分析图 4可知,a峰为BSA的一级荧光峰,从图中可以看出随着药物的加入,a峰逐渐降低;b峰为激发峰的二级倍频荧光峰;c峰为BSA的二级倍频荧光峰。在固定BSA浓度的条件下,随着反应体系中药物浓度增大,BSA的荧光强度呈规律性的降低,这表明药物对BSA有猝灭作用。荧光最大发射峰位置出现了红移,25 ℃时红移为15 nm,37 ℃时为8 nm,说明ECH和BSA确实存在相互作用,ECH猝灭了BSA氨基酸残基的内源荧光,造成BSA分子中与ECH相互作用的氨基酸残基的微区环境发生一定变化。
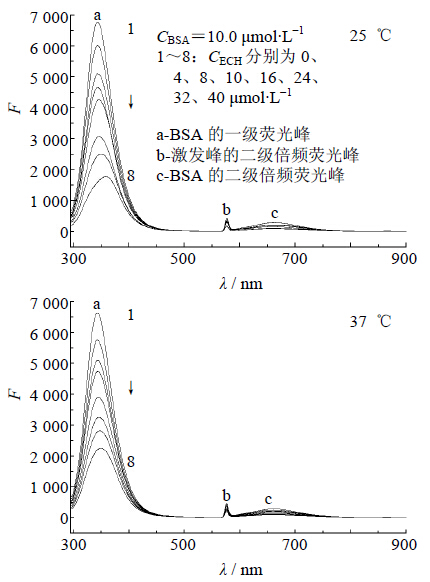 | 图 4 BSA与ECH相互作用的荧光图谱 Fig. 4 Fluorescence quenching spectra of BSA interacting with ECH |
蛋白质与药物分子相互作用的荧光猝灭过程通常分为静态猝灭与动态猝灭,动态猝灭过程遵循Stern-Volmer方程。静态猝灭是猝灭剂与荧光体分子在基态时生成不发光的复合物,由静态猝灭的实验数据可以求取结合参数。首先按Stern-Volmer[9]方程[F0/F=1+Kqτ0[D]=1+KSV[D],式中Kq为双分子猝灭过程速率常数;τ0为猝灭剂不存在时生物大分子的平均荧光寿命;[D]为猝灭剂ECH的浓度;KSV为Stern-Volmer猝灭常数,即双分子猝灭过程速率常数(双分子猝灭过程速率常数Kq=KSV/τ0)与单分子衰变速率常数的比率]处理上述体系。由实验测得ECH与BSA相互作用的荧光光谱数据,按Stern-Volmer方程处理可得图 5。
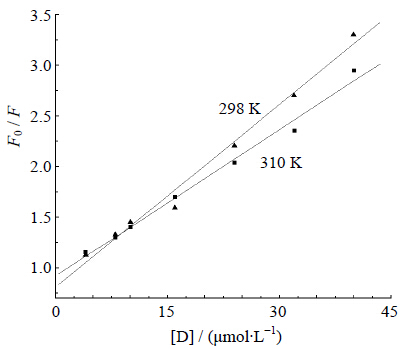 | 图 5 ECH对BSA荧光猝灭的Stern-Volmer图 Fig. 5 Stern-Volmer curves of BSA fluorescence quenching by ECH |
由于无猝灭剂时生物大分子的τ0为10-8 s数量级[10],则由实验数据可以通过Stern-Volmer方程计算不同温度下ECH-BSA相互作用的猝灭常数KSV、Kq,计算结果列于表 1。
|
|
表 1 BSA与ECH相互作用的猝灭参数 Table 1 Quenching constants of ECH binding with BSA |
目前,生物大分子与活性小分子相互作用的荧光猝灭机制研究中,常用2种方法判定荧光猝灭机制,一种方法是比较双分子猝灭过程速率常数与猝灭剂对生物大分子最大扩散碰撞猝灭速率常数(2.0×1010 L∙mol-1∙s-1)来间接判断荧光猝灭机制[11];另一种方法是通过变温实验直接推断荧光猝灭机制[12]。由表 1结果可知,ECH对BSA荧光猝灭的Stern-Volmer曲线有良好的线性关系,Kq值远大于2.0×1010 L/(mol∙s),说明ECH对BSA的猝灭是由于形成了复合物而引起的静态猝灭。另外,在不同温度下作ECH对BSA荧光猝灭的Stern-Volmer图(图 5)。由图 5可见,在选定的浓度范围内,随着温度升高,猝灭常数呈降低趋势,进一步确定了ECH对BSA的猝灭机制为静态猝灭。由此2个结果可以确定ECH与BSA的荧光猝灭机制为静态猝灭。
2.3 ECH与BSA相互作用的结合常数(K)及结合位点数(n)由实验数据分析得到ECH与BSA相互作用的动态荧光猝灭机制,则由荧光分子荧光强度-猝灭剂浓度关系得出结合参数的理论计算公式[13]:lg[(F0-F)/F]=lgK+nlg[Df],式中F0与F分别为猝灭剂加入前后荧光分子的相对强度,K是结合常数,n是结合位点数。因为加入的ECH溶 液体积远小于比色皿中溶液体积,可以合理采用猝灭剂的总浓度 [D] 代替 [Df]。以lg[D] 对lg[(F0-F)/F] 作双对数图(图 6),求得K和n值,结果列于表 2。
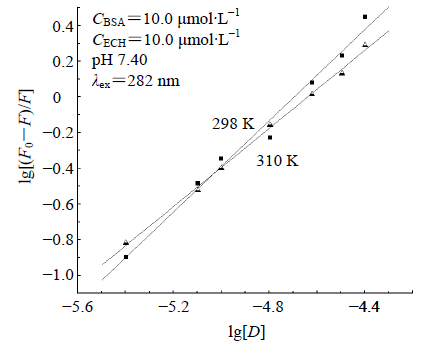 | 图 6 ECH-BSA体系荧光变化线性拟合图 Fig. 6 Fluorescence change linear fitting results of ECH-BSA system |
|
|
表 2 BSA与ECH的结合参数 Table 2 Binding parameters of ECH and BSA binding |
由图 6结合表 2可见,ECH与BSA之间存在结合强度较强的相互作用,ECH与BSA存在1个结合位点,说明ECH分子与BSA形成了较稳定的复合物。
2.4 ECH与BSA相互作用力的测定药物分子与生物大分子的相互作用力类型包括氢键、范德华力、静电引力、疏水相互作用,在一定温度范围内,相互作用过程的ΔH可视为常数,则可以计算相互作用的热力学参数。根据热力学公式[14]及前文求出的K,求得ECH与BSA结合反应的热力学参数。
ΔG=ΔH-T×ΔS
ΔG=-RTlnK
ln(K2/K1)=(ΔH/R)×(1/T1-1/T2)
求得的ΔG、ΔH及ΔS值列于表 3。药物与蛋白质的分子作用机制可根据药物-生物大分子的相互作用模式判定,药物与蛋白质相互作用的类型可由如下规则确定[15]:ΔS>0时为疏水和静电作用力;ΔS<0时为氢键和范德华力;ΔH>0,ΔS>0时为典型的疏水作用力;ΔH<0,ΔS<0时为氢键和范德华力。由表 3的结果可知,ECH与BSA的相互作用主要为氢键和范德华力。
|
|
表 3 ECH与BSA的热力学参数 Table 3 Thermodynamic parameters of ECH binding with BSA |
按照Förster非辐射能量转移机制[16]可以求出猝灭剂分子-蛋白质分子间的能量转移效率(E)及猝灭剂与蛋白质分子中荧光发射残基的结合距离(r)。据此理论,荧光发射体和荧光猝灭体之间的E和两者之间的r及临界能量转移距离(R0,E=50%时的临界能量距离)相关。
E=R06/(R06+r6)
R06=8.8×10-25K2N-4ΦJ
K2为偶极空间取向因子,N为介质的折射指数,Φ为蛋白质分子的光量子效率,J为蛋白质分子荧光发射光谱与药物吸收光谱间的光谱重叠积分
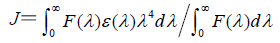
F(λ)为蛋白质分子在波长λ处的荧光强度;ε(λ)为药物在波长λ处的摩尔吸收系数
E则可以根据公式E=1-F/F0测得。
由获得的UV谱及荧光光谱作重叠光谱图,见图 7。从图 7可见,BSA的荧光发射谱与ECH的紫外吸收谱确有部分重叠。根据Förster的偶极-偶极非辐射能量转移理论[18]指出:当供能体与受能体足够靠近,距离在7 nm范围内时,被激发的供能体分子将会与近邻受能体分子发生非辐射能量转移现象。如果供能体发射荧光,供能体的荧光发射光谱将与受能体的吸收谱有足够的重叠,导致供能体荧光猝灭,并由此可以求出受能体分子和供能体分子的结合距离。
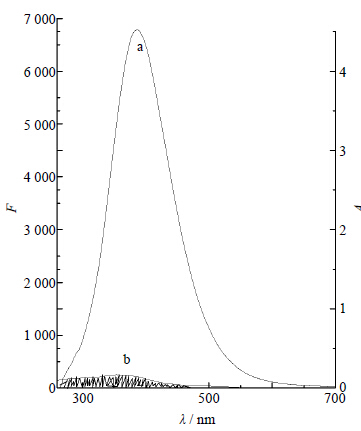 | 图 7 BSA的荧光发射谱 (a) 与ECH的紫外吸收谱 (b)的重叠图 Fig. 7 Overlapbetweenfluorescence emission spectra of BSA (a) and UV absorption spectra of ECH (b) |
本实验根据上述公式计算出BSA-ECH结合反应的光谱重叠积分J=1.43×10-14 cm3∙L/mol,求得E=0.31。在本实验条件下,取偶极空间取向因子为两结合物各向随机分布的平均值,即K2=2/3,光量子效率取色氨酸标准值Φ=0.118,折射指数N=1.336,将以上各量代入公式,可得到BSA的R0=2.62 nm,r为2.99 nm。r<7 nm,即BSA的氨基酸残基与ECH的距离小于7 nm,符合非辐射能量转移理论,氨基酸残基可将能量以非辐射方式转移至ECH,引起BSA的荧光猝灭。
2.6 ECH对BSA构象的影响蛋白质的同步荧光光谱中,Δλ=15 nm显示酪氨酸残基的荧光光谱特性,Δλ=60 nm显示色氨酸残基的荧光光谱特性。蛋白质中氨基酸残基的最大发射波长与其所处环境的极性有关,故由最大发射波长的变化可判断蛋白质构象的变化。固定BSA浓度,逐渐增加ECH浓度,可得到BSA-ECH体系的同步荧光光谱(图 8)。
 | 图 8 BSA-ECH体系的同步荧光光谱 Fig. 8 Synchronous fluorescence spectra of BSA- ECH system |
从图 8可见,BSA的荧光主要由色氨酸所贡献。随着药物浓度的增大,酪氨酸残基的最大发射波长基本保持不变(图 8-A);图 8-B显示,Δλ=60 nm时,色氨酸残基的最大发射波长出现了轻微蓝移现象,说明ECH与BSA的相互结合,导致BSA的构象发生变化,影响到BSA分子中色氨酸残基所处的微区环境,使其色氨酸残基所处的环境极性减小,组成疏水腔的肽链处于部分紧缩状态,疏水性有所增加。
2.7 BSA-ECH结合反应对BSA构象型态变迁的影响为了进一步了解ECH与BSA结合反应对BSA构象型态变迁的动力学机制,采用荧光相图法作进一步分析。荧光相图法是在发射波长λ1和λ2下测定蛋白质在不同实验条件下荧光强度I(λ1) 和I(λ2) 的变化来描述蛋白质的结构变化结果。荧光强度是一种广度性质,因此存在以下关系:I(λ1)=a+b I(λ2),a=I1(λ1)I1(λ2)[I2(λ1)-I1(λ1)] / [I2(λ2)-I1(λ2)],b=[I2(λ1)-I1(λ1)] / [I2(λ2)-I1(λ2)]。
若关系式I(λ1)=a+b I(λ2)表现为线性,则表示相应的蛋白质构象型态变迁过程符合“二态模型”;反之若为非线性,表明蛋白质的构象型态转变过程是一个序变过程;若该关系式表现为两条或多条直线,其中每一条直线都描述一个“全或无”的蛋白质结构变化过程,则符合“多态模型”。
本实验以I320-I365的相图反应结果最准确,图 9为根据实验数据作出的相应荧光相图。从图 9可以看出,ECH与BSA结合反应的荧光相图呈线性,说明ECH与BSA发生非共价结合作用时,BSA中构象型态变迁过程不是序变过程,是一个“二态”模型。
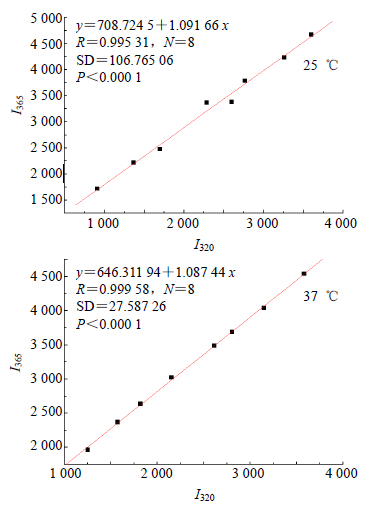 | 图 9 ECH-BSA体系的荧光相图 Fig. 9 Fluorescence phase diagram of ECH-BSA system |
偏振荧光光谱反映的是荧光体分子在激发波长下发射波长变化的偏振光谱。偏振荧光光谱可用偏振度(P)与各向异性(r)来度量,其中P可根据下式计算[10]:P=(IVV-GIVH)/(IVV+GIVH),其中G为校正因子(G=IHV/IHH),而r计算如下:r=(IVV-GIVH)/(IVV+2GIVH),其中G、IHV、IHH、IVV、IVH的含义与P计算公式中相同。固定BSA浓度,加入不同浓度的ECH后,读取偏振荧光数据并按公式计算各溶液体系的P及r值,结果见表 4。
|
|
表 4 ECH-BSA体系荧光偏振参数 Table 4 Fluorescence polarization parameters of ECH-BSA systems |
荧光体的P及r与荧光体的转动速度成反比。荧光体越小,转动速度越快,其P及r就越小。由表 4数据可见,在水溶液中荧光体分子BSA转动速度较快,消偏现象严重,P及r较小。而BSA与ECH发生相互作用后,BSA的P及r均有提高,说明药物与蛋白质分子之间存在分子间作用力,形成复合物后荧光体体积变大,分子转动受阻,旋转速度变慢,体系的黏度变大,因而荧光偏振度随之变大。实验数据定量证明了BSA与ECH发生相互作用,生成了非共价复合物。
2.9 分子模拟与实验结果的符合度分析根据光谱实验结果,ECH中色氨酸残基及酪氨酸残基所在微区位域与BSA之间具有明显的相互作用。但对接结果显示,在配体分子周围1.00 nm的范围内存在着2个酪氨酸残基,并未存在色氨酸残基。分子对接结果与实验结果存在一定差异。根据光谱实验测得ECH与BSA的结合距离为2.99 nm,将ECH-BSA周围2.90 nm的氨基酸残基分子对接后发现该范围内存在2个色氨酸残基Trp134和Trp213,能很好地解释ECH猝灭BSA内源荧光的现象。将ECH-BSA周围2.90 nm的氨基酸残基通过分子对接图显示出来(没有改变ECH-BSA内核结构及相互作用力),结果见图 10。
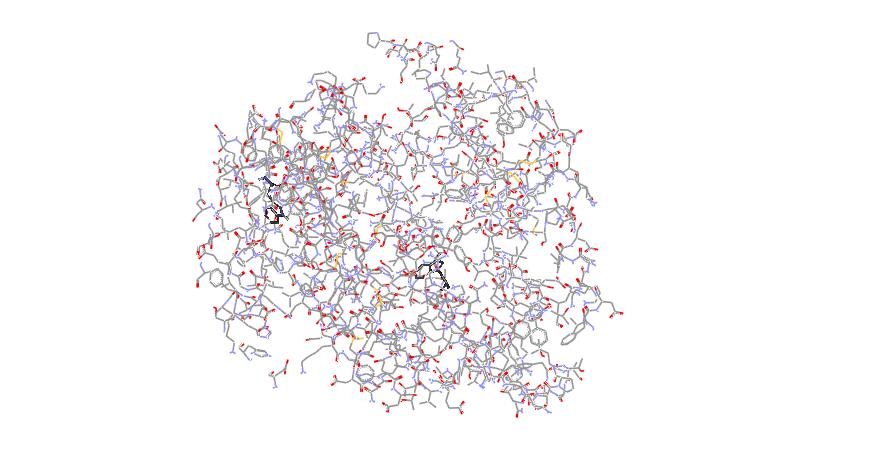 | 图 10 ECH与BSA相互作用的分子对接图 Fig. 10 Interaction mode between ECH and BSA |
由图 10可见,ECH插入BSA所在结构位域过程中,药物的进入在造成对接位点结构位域微区构象改变的同时,由于BSA分子倾向于保持整体能量最低的溶液“紧缩”型态,药物分子嵌入对接位点结构位域中势必会压缩邻近微区位域使其肽链受到挤压,相应的色氨酸邻近结构位域的肽链型态变化(即产生别构效应),使色氨酸残基所处的环境极性减小,组成疏水腔的肽链处于部分紧缩状态,疏水性有所增加,引起色氨酸残基的荧光光谱发生了蓝移。由图 8同步荧光光谱中,Δλ=60 nm的荧光谱最大发射波长轻微蓝移的结果可知,分子模拟与实验结果相一致。
3 结论本实验利用光谱法结合分子模拟技术研究了中药活性成分ECH与BSA的相互作用。分子模拟揭示了药物在BSA上的结合部位,综合实验得到热力学函数,确定了两者间的作用力,主要是氢键和范德华力作用兼有疏水作用。光谱法的结果显示药物分子与BSA之间的反应机制为动态猝灭。根据能量转移理论,说明发生了非辐射能量转移现象。ECH的加入可以引起BSA构象型态的转变,且转变符合“二态模型”。根据荧光偏振分析证明了BSA与药物确实发生了相互作用,生成了非共价复合物。实验结果与计算机模拟相一致。本研究不仅可为中药活性成分ECH与BSA分子相互作用的深入研究提供有益结果,而且对于中药其他有效成分与蛋白质分子的相互作用研究也具有一定的参考意义。
| [1] | Li H, Song A Q, Xue J H, et al. Protective effect of echinacoside on vascular endothelial cells [J]. J Xi’an Jiaotong Univ: Med Sci, 2013, 34(3): 387-392. |
| [2] | Zhong M, Chen H, Jiang Y, et al. Effects of echinacoside on striatal extracellular levels of amino acid neuro- transmitter in cerebral ischemia rats [J]. Chin Pharmacol Bull, 2012, 28(3): 361-365. |
| [3] | 刘 敏, 朱兰英, 曲秀葵, 等. 丹皮酚及其两种同分异构体与牛血清白蛋白相互作用的热力学研究 [J]. 化学学报, 2007, 65(16): 1555-1560. |
| [4] | Wu A, Lin C, Zhai Y, et al. Investigation of the interaction between two phenylethanoid glycosides and bovine serum albumin by spectroscopic methods [J]. J Pharm Anals, 2012, 3(1): 61-65. |
| [5] | Bourassa P, Kanakis C D, Tarantilis P, et al. Resveratrol, genistein, and curcumin bind bovine serum albumin [J]. J Phys Chem B, 2010, 114(9): 3348-3354. |
| [6] | Lu H, Shan X, Chen J, et al. Preparation of carbon quantum dots in wood charcoal and their interaction with bovine serum albumin [J]. Carbon, 2013, 28(4): 307-312. |
| [7] | 赵 琦. 基于分子对接技术的小分子-蛋白质相互作用研究 [D]. 无锡: 江南大学, 2009. |
| [8] | Hu Y J, Yue H L, Li X L, et al. Molecular spectroscopic studies on the interaction of morin with bovine serum albumin [J]. J Photochem Photobiol B, 2012, 112 (2): 16-22. |
| [9] | Lakowicz J R. 荧光光谱法原理 [M]. 第3版. 北京: 科学出版社, 2008. |
| [10] | Jiang C Q, Gao M X, He J X. Study of the interaction between terazosin and serum albumin synchronous fluorescence determination of terazosin [J]. Anal Chim Acta, 2002, 452(2): 185-189. |
| [11] | He W Y, Li Y, Si H Z, et al. Molecular modeling and spectroscopic studies on the binding of guaiacol to human serum albumin [J]. J Photochem Photobiol A: Chemistry, 2006, 182(2): 158-167. |
| [12] | 王 宁, 刘忠英, 胡秀丽, 等. 黄芩类药物与人血清白蛋白相互作用的研究 [J]. 高等学校化学学报, 2011, 32(2): 241-245. |
| [13] | 卞 伟, 卫艳丽, 王亚萍, 等. 荧光法研究咖啡因和茶碱与牛血清白蛋白相互作用 [J]. 光谱学与光谱分析, 2006, 26(3): 505-508. |
| [14] | 颜承农, 上官云凤, 童金强, 等. 双嘧达莫与牛血清白蛋白结合热力学特征的荧光光谱法研究 [J]. 光谱学与光谱分析, 2003, 23(3): 543-546. |
| [15] | Ross P D, Subramanian S. Thermodynamics of protein association reactions: forces contributing to stability [J]. Biochemistry, 1981, 20(11): 3096-3012. |
| [16] | Zhang G W, Que Q M, Pan J H, et al. Study of the interaction between icariin and human serum albumin by fluorescence spectroscopy [J]. J Mol Struct, 2008, 881(1/3): 132-138. |
| [17] | Lin H, Lan J F, Guan M, et al. Spectroscopic investigation of interaction between mangiferin and bovine serum albumin [J]. Spectrochim Acta Part A, 2009, 73(5): 936-941. |
 2014, Vol. 45
2014, Vol. 45


