2. 华中科技大学同济医学院协和医院 药剂科, 湖北 武汉 430020
2. Wuhan Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430022, China
多糖是自然界中最丰富的生物大分子,广泛存在于动物、植物和微生物(细菌和真菌)中[1]。真菌多糖作为药物研究始于20世纪50年代,60年代后由于其免疫抑制作用而受到广泛关注,目前从真菌子实体和菌丝体中已得到数百种真菌多糖,香菇多糖一直是该领域研究的热点和难点。1969年,日本学者Chihara等[2]首次从香菇Lentinus edodes (Berk.) Sing. 子实体中提取得到具有明显抗肿瘤活性的香菇多糖(lentinan),其结构为β-(1→3)-D-葡聚糖。现代研究表明香菇多糖除具有抗病毒[3]、抗肿瘤[4]、调节免疫力[5]等药理活性外,还有降血糖[6]、抗氧化[7]等多种功效。
目前学者普遍认为香菇多糖的活性与其理化性质、化学结构和糖链构象有很大关系。有研究指出,大多从香菇中提取的活性多糖都具有以下特征:主链结构为β-(1→3)-D-葡聚糖,相对分子质量主要分布在4×105~8×105,糖链构象为多股螺旋结构;但也有研究表明相对分子质量小于4×105的香菇多糖也具有较好的抗肿瘤活性[8]。我国近年来也开展了大量香菇多糖的研究工作,已成功开发出香菇多糖注射剂及多种相关保健品,作为癌症的辅助治疗广泛应用于临床[9]。随着我国香菇多糖提取工艺的研究不断深入,稀碱浸提法已成为最具有代表性的工艺。与传统的热水浸提法相比,所得粗多糖产率和纯度更高[10]。本研究采用碱提法从香菇子实体中提取相对分子质量小于4×105的单一组分香菇多糖,并对其结构、糖链构象以及体外抗肿瘤活性进行研究,以期为多糖的构效关系和相对分子质量小于4×105香菇多糖的开发利用提供基础。
1 仪器与材料1100 LC/MSD Trap二维液相色谱-离子阱质谱联用仪、7890A/5975C型气相色谱质谱联用仪、Agilent-HP5交联毛细管玻璃柱(美国Agilent公司),Lambda 35紫外可见分光光度计(美国PerkinElmer公司),美国Cary—50型紫外分光光度仪(美国Varian公司),CHRIST冻干机(德国Marin Christ公司),VERTEX 70傅里叶变换显微红外/拉曼光谱仪(德国Bruker公司),AV400核磁共振波谱仪(瑞士Bruker 公司),酶标仪,XD—101倒置显微镜,Air Tech标准净化工作台(苏净集团安泰公司制造),FORMAIII CO2水套培养箱(美国FORMA公司)。氢氧化钠,浓硫酸,苯酚,医用酒精,刚果红,5-氟尿嘧啶(5-FU),实验用水为双蒸水,Dextran-T系列标准品、葡萄糖(批号LB60595)、半乳糖(批号SL08403)、甘露糖(批号SL08455)、阿拉伯糖(批号10115077)、木糖(批号LB56239)和鼠李糖(批号10137156)对照品(Sigma公司),其他试剂均为分析纯。
香菇购自武汉太平洋商城,产地湖北房县,由华中科技大学同济医学院药学院中药部阮金兰教授鉴定伞形科香菇属香菇Lentinus edodes(Berk.) Sing. 的子实体。
昆明小鼠(清洁级),雌性,体质量18~22 g,动物合格证号:SCXK 2004-0007。
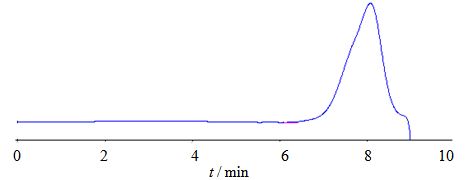
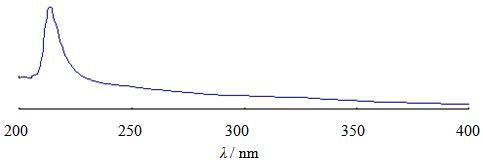
2 方法与结果 2.1 香菇多糖的提取、分离与纯化香菇子实体经剪碎、乙醇浸泡24 h后,采用沸水浸提,除去水提液,滤干后的香菇子实体再用碱提,再经5 mol/L的HAc溶液调碱提液的酸碱度至pH 7,离心弃去沉淀,上清液浓缩后醇沉得到粗多糖;采用1% H2O2对粗多糖进行脱色;脱色后粗多糖依次用超滤膜进行分离,收集中间组分的滤液,经冻干得到精制香菇多糖,命名为LNT2。苯酚-硫酸法测定LNT2的含糖量为94.99%;高效凝胶色谱法(HPGPC)测定LNT2的相对分子质量为1.852×105(图 1);LNT2在200~400 nm波长进行扫描,结果表明在280、260 nm处没有吸收峰(图 2),表明样品中不含蛋白质和核酸;参照《中国药典》2010年版二部附录VIE旋光度测定的方法进行比旋光度测定,LNT2的比旋光度为+8.03°。
|
图 1 LNT2的HPGPC色谱图 Fig. 1HPGPC of LNT2 |
|
图 2 LNT2的紫外扫描图 Fig.2 UV scanning spectrum of LNT2 |
采用气相色谱-质谱联用(GC-MS)对多糖样品进行单糖组成分析。首先将多糖完全水解成单糖,然后衍生化生成糖氰乙酸酯进行GC-MS分析[11]。将样品以及各单糖对照品制备成适合进行气相分析的糖氰乙酸酯衍生物后,通过比对在相同色谱条件下各单糖对照品衍生物色谱峰的保留时间和色谱峰峰面积,来确定多糖样品中单糖组成的种类以及比例。
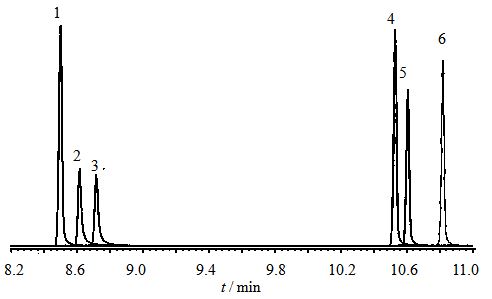
精制香菇多糖LNT2经2 mol/L硫酸水解,水解产物和各单糖对照品衍生物经GC-MS分析,得到色谱图(图 3、4)。LNT2在GC-MS色谱图中的tR(10.618 min)与标准单糖中D-葡萄糖的tR(10.609 min)一致;与NIST08标准质谱库比较,得出LNT2全水解衍生物为D-吡喃葡萄糖糖氰乙酸酯。综上所述,全水解实验结果表明LNT2仅由D-吡喃葡萄糖组成。

|
图 3 LNT2 GC-MS色谱图 Fig.3 GC-MSchromatogram of LNT2 |
|
图 4 单糖对照品GC-MS色谱图
Fig.4 GC-MSchromatogram of monosaccharide reference substance
1-鼠李糖 2-阿拉伯糖 3-木糖 4-甘露糖 5-D-葡萄糖 6-半乳糖 1-rhamnose 2-arabinose 3-xylose 4-mannose 5-D-glucose 6-galactose |
高碘酸可以选择性氧化糖的邻二羟基或邻三羟基,生成相应的多糖醛、甲醛或甲酸;反应定量地进行,每开裂1个C-C键消耗1分子高碘酸,通过测定高碘酸的消耗量及甲酸的释放量,可以判断糖苷键的位置、糖残基的种类和比例。
以高碘酸钠的浓度为横坐标(X),吸光度(A)值为纵坐标(Y),绘制标准曲线。得到回归方程:Y=8.732 4 X+0.005 3,R2=0.999 9。根据反应前后A值的变化计算高碘酸的消耗量,通过滴定计算甲酸的生成量。根据多糖的高碘酸氧化规律,计算得LNT2中各糖残基的量及比值。结果1-3或1-3-6连接的糖残基占74.4%,C-1,6或末端连接的糖残基占25.6%,残基比为2.91∶1。
2.2.3 甲基化分析甲基化分析常采用改良的Hakomori法[12, 13]。称取精制香菇多糖20 mg,溶于无水DMSO中,先与甲基亚磺酰甲基钠反应,再用碘甲烷进行甲基化,反应液经蒸馏水透析、冻干,经IR检测甲基化样品在3 500 cm-1附近无吸收峰,得到全甲基化样品。全甲基化样品先用 90%甲酸于100 ℃密闭水解6 h,再用 2 mol/L三氟乙酸于100 ℃密闭进一步水解6 h,减压蒸干后先与1 mol/L醋酸反应,再与醋酸酐反应,得全甲基化糖醇乙酸酯,最后进行GC-MS分析。
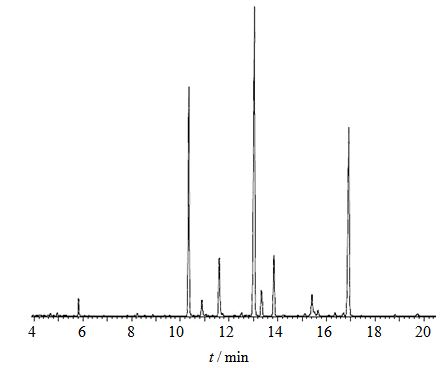
由GC-MS色谱图(图 5)可知:精制香菇多糖LNT2主要由1-、1-3、1-3-6连接的D-吡喃葡萄糖组成,分支侧链为1, 3-连接D-吡喃葡萄糖C6位上的末端葡萄糖基;各连接类型糖残基的物质的量比为1∶1.70∶1.08,与高碘酸氧化实验结果基本符合。LNT2甲基化实验GC-MS结果分析见表 1。
|
图 5 LNT2甲基化实验GC-MS色谱图 Fig. 5 GC-MS chromatogram of methylation of LNT2 |
|
|
表 1 LNT2甲基化实验结果 Table 1 Results of methylation of LNT2 |
取干燥多糖样品(LNT2)约2 mg,加入100~200 mg干燥的KBr晶体,在玛瑙研钵中研磨成均匀粉末,用压片机压片。采用傅里叶变换红外光谱仪在4 000~400 cm-1扫描分析。
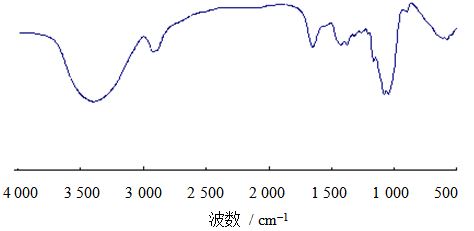
LNT2的红外图谱(图 6)显示:3 396 cm-1处的吸收峰为O-H的伸缩振动峰;1 424和2 922 cm-1处分别为C-H的变角振动和伸缩振动峰;896 cm-1处有弱吸收峰,为β糖苷键的吸收峰;1 162、1 077和1 043 cm-1处3个相关吸收峰为吡喃环上C-O-C和C-O-H的伸缩振动所致。在875、813 cm-1处几乎无吸收,说明LNT2中不含甘露糖。由图谱分析可知,LNT2是多糖类化合物,为β-吡喃糖环的结构。
|
图 6LNT2的IR扫描图 Fig. 6Results of methylation of LNT2 |
(1)部分酸水解:称取100 mg精制多糖样品,加10 mL 0.1 mol/L三氟乙酸,封管于100 ℃水解1 h。蒸馏水透析后,袋内溶液经冻干后得到LNT2的部分酸水解产物,命名为LNT2-p。
(2)样品测试:称取LNT2-p约50 mg于核磁管中,对样品LNT2-p进行1H-NMR谱、13C-NMR谱和DEPT-135谱测定。根据实验结果,13C-NMR谱表明LNT2-p所有糖残基的异头碳信号均出现在δ 103.4,为β构型糖残基,与红外光谱分析得出的结果相符,与甲基化标准单糖的NMR数据比较[14, 15],C-3信号 (δ 86.8) 向低场移动说明含有C-3位被取代的糖残基,C-6信号 (δ 68.9) 向低场移动表明含有C-6位被取代的糖残基。1H-NMR谱表明LNT2-p有4个糖残基,糖残基的异头氢信号分别为δ 4.52、4.64、4.91和5.17;各糖残基峰强比为1∶1∶1∶1。
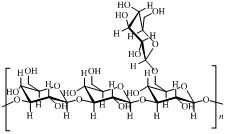
DEPT-135谱表明LNT2-p含有C-6位 (δ 61.4) 未被取代的糖残基。综合以上分析,可以初步推断LNT2的基本结构单元见图 7。
|
图 7 LNT2的基本化学结构 Fig. 7 Basic chemical structure of LNT2 |
称取一定量的刚果红,用蒸馏水配制成0.2 mmol/L的刚果红溶液、2 mg/mL的LNT2样品溶液和不同浓度的NaOH溶液(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mol/L),备用。将多糖溶液(2 mg/mL)和刚果红溶液(0.2 mmol/L)等体积混合(各2 mL)再加入4 mL不同浓度的NaOH溶液后,混合摇匀,依次测定混合液在0~0.5 mol/L的NaOH溶液中各溶液最大吸收波长(λmax)的变化。
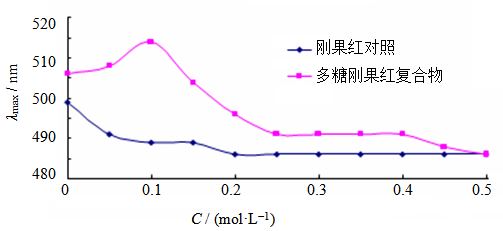
LNT2的刚果红实验结果(图 8)表明,LNT2与刚果红形成络合物在NaOH溶液0~0.5 mol/L内λmax的变化如下:在0~0.1 mol/L NaOH溶液中,络合物的λmax出现红移,并当NaOH溶液浓度为0.1 mol/L时达到最大值,可能是LNT2在弱碱环境下其溶解度逐渐增大所致;当NaOH溶液浓度大于0.1 mol/L时,络合物的λmax逐渐减少,并当NaOH浓度为0.5 mol/L时,络合物的最大吸收波长下降到与刚果红溶液一致,表明LNT2高度有序的螺旋结构逐渐解体。综合文献报道[16],初步 得出LNT2在较低浓度NaOH溶液中呈三螺旋构象。
|
图 8 LNT2刚果红实验结果 Fig. 8 Results of Congo-red test of LNT2 |
采用MTT法进行肿瘤细胞抑制实验检测。将H22细胞注入小鼠腹腔中进行细胞传代培养,从H22腹水瘤小鼠的腹水中抽取处于对数生长期的H22细胞,用含10%胎牛血清RPMI 1640培养液调整肿瘤细胞浓度至1×105 /mL。接种于96孔培养板。每孔加细胞悬液100 μL(1×104个细胞)。实验设对照组(含10%胎牛血清的RPMI-1640培养液),香菇多糖各浓度(800、400、200、100、50、25、12.5 μg/mL)组,阳性对照组(5-FU),共9组,每组设6个复孔。香菇多糖各浓度组每孔加入100 μL的各浓度多糖溶液,阳性对照组每孔加入 100 μL 200 mg/mL 5-FU溶液,调整板内各孔液体总量,使其均为200 μL,不足者补以含10%胎牛血清的RPMI 1640培养液。培养板混匀后置37 ℃、5% CO2和95%湿度条件下培养24 h后,每孔加入5 mg/mL的MTT磷酸盐缓冲液20 μL,同样条件下继续培养4 h,终止培养,2 000 r/min离心10 min,然后弃去培养孔内的培养液,每孔加入150 μL DMSO,震摇10 min,使形成的甲臜颗粒充分溶解后,混匀后用酶标仪于490 nm波长处测定各孔的吸光度(A490)值,按下面公式计算细胞生长抑制率。
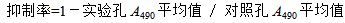
采用SPSS 17.0统计软件进行分析,数据以表示,组间比较用t检验。LNT2体外抗肿瘤活性结果见表 2。
|
|
表 2 LNT2对肝癌实体瘤细胞H22生长抑制作用(x±s,n=6) Table 2 Table2 Inhibitory effect of LNT2 on growth of liver cancer solid tumor cells H22(x±s,n=6) |
由表 2可知,在12.5~800 μg/mL时,与对照组和5-Fu组比较,LNT2对H22细胞具有显著的抑制作用,并且随着浓度的增加,细胞的生长抑制率也随之升高,呈量效依赖性。当LNT2的质量浓度为800 μg/mL时,抑制率最高达到52.62%。
3 讨论本实验采用的提取工艺简单、有效,且未使用有害试剂。得到的精制香菇多糖LNT2经HPGPC和UV实验表明为均一相对分子质量的多糖组分,不含蛋白质和核酸,其相对分子质量为1.852×105,比旋光度为+8.03°;进一步的化学分析和光谱分析表明LNT2的结构为具有分支侧链的β-(1→3)-D-葡聚糖,与大多文献报道[8]的抗肿瘤活性多糖的结构特征相符。现代研究表明,多糖的活性不仅与其一级结构有关,而且与糖链的高级构象密切相关,大量研究表明,只有具有三股螺旋结构的香菇多糖才具有较强的生物活性[17]。实验结果表明LNT2的糖链构象为三股螺旋构象,具有潜在抗肿瘤活性的研究价值。为了进一步研究LNT2的高级构象,后续还将进行X射线衍射和原子粒扫描(ATM)实验。
体外抗肿瘤实验表明LNT2具有明显抑制鼠肝腹水瘤H22细胞的活性。Fan等[18]和Joseph等[19]报道在体外具有一定抗肿瘤活性的多糖在体内也具有抗肿瘤作用,因此后续实验将进一步对LNT2在小鼠体内抗肿瘤的活性进行研究,以对其体内、外抗肿瘤活性进行全面的评估。
大多从香菇中提取的抗肿瘤活性多糖其相对分子质量主要分布在4×105~8×105,而本实验从香菇子实体得到的香菇多糖LNT2相对分子质量为1.852×105,同样具有一定的体外抗肿瘤活性。因此为相对分子质量小于4×105香菇多糖的开发利用提供了一定基础,在今后研究中,可以对不同相对分子质量香菇多糖的结构与活性之间的关系进行探讨,为多糖类药物的研究和开发提供理论依据。
| [1] | Mizuno T. Development of antitumor polysaccharides from mushroom fungi[J]. Foods Food Ingred J Jpn, 1996, 167: 69-85. |
| [2] | Chihara G, Maeda Y, Hamuro J, et al. Inhibition of mouse sarcoma 180 by polysaccharides from Lentinus edodes (Berk.) Sing[J]. Nature, 1969, 222: 687-688. |
| [3] | Lorenzen K, Anke T. Basidiomycetes as a source for new bioactive natural products[J]. Curr Org Chem, 1998(2): 329-364. |
| [4] | Borchers A T, Stern J S, Hackman R M, et al. Mushrooms, tumors, and immunity[J]. Proc Soc Exp Biol Med, 1999, 221(4): 281-293. |
| [5] | Choo Ooi V E, Liu F. A review of pharmacological activities of mushroom polysaccharides.[J]. Inter J Med Mushrooms 1999, 1(3): 195-206. |
| [6] | Tzianabos A O. Polysaccharide immunomodulators as therapeutic agents: structural aspects and biologic function[J]. Clin Microbiol Rev, 2000, 13(4): 523-533. |
| [7] | Reshetnikov S V, Tan K K. Higher basidiomycota as a source of antitumor and immunostimulating poly-saccharides (review)[J]. Inter J Med Mushrooms, 2001, 3(4): 361-394. |
| [8] | Zhang Y, Li S, Wang X, et al. Advances in lentinan: Isolation, structure, chain conformation and bioactivities[J]. Food Hydrocolloid, 2011, 25: 196-206. |
| [9] | Higashi D, Seki K, Ishibashi Y, et al. The effect of lentinan combination therapy for unresectable advanced gastric cancer[J]. Anticancer Res, 2012, 32(6): 2365-2368. |
| [10] | Wang X, Xu X, Zhang L. Thermally induced conformation transition of triple-helical lentinan in NaCl aqueous solution[J]. J Phys Chem B, 2008, 112(33): 10343-10351. |
| [11] | Hawksworth D L. The Tropical Fungal Biota: Census, Pertinence, Prophylaxis, and Prognosis[M]. Cambridge: Cambridge University Press, 1993. |
| [12] | Shu T C. Global impact of edible and medicinal mushrooms on human welfare in the 21st century: nongreen revolution[J]. Inter J Med Mushrooms, 1999, 1(1): 1-7. |
| [13] | Mizuno T. The extraction and development of antitumor-active polysaccharides from medicinal mushrooms in Japan (Review)[J]. International J Med Mushrooms, 1999, 1(1): 9-29. |
| [14] | Sharon N, Lis H. Carbohydrates in cell recognition[J]. Scientific Ame, 1993, 268(1): 82-89. |
| [15] | Mizuno T, Saito H, Nishitoba T, et al. Antitumor-active substances from mushrooms[J]. Food Rev Int, 1995, 11(1): 23-61. |
| [16] | Yui T, Ogawa K, Kakuta M, et al. Chain conformation of a glucurono-xylo-mannan isolated from fruit body of Tremella fuciformis Berk[J]. J Carbohydr Chem, 1995, 14(2): 255-263. |
| [17] | Wasser S. Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J]. Appl Microbiol Biotechnol, 2002, 60(3): 258-274. |
| [18] | Fan L, Ding S, Ai L, et al. Antitumor and immuno-modulatory activity of water-soluble polysaccharide from Inonotus obliquus[J]. Carbohydr Polym, 2012, 90: 870-874. |
| [19] | Joseph M M, Aravind S R, George S K, et al. A galactomannan polysaccharide from Punica granatum imparts in vitro and in vivo anticancer activity[J]. Carbohydr Polym, 2013, 98: 1466-1475. |
 2014, Vol. 45
2014, Vol. 45


