2. 天津中医药大学 天津市中药化学与分析重点实验室, 天津 300193;
3. 天津天士力现代中药资源有限公司, 天津 300410
2. Tianjin Key Laboratory of TCM Chemistry and Analysis, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
3. Tianjin Tasly Modern TCM Resources Co., Ltd., Tianjin 300410, China
白酒草Conyza japonica (Thunb.) Less. 为菊科白酒草属植物,产于我国浙江、福建、台湾、江西、湖南、广东、广西、云南、贵州及西藏等省区。常生于山谷田边、山坡草地或林缘,海拔700~2 500 m。根或全草药用,治疗小儿肺炎、胸膜炎、喉炎、角膜炎等症[1]。本课题组曾从白酒草及同属植物金龙胆草Conyza blinii Levl.、苏门白酒草Conyza sumatrensis (Retz.) Walker和小蓬草Conyza canadensis (L.) Cronq. 中分离得到多个化合物,并对白酒草属植物化学成分进行综述。迄今从该属植物中获得的天然产物有三萜皂苷类、黄酮类、鞘脂类、二萜类、倍半萜类、苯丙素类化合物等[2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16]。为了明确白酒草生物活性成分,同时为植物分类学提供化学依据,本实验进一步对其进行系统的化学成分研究,从白酒草全草中分离得到12个化合物,分别鉴定为白酒草皂苷U(conyzasaponin U,1)、白酒草皂苷T(conyzasaponin T,2)、白酒草皂苷O(conyzasaponin O,3)、白酒草皂苷M(conyzasaponin M,4)、山柰酚-3-O-葡萄糖苷(kaemferol-3-O- glucoside,5)、木犀草素(luteolin,6)、槲皮素-3- O-(6″-咖啡酰基)-β-D-半乳糖苷 [quercetin-3-O-(6″- caffeoyl)-β-D-galactopyranoside,7]、槲皮素-3-O-(6″-咖啡酰基)-β-D-葡萄糖苷[quercetin-3-O-(6″- caffeoyl)-β-D-glucopyranoside,8]、槲皮素-3-O-半乳糖苷(quercetin-3-O-galactoside,9)、槲皮素-3-O-葡萄糖苷(quercetin-3-O-glucoside,10)、槲皮素(quercetin,11)、β-谷甾醇(β-sitosterol,12)。以上化合物均为首次从白酒草中获得,其中化合物1、2为2个新的三萜皂苷,分别命名为白酒草皂苷U(1)和白酒草皂苷T(2)。
1 仪器与材料INOVA 500 FT核磁共振仪;XT4A型显微熔点测定仪(北京市科仪电光仪器厂);Sephadex LH-20为Amersham Pharmacia生物技术公司生产;ODS(Chromatorex,20~45 μm)为Fuji Silysia化学有限公司生产;柱色谱用硅胶及薄层色谱用GF254硅胶均为青岛海洋化工厂生产;D-101大孔吸附树脂为天津海光化工有限公司产品。所用试剂均为分析纯。
实验材料于2004年8~9月采自云南昆明,经中国科学院北京植物研究所陈艺林研究员鉴定为白酒草Conyza japonica (Thunb.) Less.,标本(S200409001)存放于天津大学药学院。
2 方法 2.1 提取与分离白酒草干燥全草2.5 kg,粉碎,依次用95%、60%乙醇回流提取2次,每次2 h,合并提取液,滤过,回收乙醇所得浸膏用适量水分散,依次用石油醚(3 L×4)、醋酸乙酯(3 L×4)和正丁醇(3 L×4)萃取,萃取液回收溶剂,分别得到各萃取物38、55、127 g。正丁醇萃取物用水溶解后,经D-101大孔吸附树脂柱色谱,依次用水及30%、50%、95%乙醇洗脱,50%乙醇洗脱 部分(45 g)经硅胶柱色谱,氯仿-甲醇-水(7∶3∶0.3→6.5∶3.5∶0.35→6∶4∶0.4→5.5∶4.5∶0.45→5∶5∶0.5→4∶6∶0.6)梯度洗脱。得到的流分32~42(5 g)经RP-HPLC得到化合物4(150 mg)。流分43~55(13 g)经过ODS柱色谱,30%、50%、70%、100%甲醇梯度洗脱得到20个流分,流分11~15经过一次ODS柱色谱,甲醇-水洗脱,得到的流分6~9经Pre-HPLC得到化合物1(100 mg),流分12~16经ODS柱色谱,甲醇-水洗脱,得到化合物2(10 mg)和3(50 mg)。醋酸乙酯部分(55 g)用硅胶柱色谱分离,用氯仿-甲醇(99∶1→97∶3→95∶5→9∶1→85∶15→8∶2→7∶3→6∶4→5∶5)梯度洗脱,共收集70个流分。流分11~14经硅胶柱色谱(氯仿-丙酮)分离所得流分10和11合并经重结晶得到化合物12(12 mg)。流分33~43经硅胶柱色谱(氯仿-甲醇)、Sephadex LH-20纯化得到化合物6(18 mg)、11(50 mg)。流分19和20经硅胶柱色谱、Sephadex LH-20纯化得到化合物5(15 mg),流分21~28经硅胶柱色谱、ODS柱色谱纯化得到化合物7和8的混合物(13 mg)以及9和10的混合物(18 mg)。
2.2 化合物1和2的薄层酸水解取少量化合物1和2,以甲醇溶解,点于高效薄层板上,置于加有浓盐酸的烧杯中(底部放一支持物使薄层板不直接与盐酸接触),烧杯密封,于80 ℃水浴加热15 min,挥干浓盐酸,葡萄糖、阿拉伯糖、木糖、鼠李糖和芹糖对照品点样,用醋酸乙酯-甲醇-水-冰醋酸(13∶2∶1∶1)为展开剂,以苯胺-邻苯二甲酸为显色剂。
3 结构鉴定化合物1:白色晶体(甲醇),mp 234~235 ℃,-25.7° (c 1.08,MeOH),HR-ESI-MS m/z: 1 495.656 3(计算值1 495.654 5,[M+Na]+),结合13C-NMR和DEPT谱确定其分子式为C67H108O35。
1H-NMR (500 MHz,C5D5N) 和13C-NMR (125 MHz,C5D5N) 显示6个角甲基单峰信号δH0.96 (3H,s),1.11 (6H,s),1.32 (3H,s),1.54 (3H,s),1.73 (3H,s) 和δC 15.0,17.4,17.7,24.8,27.2,33.2及双键信号δH 5.60 (brs) 和δC 123.0,144.4,提示化合物1可能为具有齐墩果烷-12-烯基本骨架的三萜皂苷,综合分析1H-NMR谱、13C-NMR谱、DEPT谱、COSY谱、HMBC谱、HMQC谱、NOESY谱,并与文献报道[11]对照,确定苷元为远志酸(polygalacic acid,2β,3β,16α,23-tetrahydroxy-olean-12-en-28-oic acid)。C-3 (δ 82.9) 和C-28 (δ 176.3) 提示化合物1在3、28位成双糖链苷。在NMR谱中显示了7个糖的端基质子信号δH 5.04 (1H,d,J = 8.0 Hz),5.09 (1H,d,J = 7.5 Hz),5.12 (1H,d,J = 7.5 Hz),5.17 (1H,d,J = 8.0 Hz),5.67 (1H,brs),6.38 (1H,brs),6.48 (1H,brs) 及端基碳信号δC 109.4,106.5,106.3,105.4,105.2,101.1,93.4。信号δH 1.73 (3H,d,J = 6.0 Hz),δC 18.5提示有1个6-去氧糖存在。薄层酸水解结果表明化合物1中含有鼠李糖、木糖、阿拉伯糖、葡萄糖、芹糖5种糖。综合分析1H-NMR谱、13C-NMR谱、DEPT谱、COSY谱、HMBC谱、HMQC谱、NOESY谱,对化合物1中所有碳氢信号进行归属,将糖的核磁数据与1已知化合物白酒草皂苷M[11]中糖的核磁数据比较,确定化合物1中含有1个β-D-吡喃葡萄糖基、2个α-L-吡喃阿拉伯糖基、2个β-D-吡喃木糖基、1个α-L-吡喃鼠李糖基和1个β-D-呋喃芹糖基(图 1)。苷元C-3位糖链连接顺序根据HMBC谱(图 2)以下相关得以确定:Xyl′的H-1 (δ 5.17) 和Glc的C-3 (δC 87.7),Glc的H-1 (δH 5.12) 和苷元C-3 (δC 83.0) 的HMBC相关;苷元C-28位糖链连接顺序根据HMBC谱(图 2)以下相关得以确定:Ara′的H-1 (δ 5.09) 和Api (f ) 的C-2 (δ 84.5),Api (f) 的H-1 (δ 6.38) 和Xyl的C-3 (δ 83.2),Xyl的H-1 (δ 5.04) 和Rha的C-4 (δ 83.6),Rha的H-1 (δ 5.67) 和Ara的C-2 (δ 75.5),Ara的H-1 (δ 6.48) 和苷元C-28 (δ 175.9) 有远程相关,并由NOESY谱中以下相关关系(图 2)进一步确证:Xyl′的H-1 (δ 5.17) 和Glc的H-3 (δ 4.05),Glc的H-1 (δ 5.12) 和苷元H-3 (δ4.30),Ara′的H-1 (δ 5.09) 和Api (f ) 的H-2 (δ 4.99), Api (f ) 的H-1 (δ 6.38) 和Xyl的H-3 (δ 4.08),Xyl的H-1 (δ 5.04) 和Rha的H-4 (δ 4.30),Rha的H-1 (δ 5.67) 和Ara的H-2 (δ 4.49) 相关。
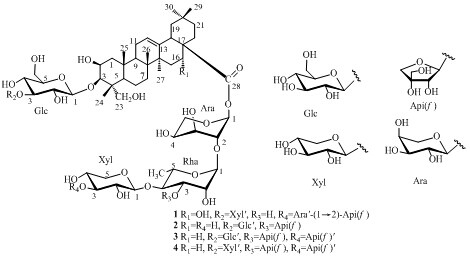
|
图 1 化合物1~4的结构 Fig. 1 Structures of compounds 1—4 |
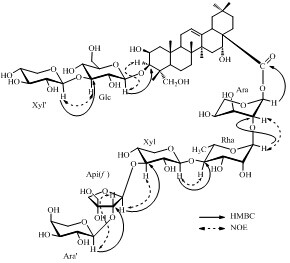
|
图 2 化合物1主要的HMBC和NOE相关 Fig. 2 Key HMBC and NOE correlations of compound 1 |
故确定化合物1的结构为:3-O-β-D-xylopyra- nosyl-(1→3)-β-D-glucopyranosyl polygalacic acid 28- O-α-L-arabinopyranosyl-(1→2)-β-D-apiofuranosyl- (1→3)-β-D-xylopyranosyl-(1→4)-α-L-rhamnopyra- nosyl-(1→2)-α-L-arabinopyranosyl ester,为新化合物,命名为白酒草皂苷U。1H-NMR (500 MHz,C5D5N) 苷元: δ 3.53 (1H,overlapped,H-18),3.67,4.30 (2H,overlapped,H-23),4.30 (1H,overlapped,H-3),4.77 (1H,overlapped,H-2),5.42 (1H,brs,H-12),5.21 (1H,brs,H-16),0.96,1.73,1.32,1.54 (各3H,s,29,27,24,25-CH3),1.11 (6H,s,30,26-CH3);糖部分信号归属见表 1;13C-NMR (125 MHz,C5D5N) 数据见表 2。
|
|
表 1 化合物1和4糖基的1H-NMR数据 Table 1 1H-NMR spectroscopic data for sugar moieties ofcompounds 1 and 4 |
|
|
表 2 化合物1~4的13C-NMR数据 Table 2 13C-NMR data of compounds 1—4 |
化合物2:白色晶体(甲醇),mp 239~241 ℃,[α]20D-26.4° (c 0.26, MeOH),ESI-MS m/z: 1 377.638 8(计算值1 377.630 3,[M+Na]+),结合13C-NMR和DEPT谱确定其分子式为C63H102O31。
1H-NMR (500 MHz,C5D5N) 和13C-NMR (125 MHz,C5D5N) 显示6个角甲基单峰信号δH0.87,0.98,1.11,1.20,1.28,1.51和δC15.0,17.2,17.5,23.7, 26.1,33.1及双键信号δH 5.43 (brs) 和δC 123.1,144.1,提示化合物2可能为具有齐墩果烷-12-烯基本骨架的三萜皂苷,结合文献报道[11]确定苷元为贝萼皂苷元(bayogenin,2β,3β,23-trihydroxy-olean-12-en-28- oic acid)。δC82.9 (C-3),δC 176.3 (C-28) 提示化合物2在3、28位成苷。在NMR谱中显示了6个糖的端基质子信号δH 5.11 (1H,d,J = 7.2 Hz),5.20 (1H,d,J = 7.6 Hz),5.31 (1H,d,J = 8.0 Hz),5.97 (1H,d,J = 4.8 Hz),5.57 (1H,brs),6.50 (1H,brs) 及端基碳信号δC111.6,105.7,105.2,105.1,101.0,92.9。信号δH1.73 (3H,d,J = 6.0 Hz),δC18.5提示有1个6-去氧糖存在。薄层酸水解结果表明化合物</span>2中含有鼠李糖、木糖、阿拉伯糖、葡萄糖、芹糖5种糖。综合分析1H-NMR谱、13C-NMR谱、DEPT谱、COSY谱、HMBC谱、HMQC谱、NOESY谱和TOCSY谱,对化合物2中所有碳氢信号进行归属,化合物2与白酒草皂苷O[11]的核磁数据非常相似,不同之处在于化合物2较白酒草皂苷O少了1组β-D-呋喃芹糖基的信号,对比后最终确定化合物2中含有的6个糖为2个β-D-吡喃葡萄糖基、1个β-D-吡喃木糖基、1个α-L-吡喃鼠李糖基、1个α-L-吡喃阿拉伯糖基和1个β-D-呋喃芹糖基,并且β-D-吡喃木糖基是1个末端糖。糖链的连接顺序可由HMBC谱进一步证实:Glc′的H-1 (δ 5.20) 和Glc的C-3 (δC 88.6)相关,Glc的H-1 (δH 5.11) 和苷元C-3 (δC 82.9) 相关确定苷元C-3位糖链连接顺序;Api (f ) 的H-1 (δ 5.97) 和Rha的C-3 (δ 82.2) 相关,Xyl的H-1 (δ 5.31) 和Rha的C-4 (δ 78.0) 相关,Rha的H-1 (δ 5.57) 和Ara的C-2 (δ 75.6) 相关,Ara的H-1 (δ 6.50) 和苷元C-28 (δ 176.3) 的远程相关可以确定苷元C-28位糖链的连接顺序。故化合物2的结构鉴定为3-O-β-D-glucopyranosyl-(1→3)-β-D-glucopyranosyl bayogenin 28-O-β-D</i>-xylopyranosyl-(1→4)-[β-D- apiofuranosyl-(1→3)]-α-L-rhamnopyranosyl-(1→2)-α-L-arabinopyranosyl ester,为新化合物,命名为白酒草皂苷T。1H-NMR (500 MHz,C5D5N) 苷元: δ 3.26 (1H,overlapped,H-18),3.67,4.33 (2H,overlapped,H-23),4.26 (1H,overlapped,H-3),4.74 (1H,overlapped,H-2),5.44 (1H,brs,H-12),0.89,1.00,1.13,1.22,1.32,1.54 (各3H,s,29,30,26,27,24,25-CH3),糖部分信号归属见表 3;13C-NMR (125 MHz,C5D5N) 数据见表 2。
|
|
表 3 化合物2和3糖基的1H-NMR数据 Table 3 1H-NMR data for sugar moieties of compounds 2 and 3 |
化合物3:白色晶体(甲醇),1H-NMR (500 MHz,C5D5N) 苷元δ 3.27 (1H,overlapped,H-18),5.42 (1H,brs,H-12),0.87,0.98,1.11,1.20,1.30,1.52 (各3H,s,29,30,26,27,24,25-CH3),糖部分信号归属见表 3;13C-NMR (125 MHz,C5D5N) 数据见表 2。以上数据与文献报道一致[11],故鉴定化合物3为白酒草皂苷O。
化合物4:白色晶体(甲醇),1H-NMR (500 MHz,C5D5N) 苷元: δ 3.31 (1H,dd,J = 13.5,2.6 Hz,H-18),5.44 (1H,brs,H-12),0.89,1.00,1.12,1.22,1.32,1.54 (各3H,s,29,30,26,27,24,25-CH3),糖部分信号归属见表 1;13C-NMR (125 MHz,C5D5N) 数据见表 2。以上数据与文献报道一致[11],故鉴定化合物4为白酒草皂苷M。
化合物5:黄色结晶(甲醇)。1H-NMR (500 MHz,DMSO-d6) δ: 8.05 (2H,d,J = 9.0 Hz,H-2′,6′),6.90 (2H,d,J = 9.0 Hz,H-3′,5′),6.47 (1H,d,J = 2.0 Hz,H-8),6.24 (1H,d,J = 2.0 Hz,H-6),5.45 (1H,d,J = 7.5 Hz,H-1″);13C-NMR (125 MHz,DMSO-d6) δ: 157.1 (C-2),133.9 (C-3),178.1 (C-4),161.6 (C-5),99.3 (C-6),164.6 (C-7),94.4 (C-8),157.0 (C-9),104.7 (C-10),121.6 (C-1′),131.6 (C-2′,6′),115.7 (C-3′,5′),160.4 (C-4′),101.5 (C-1″),74.7 (C-2″),76.8 (C-3″),70.4 (C-4″),78.0 (C-5″),61.4 (C-6″)。以上数据与文献报道一致[17],故鉴定化合物5为山柰酚-3- O-葡萄糖苷。
化合物6:浅黄色粉末(丙酮)。1H-NMR (500 MHz,DMSO-d6) δ: 7.39 (1H,dd,J = 8.0,2.0 Hz,H-6′),7.37 (1H,d,J = 2.0 Hz,H-2′),6.88 (1H,d,J = 8.0 Hz,H-5′),6.64 (1H,s,H-3),6.45 (1H,d,J = 2.0 Hz,H-8),6.18 (1H,d,J = 2.0 Hz,H-6)。以上数据与文献报道一致[18],故鉴定化合物6为木犀草素。
化合物7:黄色粉末(甲醇)。1H-NMR (500 MHz,DMSO-d6) δ: 7.65 (1H,dd,J = 8.5,2.5 Hz,H-6′),7.57 (1H,d,J = 2.0 Hz,H-2′),6.86 (1H,d,J = 9.0 Hz,H-5′),6.41 (1H,d,J = 2.0 Hz,H-8),6.17 (1H,d,J = 2.0 Hz,H-6),5.41 (1H,d,J = 7.5 Hz,H-1″),6.99 (1H,d,J = 2.0 Hz,H-2′′′),6.77 (1H,d,J = 8.0 Hz,H-5′′′),6.80 (1H,dd,J = 8.0,2.0 Hz,H-6′′′),7.30 (1H,d,J = 15.5 Hz,H-7′′′),6.06 (1H,d,J = 16.0 Hz,H-8′′′);13C-NMR (125 MHz,DMSO-d6) δ: 156.7a (C-2),134.1 (C-3),178.0 (C-4),161.5 (C-5),99.4 (C-6),164.8 (C-7),94.2 (C-8),156.9a (C-9),104.4 (C-10),121.7 (C-1′),115.8 (C-2′),145.3 (C-3′),148.9b (C-4′),116.5 (C-5′),122.5 (C-6′),102.2 (C-1″),71.6 (C-2″),73.6 (C-3″),68.8 (C-4″),73.4 (C-5″),63.8 (C-6″),126.1 (C-1′′′),114.1 (C-2′′′),145.8c (C-3′′′),148.8b (C-4′′′),116.3 (C-5′′′),122.1 (C-6′′′),146.0c (C-7′′′),115.1 (C-8′′′),167.0 (C-9′′′)(a、b、c表示化学位移值可互换)。以上数据与文献报道[17, 19]比较,鉴定化合物7为槲皮素-3- O-(6″-咖啡酰基)-β-D-半乳糖苷。
化合物8:黄色粉末(甲醇),与化合物7以1∶2的混合物分离得到。1H-NMR (500 MHz,DMSO- d6) δ: 7.66 (1H,dd,J = 8.5,2.0 Hz,H-6′),7.56 (1H,d,J = 2.0 Hz,H-2′),6.86 (1H,d,J = 8.5 Hz,H-5′),6.40 (1H,d,J = 2.0 Hz,H-8),6.18 (1H,d,J = 2.0 Hz,H-6),5.49 (1H,d,J = 7.5 Hz,H-1″),7.00 (1H,d,J = 2.0 Hz,H-2′′′),6.78 (1H,d,J = 8.0 Hz,H-5′′′),6.81 (1H,dd,J = 8.5,2.0 Hz,H-6′′′),7.28 (1H,d,J = 15.5 Hz,H-7′′′),6.07 (1H,d,J = 16.0 Hz,H-8′′′);13C-NMR (125 MHz,DMSO-d6) δ: 157.0 (C-2),133.8 (C-3),178.0 (C-4),161.5 (C-5),99.3 (C-6),164.6 (C-7),94.2 (C-8),157.0 (C-9),104.5 (C-10),121.7 (C-1′),115.8 (C-2′),145.3 (C-3′),148.9a (C-4′),116.7 (C-5′),122.2 (C-6′),101.4 (C-1″),74.5 (C-2″),76.7 (C-3″),70.4 (C-4″),74.9 (C-5″),63.7 (C-6″),126.1 (C-1′′′),114.2 (C-2′′′),145.9b (C-3′′′),148.8a (C-4′′′),116.3 (C-5′′′),122.0 (C-6′′′),145.7b (C-7′′′),115.2 (C-8′′′),167.0 (C-9′′′)。以上数据与文献报道[17, 19]比较,鉴定化合物8为槲皮素-3-O-(6″-咖啡酰基)-β-D-葡萄糖苷。
化合物9和10:黄色粉末(甲醇),经硅胶TLC和聚酰胺TLC检查为均显示单一斑点。NMR谱分析,并与文献报道[5, 17]对照,鉴定为槲皮素-3-O-半乳糖苷和槲皮素-3-O-葡萄糖苷约2∶1的混合物。槲皮素-3-O-半乳糖苷(9)的NMR数据:1H-NMR (500 MHz,DMSO-d6) δ: 7.66 (1H,dd,J = 8.5,2.0 Hz,H-6′),7.59 (1H,d,J = 2.0 Hz,H-2′),6.86 (1H,d,J = 8.5 Hz,H-5′),6.46 (1H,d,J = 2.0 Hz,H-8),6.24 (1H,d,J = 2.0 Hz,H-6),5.38 (1H,d,J = 8.0 Hz,H-1″);13C-NMR (125 MHz,DMSO-d6) δ: 157.0a (C-2),134.2 (C-3),178.1 (C-4),161.6 (C-5),99.3 (C-6),164.7 (C-7),94.3 (C-8),156.9a (C-9),104.5 (C-10),121.8 (C-1′),115.8 (C-2′),145.3 (C-3′),148.9 (C-4′),116.6 (C-5′),122.6 (C-6′),102.5 (C-1″),71.7 (C-2″),73.7 (C-3″),68.5 (C-4″),76.4 (C-5″),60.7 (C-6″)。槲皮素-3-O-葡萄糖苷(10)的NMR数据:1H-NMR (500 MHz,DMSO-d6) δ: 7.66 (1H,dd,J = 8.5,2.0 Hz,H-6′),7.60 (1H,d,J = 2.0 Hz,H-2′),6.88 (1H,d,J = 8.5 Hz,H-5′),6.45 (1H,d,J = 2.0 Hz,H-8),6.24 (1H,d,J = 2.0 Hz,H-6),5.47 (1H,d,J = 8.0 Hz,H-1″);13C-NMR (125 MHz,DMSO-d6) δ: 157.0a (C-2),134.0 (C-3),178.1 (C-4),161.6 (C-5),99.3 (C-6),164.7 (C-7),94.3 (C-8),156.9a (C-9),104.6 (C-10),121.8 (C-1′),115.8 (C-2′),145.3 (C-3′),148.9 (C-4′),116.8 (C-5′),122.3 (C-6′),101.5 (C-1″),74.6 (C-2″),76.9 (C-3″),70.4 (C-4″),78.0 (C-5″),61.4 (C-6″)。
化合物11:黄色固体(甲醇),与槲皮素对照品[5]在硅胶薄层和聚酰胺薄膜上3种不同条件共薄层色谱,硫酸或三氯化铝显色,Rf值及显色行为完全一致,故鉴定化合物11为槲皮素。
化合物12:白色针状结晶(丙酮),与β-谷甾醇对照品[12]共薄层色谱,用3种不同溶剂系统展开,硫酸和磷钼酸显色,Rf值及显色行为完全一致,故鉴定化合物12为β-谷甾醇。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1998. |
| [2] | 苏艳芳, 刘建生, 果德安, 等. 白酒草属植物化学成分[J]. 国外医药: 植物药分册, 2000, 15(5): 190-197. |
| [3] | 苏艳芳, 罗 洋, 陈 磊, 等. 白酒草属植物化学成分研究进展[J]. 天然产物研究与开发, 2006, 18(5): 878-882. |
| [4] | 颜世伦, 苏艳芳, 解笑瑜, 等. 白酒草中2个新的三萜皂苷[J]. 中草药, 2014, 45(1): 23-27. |
| [5] | 苏艳芳, 刘建生, 果德安, 等. 金龙胆草黄酮类成分的研究[J]. 中草药, 2001, 32(6): 496-497. |
| [6] | 苏艳芳, 果德安, 孙缅恩, 等. 金龙胆草萜类成分的研究[J]. 中草药, 2001, 32(12): 1067-1068. |
| [7] | Su Y F, Guo D A, Guo H Z, et al. Four new triterpenoid saponins from Conyza blinii[J]. J Nat Prod, 2001, 64: 32-36. |
| [8] | Su Y F, Koike K, Guo D A, et al. New apiose-containing triterpenoid saponins from Conyza blinii[J]. Tetrahedron, 2001, 57: 6721-6726. |
| [9] | Su Y F, Guo D A, Gui Y J, et al. A new phenolic glycoside and a new trans-clerodane diterpene from Conyza blinii[J]. J Asian Nat Prod Res, 2001, 3: 229-233. |
| [10] | Su Y F, Koike K, Guo D A, et al. Three new labdane diterpenoid glycosides from Conyza blinii[J]. Heterocycles, 2002, 56: 265-271. |
| [11] | Su Y F, Koike K, Nikaido T, et al. Conyzasaponin I-Q, Nine new triterpenoid saponins from Conyza blinii[J]. J Nat Prod, 2003, 66: 1593-1599. |
| [12] | 苏艳芳, 陈 磊, 罗 洋, 等. 金龙胆草化学成分及其抗溃疡活性研究 (I)[J]. 中草药, 2007, 38(3): 332-334. |
| [13] | Su Y F, Chen L, Wang D W, et al. A new labdane diterpenoid arabinoside from Conyza blinii[J]. Nat Prod Res, 2008, 22(6): 521-524. |
| [14] | Chai X, Su Y F, Guo L P, et al. Phenolic constituents from Conyza sumatrensis[J]. Biochem Syst Ecol, 2008, 36: 216-218. |
| [15] | 解笑瑜, 苏艳芳, 柴 欣, 等. 苏门白酒草的化学成分研究[J]. 中草药, 2009, 40(11): 1715-1719. |
| [16] | Ding Y X, Su Y F, Guo H, et al. Phenylpropanoyl esters from horseweed (Conyza canadensis) and their inhibitory effects on catecholamine secretion[J]. J Nat Prod, 2010, 73: 270-274. |
| [17] | Markham K R, Ternai B, Stanley R, et al. Carbon-13 NMR studies of flavonoids—Ⅲ: Naturally occurring flavonoid glycosides and their acylated derivatives[J]. Tetrahedron, 1978, 34(9): 1389-1397. |
| [18] | 曹 园, 瞿 慧, 姚 毅, 等. 鬼针草化学成分研究[J]. 中草药, 2013, 44(24): 3435-3439.Datta B K, Datta S K, Sarker S D. Quercetin 3-O-(6"-caffeoyl)-β-D-galactopyranoside from Polygonum viscocum[J]. Fitoterapia, 2000, 71(4): 459-460. |
 2014, Vol. 45
2014, Vol. 45


