细菌的耐药性已成为医学的一个棘手的问题,耐药性的重要原因之一是因为由胞外聚合物组成的生物被膜为膜内病原体提供保护,从而避免宿主免疫系统和抗生素的作用[1]。铜绿假单胞菌(Pseudomonas aeruginosa,PA)和白色念珠菌(Candida albicans,CA)是临床最常见的条件致病菌,在医院感染中占有非常重要的地位,金黄色葡萄球菌(Staphylococcus aureus,SA)是常见的化脓性病原菌,这3种菌极易形成生物被膜并对传统抗生素都具有耐药性,使感染难以控制[2, 3, 4]。因此,寻找毒性较低、抗菌、抗生物被膜作用强的传统抗生素替代品引起了人们的兴趣。中药及其有效成分已经被证明是具有前途的抗菌药物[5, 6]。此外,据报道,一些“非抗生素”类物质对细菌和真菌也有广谱的抑制作用,如EDTA[7-8]和乙醇[9]。但是这些药物往往抗菌作用较弱。中药的有效成分和“非抗生素”类有抗菌作用物质联合是否能增强抗菌、抗生物被膜作用是值得探讨的问题。本实验探索已经被证明在体外有抗生物被膜作用的鱼腥草素钠(sodium houttuyfonate,SH)[10, 11, 12, 13, 14]及有抗菌效果的乙二胺四乙酸二钠(EDTA-Na2)联合用药对PA、CA、SA 3种病原菌和生物被膜的作用。 1 材料 1.1 菌株
PA(ATCC27853)、SA(ATCC25923)和CA(SC5314),均购于中国食品药品检定研究院。 1.2 药品、试剂和仪器
SH(质量分数94.5%,批号100247-199601,中国食品药品检定研究院);LB(Luria-Bertani)培养基(北京奥博星生物技术有限责任公司);RPMI 1640(Gibco);EDTA-Na2(国药集团化学试剂有限公司);DPH—9162型恒温培养箱(上海一恒科技有限公司);NRY—200型台式恒温摇床(上海南荣实验室设备有限公司);SpectraMax M2e多功能酶标仪[美谷分子仪器(上海)有限公司];Sirion200扫描电镜(SEM,FEI公司)。 2 方法 2.1 最小抑菌浓度(MIC)的测定
采用微量稀释法测定SH、EDTA-Na2对PA、SA和CA的MIC。PA和SA终浓度为1×106 CFU/mL,CA浓度为1×103 CFU/mL。SH与EDTA-Na2设定的梯度分别为2 048、1 024、512、256、128、64、32、16、8、4、2 μg/mL和120、60、30、15、7.5、3.75、1.875、0.938、0.469、0.235、0.117 mg/mL。在96孔板中每个梯度设8个复孔,每孔分别加入100 μL含2种药物的培养液和100 μL菌液。混合后PA、SA和CA分别置于37 ℃下静置培养24、48 h,测定600 nm吸光度(A600)值,与空白对照组(不含药物)比较,抑制率80%以上的最低药物浓度为MIC。实验重复3次。 2.2 最小膜清除浓度(MBEC)的测定
采用微量稀释法测定SH、EDTA-Na2对PA、SA和CA的MBEC。3种菌的终浓度均为1×106 CFU/mL。药物梯度设置同“2.1”项。在96孔中每个梯度设8个复孔,每孔分别加入200 μL菌液后,37 ℃恒温过夜培养24 h,去除培养基,用无菌PBS洗涤2~3次去除浮游菌。再在每孔分别加入100 μL含2种药物的培养液和100 μL的无药培养基,混合后37 ℃恒温过夜培养24 h,测定A600,与空白对照组(不含药物)比较,抑制率80%以上的最低药物浓度为MBEC。实验重复3次。 2.3 SH与EDTA-Na2协同点的测定
采用棋盘法分别向96孔板分别加入SH和EDTA-Na2,每种抗菌药物从2倍MIC浓度开始用无菌培养基倍比稀释(SH稀释7个浓度,EDTA-Na2稀释11个浓度),各取50 μL分别排列在平板的行与列上,然后在96孔板中加入100 μL菌液,37 ℃恒温培养24 h,测定A600,与空白对照组(不含药物)比较,抑制率80%以上的最低药物浓度为联合MIC。通过计算部分抑制浓度指数(fractional inhibitory concentration index,FICI)[15]判断相互作用:FICI<0.5为协同作用,0.5≤FICI≤4.0为联合作用,FICI>4.0为拮抗作用。
FICI=联合MICSH/单独MICSH+联合MICEDTA-Na2/单独MICEDTA-Na2
2.4 协同点时细菌的生存曲线选取合适的协同点,采用平板稀释涂布法测定PA、SA和CA在SH、EDTA-Na2单独干预、SH与EDTA-Na2共同干预1、3、6、12、24 h后的细菌数量。以不加药物的空白组作为对照。绘制细菌生存曲线。 2.5 扫描电子显微镜观察细菌形态
PA、SA和CA分别接种于LB和RPMI 1640培养基中,在37 ℃下,220 r/min恒温摇床培养24 h,2 000 r/min 离心10 min,倾去上清液,用LB和RPMI 1640培养基分别稀释,PA和SA终浓度为7.5×105 CFU/mL,CA浓度为1×106 CFU/mL。将3种菌液各1 mL分别接种于置入无菌玻片的24孔板中,分别加入含有SH、EDTA-Na2和含有两药的培养基,至药物终浓度为协同点的药物浓度,37 ℃条件下,培育24 h,镀银染色后,扫描电镜观察细菌形态。 3 结果 3.1 SH和EDTA-Na2的MIC和MBEC
采用微量稀释法测定SH和EDTA-Na2两种药物分别对PA、SA和CA的MIC和MBEC,结果见表 1。
| 表 1 SH和EDTA-Na2对PA、SA和CA的MIC和MBEC值 Table 1 MIC and MBEC of SH and EDTA-Na2for PA, SA, and CA |
由SH与EDTA-Na2两种药物干预PA、SA和CA的浮游菌和生物被膜24 h后的A600值得出SH与EDTA-Na2联合应用的MIC,进而得到FICI,以SH与EDTA-Na2对PA、SA和CA浮游菌和生物被膜具有协同作用的MIC或MBEC为协同点,具体协同点对应的药物(SH/EDTA-Na2)质量浓度(mg/mL)分别为0.256/0.938和0.512/3.722、0.008/0.233和0.032/0.469、0.008/0.029和0.064/0.938。具体结果见表 2。
| 表 2 SH与EDTA-Na2联合抗PA、SA和CA的协同点 Table 2 Synergistic point of SH in combination with EDTA-Na2 against PA, SA, and CA |
分别以协同点对应的药物(SH/EDTA-Na2)质量浓度干预PA、SA和CA的浮游菌和生物被膜菌不同时间,得到3种菌在药物协同点质量浓度时的生存曲线。见图 1。
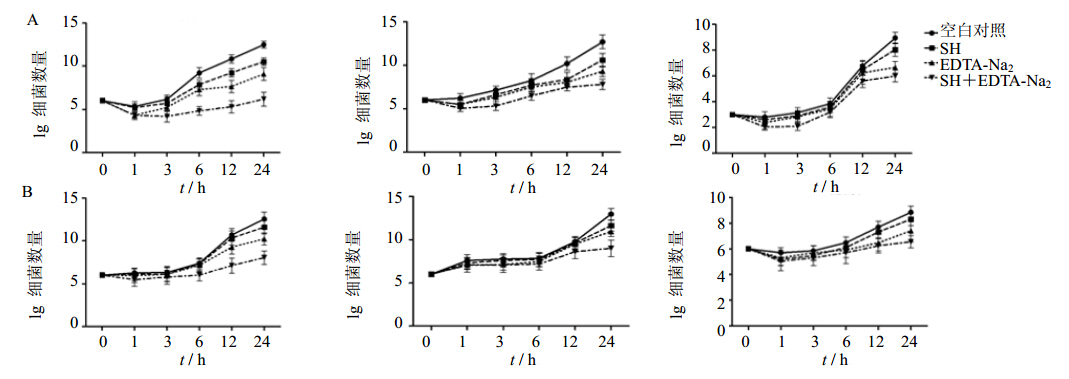 |
A-浮游菌 B-生物被膜菌 A-planktonic B-biofilm图 1 PA、SA和CA在SH和EDTA-Na2协同点质量浓度下的生存曲线 Fig. 1 T-K curves of PA, SA, and CA in synergistic points |
扫描电子显微镜观察PA、SA和CA浮游菌和生物被膜在协同点药物质量浓度作用24 h后的形态,镜下观察到浮游菌的空白对照组载体上由密集的胞外基质形成黏液层,大部分细菌已被包裹在有胞外基质形成的黏液层下,少量细菌镶嵌在黏液层之间,形成了早期的生物被膜;SH和EDTA-Na2抑制了浮游菌的生物被膜形成,镜下均未观察到明显的生物被膜结构;两药联合作用的载体上仅存在散在的黏液且细菌数量少,形态清晰,没有生物被膜形成(图 2)。图 2显示生物被膜的空白对照组载体上的生物被膜层明显增厚如蘑菇状形态,其内部有相互交织的孔道,细菌被胞外基质完全覆盖;而SH和EDTA-Na2组的生物被膜结构被局部破坏;SH与EDTA-Na2联合作用的载体上的生物被膜结构被破坏,仅存在散在的黏液或较少的交织物,出现散落的细菌。同一质量浓度下,联合用药组对细菌生长的抑制作用和对生物被膜的清除作用较单药组显著。
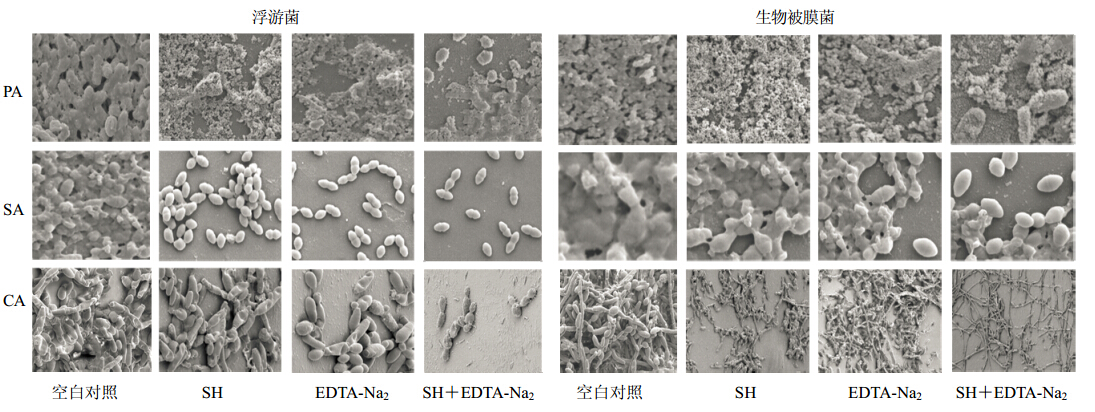 | 图 2 扫描电镜下PA、SA和CA菌的形态 Fig. 2 Morphological observation of PA, SA, and CA by SEM |
鱼腥草是我国传统中药,具有清热解毒、抗菌、抗病毒、利尿消肿等作用,并是治疗痰热壅肺、发为肺痈、咳吐脓血的要药,是国家卫生部正式确定为药食两用的品种之一。SH是鱼腥草(三白草科)中由挥发油组成的鱼腥草素和亚硫酸氢钠共同合成的化合物[16]。在国内SH作为抗菌药用于临床多年,取得了很好的疗效。然而,研究SH或者联合其他药物抗菌或生物被膜方面仍然很少。最近有文献报道[10, 17],SH及其衍生物在体外单独或与其他抗生素联用能够有效抑制PA和SA的生长繁殖。EDTA-Na2是常用的螯合试剂,作为联合药物或抑制细菌、真菌等病原体蛋白的合成的试剂已经被广泛应用,这可能与其抑制菌丝的生成从而破坏生物被膜的形成有关[18]。本实验用SH联合EDTA-Na2抗生物被膜菌PA、SA和CA,证明了SH与EDTA-Na2联用不仅对PA具有协同作用,而且对SA和CA也有协同作用,尤其对他们的生物被膜。由于细胞数量增加,SH和EDTA-Na2对CA生物被膜(约为106 CFU/mL)的MBEC值显著高于浮游细胞(约为103 CFU/mL),因此,相比于对SA和PA生物被膜的抑制作用,EDTA-Na2更难以完全消除CA的生物被膜。SH与EDTA-Na2联用时能够大大降低药物的用量,并能杀死浮游菌和清除生物被膜。
一般传统抗生素在抗菌方面往往优于中药或其有效成分,但目前常规应用的抗生素只能杀灭浮游菌,对膜内菌的清除没有很好的疗效,致使膜内菌长期存活,释放时又会引起新的感染,从而使感染反复发作,长期应用会导致耐药菌株的增多。鱼腥草是药食两用的天然植物,具有长期服用对人体无毒副作用[19],不形成耐药两大优势。总之,本研究结果显示:(1)SH对PA、SA和CA都有抑制作用,尤其对SA和CA更加有效;(2)SH与EDTA-Na2联合对PA、SA和CA都具有协同作用,并对这3种菌的生长和生物被膜有强有力的抑制和清除作用,表明SH可能是潜在的抗生素替代品,特别是结合EDTA-Na2,使其在抗感染治疗中有良好的应用前景。
| [1] | Clatworthy A E, Pierson E, Hung D T. Targeting virulence: a new paradigm for antimicrobial therapy [J]. Nat Chem Biol, 2007, 3(9): 541-548. |
| [2] | Mulet X, Macia M D, Mena A, et al. Azithromycin in Pseudomonas aeruginosa biofilms: bactericidal activity and selection of nfxB mutants [J]. Antimicrob Agents Chemother, 2009, 53(4): 1552-1560. |
| [3] | Singh R, Ray P, Das A, et al. Penetration of antibiotics through Staphylococcus aureus and Staphylococcus epidermidis biofilms [J]. J Antimicrob Chemother, 2010, 65(9): 1955-1958. |
| [4] | Uppuluri P, Srinivasan A, Ramasubramanian A A, et al. Effects of fluconazole, amphotericin B, and caspofungin on Candida albicans biofilms under conditions of flow and on biofilm dispersion [J]. Antimicrob Agents Chemother, 2011, 55(7): 3591-3593. |
| [5] | Zeng X P, Liu X Y, Bian J, et al. Synergistic effect of 14-alpha-lipoyl andrographolide and various antibiotics on the formation of biofilms and production of exopolysaccharide and pyocyanin by Pseudomonas aeruginosa [J]. Antimicrob Agents Chemother, 2011, 55(6): 3015-3017. |
| [6] | Zhang H, Wang K, Zhang G, et al. Synergistic anti-candidal activity of tetrandrine on ketoconazole: an experimental study [J]. Planta Med, 2010, 76(1): 53-61. |
| [7] | Al-Bakri A G, Othman G, Bustanji Y. The assessment of the antibacterial and antifungal activities of aspirin, EDTA and aspirin-EDTA combination and their effectiveness as antibiofilm agents [J]. J Appl Microbiol, 2009, 107(1): 280-286. |
| [8] | El-Sharif A A, Hussain M H. Chitosan-EDTA new combination is a promising candidate for treatment of bacterial and fungal infections [J]. Curr Microbiol, 2011, 62(3): 739-745. |
| [9] | Peters B M, Ward R M, Rane H S, et al. Efficacy of ethanol against Candida albicans and Staphylococcus aureus polymicrobial biofilms [J]. Antimicrob Agents Chemother, 2013, 57(1): 74-82. |
| [10] | Shao J, Cheng H J, Wang C Z, et al. A phytoanticipin derivative, sodium houttuyfonate, induces in vitro synergistic effects with levofloxacin against biofilm formation by Pseudomonas aeruginosa [J]. Molecules, 2012, 17(9): 11242-11254. |
| [11] | 朱玲玲, 孙振新, 程惠娟, 等. 鱼腥草素钠对头孢他啶抗铜绿假单胞菌生物被膜的增强作用及抗菌协同作用 [J]. 时珍国医国药, 2013, 24(10): 2353-2355. |
| [12] | 程惠娟, 张昌峰, 汪长中, 等. 鱼腥草素钠对铜绿假单胞菌生物被膜藻酸盐合成的影响 [J]. 中成药, 2013, 35(3): 455-460. |
| [13] | 程惠娟, 汪长中, 卢文波, 等. 鱼腥草素钠对铜绿假单胞菌黏附的清除作用及对生物被膜形成的影响 [J]. 中国中药杂志, 2012, 37(21): 3297-3301. |
| [14] | 程惠娟, 汪长中, 胡跃龙, 等. 鱼腥草素钠对铜绿假单胞菌生物被膜的清除作用 [J]. 中成药, 2012, 34(12): 2274-2277. |
| [15] | Odds F. Synergy, antagonism, and what the chequerboard puts between them [J]. J Antimicrob Chemother, 2003, 52(1): 1. |
| [16] | 张美玉, 李连达. 鱼腥草及其制剂研究进展 [J]. 中药药理与临床, 2010, 26(2): 79-85. |
| [17] | Lu X, Yang X, Li X, et al. In vitro activity of sodium new houttuyfonate alone and in combination with oxacillin or netilmicin against methicillin-resistant Staphylococcus aureus [J]. PLoS One, 2013, 8(7): e68053. |
| [18] | Ramage G, Wickes B L, Lopez-Ribot J L. Inhibition on Candida albicans biofilm formation using divalent cation chelators (EDTA) [J]. Mycopathologia, 2007, 164(6): 301-306. |
| [19] | Wang D Y, Yu Q H, Eikstadt P, et al. Studies on adjuvanticity of sodium houttuyfonate and its mechanism [J]. Int Immunopharmacol, 2002, 2(10): 1411-1418. |
 2014, Vol. 45
2014, Vol. 45


