2. 安徽省中医药科学院 中西医结合研究所, 安徽 合肥 230038
2. Institute of Integrated Traditional and Western Medicine, Anhui Academy of Chinese Medicine, Hefei 230038, China
白色念珠菌是一种重要的条件致病性真菌,其毒力因子除了黏附素、菌丝形成及表型转换之外,还包括磷脂酶(phospholipase,PL)、天冬氨酸蛋白酶(aspartic protease,Sap)、脂肪酶(lipase,Lip)、细胞表面疏水性(cell surface hydrophobicity,CSH)等[1]。白色念珠菌通过黏附素识别宿主细胞,继而分泌侵袭性酶促进其在细胞中扩散,同时通过形态发生及酵母-菌丝相转换使其利于侵入宿主,适应宿主环境,造成白色念珠菌感染。因此,有效抑制毒力因子的活性成为治疗白色念珠菌感染的有效手段。本课题组前期研究发现黄连解毒汤醋酸乙酯提取物(ethyl acetate extract of Huanglian Jiedu Decoction,EAHJD)可一定程度抑制白色念珠菌的早期黏附及菌丝形成[2],在此基础上,本研究拟进一步探讨EAHJD对白色念珠菌分泌酶等毒力因子的作用,为黄连解毒汤临床用于抗真菌感染提供重要的实验依据。 1 材料
1.1 菌株
白色念珠菌Candida albicans 17株临床株由第二军医大学药学院姜远英教授惠赠。 1.2 药物
阳性对照药氟康唑(fluconazole,FLZ)对照品(中国食品药品检定研究院);黄连解毒汤按国家中医药管理局统一组织编审的普通高等类教育中医类规划教材《方剂学》中的药物组成,具体包括黄连、黄芩、黄柏和栀子,药材均购于安徽中医药大学第一附属医院中药房,并经高家荣主任药师鉴定。使用80%甲醇70 ℃回流2 h后滤过,收集滤渣,共重复回流3次后,滤液用醋酸乙酯萃取3次,萃取液65 ℃旋转蒸发至结晶干燥,得到EAHJD。 1.3 试剂
pH 7.4磷酸盐缓冲液(PBS),氨基黑10B(Aladdin公司),冰乙酸(上海化学试剂有限公司),正辛烷(国药集团化学试剂有限公司),无水乙醇(上海苏懿化学试剂有限公司),溶壁酶(Sigma公司),Total RNA提取试剂、PCR反应试剂(日本ToyoBo公司),引物(上海生工生物工程有限公司)。 1.4 培养基
RPMI 1640液体培养基(Gibco公司),用1 mol/L NaOH溶液调整该液体培养基在25 ℃的pH为7.0±0.1,滤过灭菌,4 ℃保存备用。沙氏液体培养基、沙氏琼脂培养基(青岛高科技海博生物技术有限公司)。
蛋黄培养基(100 mL):葡萄糖2.0 g、蛋白胨1.0 g、营养琼脂2.0 g、5 mol/L NaCl 20 mL、25 mmol/L CaCl2 20 mL,补蒸馏水至100 mL,115 ℃灭菌30 min,冷却至50 ℃左右,取新鲜鸡蛋1个,酒精浸泡30 min后严格无菌操作取出蛋黄液,每100 毫升上述培养基加入无菌蛋黄4 mL,充分混匀。
YGM-牛奶培养基(100 mL):葡萄糖2.0 g、酵母粉0.2 g、KH2PO4 1.0 g、营养琼脂2.0 g,115 ℃灭菌30 min,冷却至50 ℃左右,加入1.0%灭菌脱脂奶粉,充分混匀。
平板筛选培养基(100 mL):橄榄油2.0 mL、蛋白胨1.0 g、牛肉膏0.5 g、葡萄糖0.3 g、聚乙烯醇(PVA)1.0 g、氯化钠0.5 g、聚山梨酯80 0.5 mL、琼脂1.5 g、溴百里香酚蓝0.01 g。
发酵产酶培养基(1 L):葡萄糖100 g、蛋白胨1.8 g、酵母膏0.5 g、KH2PO4 2.0 g、橄榄油8.5 mL、聚山梨酯804.6 mL。
橄榄油乳化液:取2.0 g PVA加热溶解,冷却定容至100 mL,橄榄油与PVA溶液按1∶3混合。 1.5 仪器
16EWRi游标卡尺(Mahr公司),DPH—9162型电热恒温培养箱(上海一恒科技有限公司),血细胞计数板(上海求精生化试剂仪器有限公司),AB SpectraMax M2e多功能酶标仪[美谷分子仪器(上海)有限公司],KQ5200B超声波(昆山市超声仪器有限公司),I7000荧光定量PCR仪(美国生物应用系统公司)。 2 方法 2.1 菌悬液配制
从4 ℃保存的沙氏培养平板上挑取单菌落白色念珠菌,接种至液体沙氏培养液,37 ℃、200 r/min过夜培养,离心收集菌体,血细胞计数板计数,以RPMI 1640培养液稀释至2×107 CFU/mL。 2.2 分泌型酶阳性菌株的筛选及其酶活力测定 2.2.1 分泌型酶阳性菌株的筛选
①PL阳性菌株筛选[3]:取10 μL菌悬液滴加于蛋黄培养基表面,使其呈圆形,37 ℃培养48 h,菌落周围出现沉淀圈即为PL阳性菌株。②Sap阳性菌株筛选[4]:取10 μL菌悬液滴加于YGM-牛奶培养基表面,使其呈圆形,37 ℃培养72 h后,再将适量氨基黑染色液缓慢倾入培养基表面,室温染色24 h,洗脱液脱色15 min,吸去洗脱液,重新加入洗脱液,如此反复脱色,直至不含蛋白质部分的琼脂褪色为止,底部出现透明圈即为Sap阳性菌株。③Lip阳性菌株筛选[5]:取10 μL菌悬液滴加于平板筛选培养基表面,使其呈圆形,37 ℃培养48 h后,菌落周围出现黄色环即为Lip阳性菌株。 2.2.2 EAHJD对酶活力的影响
取充分混匀的蛋黄、YGM-牛奶、发酵产酶培养基,分别加入终质量浓度为1 250、312、78 μg/mL EAHJD及256 μg/mL FLZ作为给药组,另设正常培养基为阴性对照组。各组按“2.2.1”项方法接种菌种,分别培养不同时间后进行PL、Sap和Lip酶活力的测定。具体如下:①PL活力测定,操作步骤同“2.2.1”项,测定菌落及沉淀圈直径。②Sap活力测定,操作步骤同“2.2.1”项,测定菌落及透明圈直径,结果测定以Pz值表示酶的活力,Pz值=菌落直径/总直径(菌落+菌落周围圈),Pz值愈小,酶活力愈强。③Lip活力测定,取菌悬液按10%接种于发酵产酶培养基中,30 ℃,160 r/min摇床培养16 h,10 000 r/min离心10 min收集菌体,10 mL,pH 6.8无菌PBS冲洗2次,称取0.5 g离心压积细胞与25 mL无菌PBS混合于冰水中超声破碎(输出功率500 W,每次辐射时间6 s,间歇时间5 s,总时间5 min),10 000 r/min离心10 min收集上清液得到粗酶液。取6个100 mL三角烧瓶,依次标为阴性对照组(只加95%乙醇15 mL,38 ℃水浴5 min);1 250 μg/mL EAHJD组;312 μg/mL EAHJD组;78 μg/mL EAHJD组;256 μg/mL FLZ组;空白对照组。各瓶均加入4 mL橄榄油乳化 液与5 mL pH 6.8的0.067 mol/L PBS混匀,所有组均加入1 mL酶液,立即混匀反应10 min,除阴性对照瓶外,其他均加入15 mL 95%乙醇终止反应。各瓶均加入2滴酚酞,用0.01 mol/L NaOH滴定。计算酶活力(U/g)。
酶活力=NaOH消耗量×0.05×40×1 000 / 10
2.3 CSH的测定[6]取菌悬液于6孔培养板中,加入终质量浓度为1 250、312、78 μg/mL EAHJD及256 μg/mL FLT,37 ℃培养48 h后,弃去培养基,无菌PBS分别刮取细胞,离心,弃上清,加入沙氏培养基制备成菌悬液[600 nm处吸光度值(A600)=1],每组取1.2 mL置于洁净玻璃管内,加入0.3 mL正辛烷,涡旋混匀3 min,静置15 min两相分离,分离后立即测定水相A600,以不加正辛烷测得的A600作为对照。计算CSH。
CSH=(A600对照-A600实验) / A600对照
2.4 PL、Sap、Lip相关基因的检测将标准菌悬液稀释成2×106 CFU/mL,每孔1 mL加入24孔板,然后分别加入终质量浓度为1 250、312、78 μg/mL EAHJD及256 μg/mL FLZ各1 mL混匀,37 ℃培养24 h后,吸取培养液;3 000 r/min离心5 min,弃上清后用无菌PBS洗3次。加入溶壁酶水浴20 min后进行RNA提取,并调节RNA浓度,使菌体模板量一致。具体操作方法参照ToyoBo公司MagExtractor-RNA提取试剂说明书进行。 2.4.1 引物的设计与合成
根据NCBI基因库查得所需基因序列,并用Premier 5.0软件设计所需引物,委托上海生工生物有限公司合成引物,各引物情况见表 1。
| 表 1 PCR反应引物序列 Table 1 Primer sequences of PCR reaction |
6 μL RNA变性后加入试剂 [4×DNA Master(55 μL)和gDNA Remover(1.1 μL)] 2 μL,37 ℃水浴5 min后加入5RT-Master MixII 2 μL混合后50 ℃、5 min;98 ℃、5 min;4 ℃、1 min反转录。反应完成后将cDNA稀释10倍备用。 2.4.3 实时荧光定量PCR反应
配制25 μL总反应体系:2×SYBR Green Realtime PCR 12.5 μL,PCR 正、反向引物(10 μmol/L)各1 μL,cDNA 0.5 μL,ddH2O 10 μL。反应条件:95 ℃预变性60 s;扩增定量程序40个循环,循环参数:变性95 ℃、15 s;退火55 ℃、15 s;延伸72 ℃、45 s;熔解曲线:60~95 ℃,加热速率为0.1 ℃/s。内参基因为actin。每个样品均设置3个重复,重复实验2次。 2.4.4 定量分析
实时荧光定量PCR分别测定目的基因及内参的Ct值,结果取其平均值。基因表达水平用倍数变化(2−ΔΔCt)来表示。 2.5 统计学处理
所有数据应用SPSS 17统计软件分析处理,计量资料以x±s表示,组间差异比较采用单因素方差分析。 3 结果 3.1 分泌型酶阳性菌株筛选结果 3.1.1 PL阳性菌株
17株白色念珠菌中,PL阳性菌株共15株,占88.2%。其中PL活性较高菌株5株,蛋黄培养基上形成较宽的沉淀圈;PL活性较低菌株10株,形成较窄沉淀圈;PL阴性无沉淀圈。见图 1。
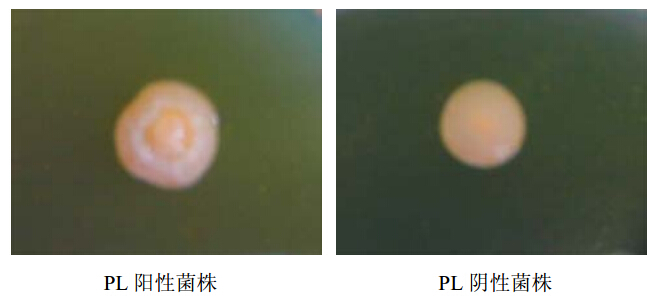 | 图 1 PL阳性菌株筛选结果 Fig. 1 Screening of PL positive C. albicans strain |
17株白色念珠菌中,Sap阳性菌株共13株,占76.5%。其中Sap活性较高菌株7株,透明圈较宽;Sap活性较低菌株6株,透明圈较窄;Sap阴性的无透明圈。见图 2。
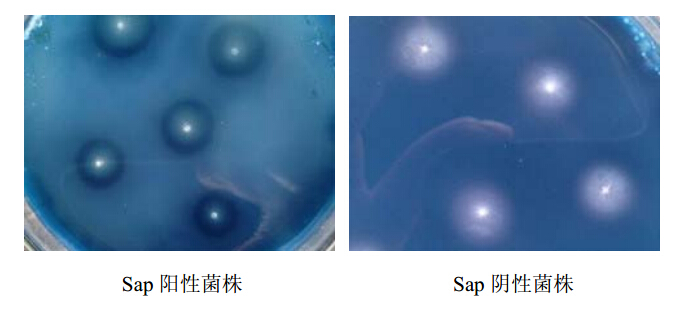 | 图 2 Sap阳性菌株筛选结果 Fig. 2 Screening of Sap positive C. albicans strain |
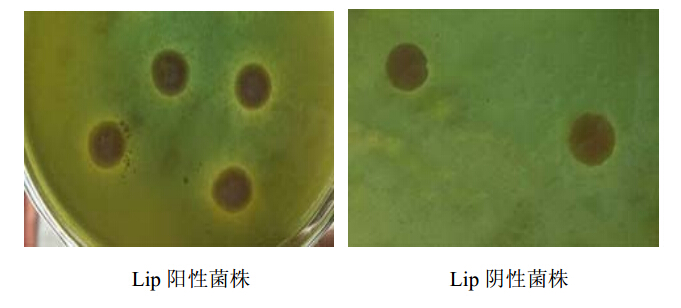 | 图 3 Lip阳性菌株筛选结果 Fig. 3 Screening of Lip positive C. albicans strain |
17株白色念珠菌中3种分泌型酶均呈阳性3株,占17.6%。 3.2 EAHJD对分泌型酶活力的影响 3.2.1 EAHJD对PL分泌的影响
结果发现,用药组均未能抑制PL的分泌,菌落周围仍呈现沉淀圈。 3.2.2 EAHJD对Sap分泌的影响
1 250 μg/mL EAHJD 作用组,透明圈几乎消失;312 μg/mL EAHJD作用组透明圈稍大;78 μg/mL EAHJD作用组同空白对照组比较透明圈接近。见表 2。
| 表 2 EAHJD对白色念珠菌Sap活力的影响(x±s, n=6) Table 2 Effectof EAHJD on Sap activity of C. albicans (x±s, n=6) |
对照组Lip活力较强,达104 U/g,EAHJD从78 μg/mL增加至1 250 μg/mL时,酶活力依次降至99、68、23 U/g,256 μg/mL FLZ作用后酶活力为55 U/g。见图 4。
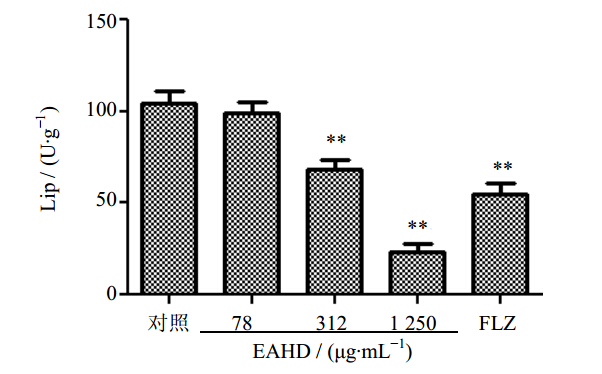 | 图 4 EAHJD对白色念珠菌Lip活力的影响 Fig. 4 Effect of EAHJD on Lip activityin C. albicans |
对照组的细胞CSH较高,经EAHJD处理后其CSH明显降低,EAHJD为78 μg/mL时CHS为0.92,随着药物质量浓度迅速升高其CHS迅速降低,EAHJD为312 μg/mL时CHS为0.43,略低于256 μg/mL FLZ作用后的CSH(0.49),1 250 μg/mL EAHJD作用后降至0.15。见图 5。
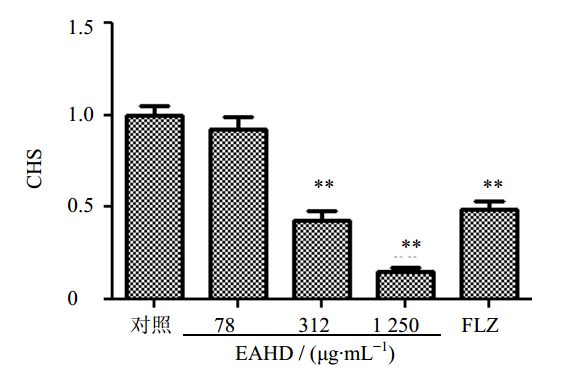 | 图 5 EAHJD对白色念珠菌CHS的影响 Fig. 5 Effect of EAHJD on CSH of C. albicans |
检测所有基因发现,随着EAHJD质量浓度的降低,CSH1分别下调了7.69、3.57、2.95倍;分泌型酶相关基因的表达呈现不同倍数变化,PLC1、Sap1、Sap2、Sap3、Sap9、Lip3、Lip4、Lip6表达均下调,其中1 250 μg/mL EAHJD使Sap2、Lip3分别下调8.29、9.24倍,效果显著;PLB1、PLC2、Sap10、Lip5表达无变化。见表 3。
| 表 3 EAHJD对白色念珠菌毒力因子合成相关基因表达的影响 Table 3 Effect of EAHJD on expression of virulence factors synthesis related gene of C. albicans |
白色念珠菌是一种重要的条件致病菌,在菌群
失调或机体免疫功能下降时可引发机会性感染。随着分子免疫学、分子生物学的发展,对于该菌感染人类宿主的研究取得了很大进展,对白色念珠菌的毒力因子有了进一步的认识。
本实验从白色念珠菌几种常见的主要毒力因子方面探讨EAHJD抗白色念珠菌作用。PL作为一种重要的毒力因子,其中磷脂酶B、C、D(PLB、PLC、PLD研究较多。Barrett-Bee 等[7]证实PL活力高的白色念珠菌对颊膜上皮黏附力及小鼠的致病性均上升。PLB是一种分泌型糖蛋白,糖基化磷脂酰肌醇(GPI)结合位点与PLB1结合后,将PLB1与细胞膜或细胞壁上的几丁质结合,使其固定于细胞壁上。PLC在膜受体的传递中扮演重要角色,其中PLC1可能涉及白色念珠菌细胞生长过程,PLC1突变株未能形成菌丝;而PLC2与PLC3经证实并非白色念珠菌毒力所必需的[8]。本实验17株临床株中PLB阳性15株,其中活性较高有5株。EAHJD干预下,仅从沉淀圈观察,PLB的分泌并未发现明显变化。RT-PCR检测基因发现EAHJD作用后,PLB1与PLC2表达未见明显变化,1 250、312 μg/mL EAHJD分别使PLC1表达下降4.3、3.1倍。结合表型及基因变化推测,EAHJD引起PLC1下调但未能造成表型变化推测可能还作用于其他PLB相关基因,共同调节基因变化,造成PLB分泌无明显差异。Sap作为白色念珠菌另一个重要的毒力因子,不仅有较高的蛋白水解活性,而且对感染鼠有较高的致死性。研究证明Sap1~3无效突变体丧失了大部分毒性;Sap9和Sap10通常存在于共生和感染过程中[9]。17株临床株筛选出13株Sap阳性菌株,其中活性较高有7株。EAHJD干预后,Sap分泌显著降低。与对照组相比,78、312、1 250 μg/mL EAHJD作用后Sap活力Pz值依次上升了19.2%、55.3%、77.4%。RT-PCR检测基因发现EAHJD作用后,Sap2、Sap3、Sap9均下调;Sap1、Sap10无明显变化,推测EAHJD对Sap基因的下调效应起主导作用,从而抑制了Sap的分泌。Lip也是白色念珠菌的重要毒力因子之一,1965年首次提出白色念珠菌细胞外Lip活性。Hube等[10]实验发现Lip3~6在多种培养及各生长阶段均表达。17株临床株筛选出10株Lip阳性菌株,其中活性较高有6株。EAHJD干预后,与对照组相比,78、312、1 250 μg/mL EAHJD作用组分别使Lip活性下降0.05%、34.6%、77.9%。RT-PCR检测基因发现EAHJD作用后,Lip3、Lip4、Lip6均下调,Lip5无显著变化。这与Lan等[11]的研究一致,即Lip5属于冷活性酶,最适环境为15~25 ℃,而本实验作用温度为37 ℃,推测该基因表达受到抑制,导致EAHJD难于无法作用该靶点。而其他3个基因表达下调引起& lt;/ span>Lip分泌大大降低。
CSH有助于菌体黏附于上皮细胞、内皮细胞和胞外基质蛋白,以及抵抗吞噬细胞的杀伤,因而是白色念珠菌的一种重要毒力因子[12]。同时,CSH也参与了生物膜的形成,后者不仅参与了白色念珠菌的耐药性,同时也是重要的致病因素。本实验检测了经不同质量浓度EAHJD处理的白色念珠菌CSH值,结果表明,EAHJD浓度越大,CSH值越小,CSH1基因表达也相应越低,推测CSH1表达下降而导致CSH降低可能是EAHJD降低毒力的分子机制之一。
综上所述,EAHJD的抗白色念珠菌作用可能与其抑制PL、Sap、Lip和CSH等密切相关。
| [1] | 马 虎, 崔 凡, 林昭春. 白念珠菌致病相关的水解酶 [J]. 中国真菌学杂志, 2012, 7(4): 247-251. |
| [2] | 汪天明, 严园园, 施高翔, 等. 黄连解毒汤乙酸乙酯提取物对白假丝酵母菌黏附作用的影响 [J]. 中国微生态学杂志, 2014, 26(4): 391-395. |
| [3] | Kadir T, Gümrü B, Uygun-Can B. Phospholipase activity of Candida albicans isolates form atients with denture stomatitis: The influence of chlorhexidine gluconate on hospholipase roduction [J]. Arch Oral Biol, 2007, 52(7): 691-696. |
| [4] | 黄长武, 李兴禄, 邱君风, 等. 白色念珠菌在呼吸道中致病性的研究 [J]. 中华医院感染学杂志, 2004, 14(7): 721-723. |
| [5] | 黎小军, 谢莲萍, 刘建宏, 等. 产Lip菌株的筛选、鉴定与产酶条件优化 [J]. 江西师范大学学报: 自然科学版, 2014, 38(1): 14-18. |
| [6] | CaoY Y, Gao Y B, Xu Z, et al. cDNA microarray analysis of differential gene expression in Candida albicans biofilm exposed to famesol [J]. Antimicbiol Agents Chemother, 2005, 49(2): 584-589. |
| [7] | Barrett-Bee K, Haves Y, Wilson R G, et al. A comparison of hospholipase activity, cellular adherence and athogenicity of yeasts [J]. J Gen Microbiol, 1985, 131(5): 1217-1221. |
| [8] | Knechtle P, Goyard S, Brachat S, et al. Phosphatidylinositol-dependent hospholipases C lc2 and lc3 of Candida albicans are dispensable for morphogenesis and host-pathogen interaction [J]. Res Microbiol, 2005, 156(7): 822-829. |
| [9] | Albrecht A, Felk A, Pichova I, et al. Glycosylphosphttidylinositol-anchored roteases of Candida albicans target roteins necessary for both cellular rocesses and host-pathogen interactions [J]. J Biol Chem, 2006, 281(2): 688-694. |
| [10] | Hube B, Stehr F, Bossenz M, et al. Secreted lipases of Candida albicans: cloning, characterization and expression analysis of a new gene family with at least ten members [J]. Arch Microbiol, 2000, 174(5): 362-374. |
| [11] | Lan D M, Yang N, Wang W K, et al. A novel cold-active lipase from Candida albicans: cloning, expression and characterization of the recombinant enzyme [J]. Int J Mol Sci, 2011, 12(6): 3950-3965. |
| [12] | Singleton D R, Masuoka J, Hazen K C. Cloning and analysis of a Candida albicans gene that affects cell surface hydrophobicity [J]. Bacteriol, 2001, 183(12): 3582-3588. |
 2014, Vol. 45
2014, Vol. 45


