2. 湖北中医药大学, 湖北 武汉 430065
2. Hubei University of Traditional Chinese Medicine, Wuhan 430065, China
中药传入欧洲已有300多年历史,在20世纪90年代得到普遍认可并被广泛用于妇产科、皮肤科、胃肠道疾病、精神疾病、过敏性疾病等[1]。长期以来,欧洲各成员国并无统一的草药产品管理法规,除了以草药药品身份,这些产品往往还以食品补充剂、健康产品、化妆品等多种形式在市场销售。为统一草药药品市场管理,2004年欧盟颁布实施2004/24/EC法令,尽管未获药品注册产品有7年过渡期,但至2011年4月该过渡期结束仍无1例中药产品成功注册,截止目前也仅有唯一中药产品——地奥心血康胶囊取得欧盟成员国荷兰上市注册许可,绝大多数中药产品在欧盟面临市场准入危机,无疑对中药的国际地位和中药产业的长远发展造成显著不利影响[2]。因此,解决传统中药产品欧盟药品注册过程中关键问题,是目前中药国际化发展战略中极为重要的课题。
欧盟草药专论(Community Herbal Monograph,CHM)是由欧盟草药药品委员会(committee on herbal medicinal products,HMPC)评价并起草发布的代表欧洲药品局(European Medicines Agency,EMA)对草药安全性和有效性或传统应用观点的类指南性质官方文件,CHM包括固有应用和传统应用2种,本文仅限于针对传统应用CHM的分析与讨论。自2004年EMA正式设立HMPC后,即启动了CHM评价工作。2005年,HMPC在其发布的有关草药安全性和有效性评价技术指南中明确指出,CHM评价标准与传统草药药品简化注册(traditional use registration,TUR)中草药药品有关安全性和有效性的审评标准基本一致[3, 4]&l t;/ span>,CHM还可在TUR审评中作为主要安全性和有效性或传统应用资料而发挥重要作用[5]。另一方面,由于大多欧盟成员国直到2008年3月才正式实施2004/24/EC法令并开展TUR审评工作[6],相比HMPC启动CHM工作晚了近4年,HMPC对CHM评估相较各成员国TUR审评的经验更为丰富;同时,CHM作为EMA层面对传统草药的评价也更具权威性和代表性。在目前欧盟各成员国对草药药品相关审评信息公布尚不完整的情况下,选择CHM为研究切入点,系统分析CHM草药评价中的关键问题,是探寻中药欧盟注册关键环节的最可行和最重要手段。本文旨在明确HMPC传统应用CHM评价现状,对影响CHM建立的关键因素以及中药产品简化注册过程中的关键问题进行深入分析,以期为中药产品欧盟注册提供一定参考。 1 CHM评价现状
按照HMPC评价程序和标准,其对拟建立CHM的传统草药评价结论有2种:一是认为符合传统应用要求,建议建立并起草和发布CHM;一是认为不满足传统应用某1项或某几项要求,不建议建立CHM,即发布公开声明(public statement,PS)。根据HMPC最新发布的官方数据,截止2013年11月底,共有109种传统草药发布传统应用CHM,有13种传统草药发布PS[7]。 1.1 发布CHM的109种草药
分析已建立CHM的109种草药相关适应症和给药方式,与本课题组2011年研究结果类似[8],建立传统应用CHM的草药多有1~3个适应症,少数有4个适应症,主要包括胃肠道不适、泌尿科与妇科疾病、感冒、咳嗽、皮炎和小创伤等;在给药方式方面,CHM草药多为口服、外用、口腔黏膜给药等。上述CHM草药的特点均满足2004/24/EC法令第16a(1)条对传统草药a、b、c、d、e的5项基本要求。其中,(a)适应症应设计为不需医师指导即可应用于诊断、处方和治疗;(b)有特定规格和剂量;(c)是口服、外用或吸入制剂;(d)具有至少30年药用历史,包括欧盟境内至少15年药用证据;(e)有充分药品传统应用证据,特别是基于长期使用和经验证明该产品在特定条件下使用无害,而且具有药理作用或药效合理性证据。
值得进一步说明的是,对于109种CHM草药的传统应用来源,绝大部分来源于欧盟境内,仅有少部分同时包括了欧盟和非欧盟地区,如中国或印度。笔者经仔细对比统计发现,针对已建立CHM的109种传统草药,按照植物品种是否被《中国药典》2010版收载作为“中国传统来源”的评判标准,共计有10种草药同时具有欧盟和中国传统来源,其科、属、种及药用部位与《中国药典》收载品种相同,分别是干姜、贯叶金丝桃、亚麻子、菊苣、没药、姜黄、小茴香、甘草、蒲公英、葫芦巴(表 1)。
| 表 1 10种同时具有欧盟和中国传统来源的发布传统应用CHM的草药 Table 1 Solubility of naringenin in various adjuvants |
截止到2013年底,HMPC对13种草药发布了PS,即认为该13种草药不能建立CHM。其中,有8种草药为非欧盟传统来源草药,洋葱、当归、丁香、白屈菜、积雪草共计5种草药为《中国药典》2010年版收载品种。笔者通过对13个PS草药HMPC评价情况的进一步分析,发现未能满足2004/24/EC法令16a(1)条中某1项或几项对传统草药药品的要求是其主要原因,见表 2。
| 表 2 发布PS的13种草药 Table 2 Thirteen kinds of released PS herbs |
通过对以上109个CHM草药和13个PS草药的分析研究,2004/24/EC法令16a(1)条a、b、c、d、e项对传统草药的5项要求是CHM建立过程中所面临的主要问题,归纳起来主要体现在下述2个方面。 2.1 草药“长期传统应用”的充分证据
按照2004/24/EC法令相关规定,对草药“长期传统应用”证据的要求实质包含3方面内容:(1)30年以上的该草药传统药用历史;(2)至少15年以上的欧盟境内药用历史;(3)基于长期应用的“药理合理性”证据。其中,在法令16a(1)条d项中对在欧盟境内至少15年药用历史的规定,是直接影响草药尤其非欧盟来源草药能否建立CHM的最主要原因,见图 1。如来自中国的当归和丁香,来自印度的Adhatodae Vasicae Folium和Andrographidis Paniculatae Folium虽有超过30年甚至数百年以上传统药用证据,但并无公开文献或上市药品证明其在欧盟境内有任何药用历史,因而无法建立CHM。而对于法令16a(1)条e项中规定的关于草药“药理合理性”证据问题,由于20世纪末开始全球范围内对植物药研究的高度重视,已有大量运用现代科学方法对草药活性成分及药理作用特点进行研究的文献,即使缺乏某种草药的现代药理学或活性成分研究报道,也可通过补充开展相关实验研究解决该问题。因此,无法提供15年以上欧盟药用历史的充分证据,是目前导致草药尤其非欧盟来源草药“长期传统应用”证据不充分的最为关键原因。
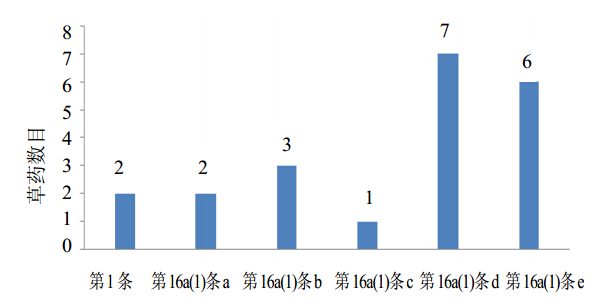 | 图 1 发布PS草药所不满足的2004/24/EC法令条款 Fig. 1Released PS herbs unsatisfied 2004/24/EC law provisions |
证明草药“在特定条件下使用安全”的证据主要涉及2004/24/EC法令16a(1)条a、b、c、e等4项对传统草药的要求,包括2方面:(1)草药长期应用所积累大量研究资料和数据显示其不存在安全性隐患;(2)有资料证明草药这种长期应用是在特定条件下使用,如特定剂量、适应症、给药途径等,这里特定的适应症是指必须满足自我药疗的要求,即适应症应不需医师指导即可应用于诊断、处方和治疗,与非处方药对适应症的要求基本一致。根据对上述13个发布PS草药的分析,草药的安全性问题是导致不能建立CHM的另1个重要因素,见图 1。多数草药因其提取物或其中所含有植物化学成分的毒性报道而引起HMPC对其安全性的质疑,如当归中的黄樟醚、异黄樟醚成分有大量遗传毒性报道,其中所含的香豆素具有光毒性等[9]。同时,部分草药不能建立CHM的原因,还包括草药特定剂量使用的资料不充分,适应症和给药途径超出自我药疗范畴等。
由以上分析可以看出,缺乏15年以上欧盟药用历史证据和安全性问题是导致传统草药,尤其是包括中药产品在内的非欧盟地区传统草药不能建立CHM的2个最为重要因素。此外,也有少数草药因不符合欧盟“草药提取物”定义而无法建立CHM而被发布PS,如积雪草的一种提取物(titrated extract of Centella asiatica,TECA)约含40%积雪草苷和60%三萜皂苷元(积雪草酸和羟基积雪草酸),其制备过程涉及纯化步骤和改变草药成分组成的化学处理方式,最终使TECA成为与积雪草原成分比例不符的高度精制提取物。基于其制备工艺和成分组成特点,HMPC认为积雪草提取物TECA已不符合欧盟对草药提取物的定义,尽管其满足包括使用年限、适应症和给药途径限制等传统草药要求,仍不推荐TECA建立CHM[10]。 3 传统草药(中药)欧盟注册关键问题
主要针对13个未能建立CHM,即发布PS草药的进一步分析研究,结果证实了传统草药的CHM评价标准与其相关产品的TUR基本一致。因此,能否提供15年以上欧盟药用历史证据和充分的安全性证据,也是中药产品欧盟注册的2大主要挑战。
更进一步,由于草药产品按照传统草药药品进行简化注册申请时,允许采用专家证据和安全性综述等文献资料代替产品临床前药理毒理和临床试验研究数据;同时,由于欧盟当局对传统中医药理论等非欧盟传统医学缺乏足够认识和理解,以及不同国家和地区药品上市后药物警戒标准和水平有所差异,导致欧盟不得不对传统草药药品设定某些特殊要求以充分保障其安全性。从这一角度考虑,事实上上述讨论的关键因素中,无论对至少15年欧盟药用证据的要求,还是对传统草药适应症、给药途径等多方面的限制,其核心与实质均为确保传统草药的安全性。同时,从中药产品欧盟注册实践考虑,以唯一在欧盟成员国获得TUR批准上市的中药产品——地奥心血康胶囊为例,该产品2010年9月从荷兰药品局(Dutch Medicines Evaluation Board,MEB)启动审评到2012年3月批准注册申请累计召开5次会议,几乎每次讨论主题均涉及包括毒理资料、药物警戒学数据等安全性问题,甚至包括产品在中国使用安全的临床资料外推至在欧洲人群证据的讨论[11]。因此,无论从对欧盟CHM和传统草药药品法规制定的背景和实际,还是从对中药产品欧盟注册实践的分析,针对中成药这类非欧盟来源产品而言,安全性问题都是目前传统草药药品简化申请与审评中的首要问题。
另值得注意的是,欧盟草药提取物与我国对中药提取物的定义存在差异。欧盟草药提取物是指由草药制备而得到的粉碎或粉状草药材、酊剂、提取物、挥发油、压榨汁和经加工的分泌物等,其制备方法包括萃取、蒸馏、压榨、分馏、纯化、浓缩或发酵。同时,HMPC 2010年发布的对草药提取物纯度认定的技术指南(Reflection paper on the level of purification of extracts to be considered as herbal preparations),其中明确指出不能被认定为草药提取物的2种情况:制备工艺中涉及化学处理过程;单一成分的高度富集,HMPC认为通常情况下草药提取物活性成分的量不能高于70%[12]。而根据《药品注册管理办法》我国1类中药中单一成分量可占总提取物90%以上,同时并未对中药提取物制备方法进行明确规定。因此,我国中药企业在开展欧盟注册时,应对产品纯度和制备工艺引起高度重视,避免因不符合欧盟提取物定义而导致注册失败。 4 讨论与建议
欧盟2004/24/EC法令对传统草药药品实行简化注册,但基于上述各种原因,对非欧盟本土来源的传统中药而言仍面临诸多挑战,使中药产品的欧盟注册进展极为缓慢。尽管如此,国内仍有1批坚持中药国际化发展的企业先后开展中药欧盟注册工作,笔者通过上述研究分析主要提出如下3方面建议。 4.1 充分利用已经建立的欧盟传统应用CHM,在中药欧盟注册中具有重要价值
CHM是草药药品传统应用和安全性的重要证据,一旦产品所涉及的草药建立CHM,申请者无需提交欧盟境内至少15年药用证据和其他药理学资料[4]。基于HMPC已建立相当数量CHM及其在TUR中的重要作用,已有欧洲本土草药企业在其产品注册中成功借助相应CHM获得注册批准,如2013年8月英国药品和健康产品管理局(Healthcare products Regulatory Agency,MHRA)批准的以缬草提取物为主要活性部位的Kiwiherb Valerian口服液就充分利用了缬草CHM作为其传统应用和安全性证据[13],从而避免繁琐的传统应用证据相关资料的准备,以及证明产品安全性相关的动物试验甚至临床研究。因此,国内中药企业选择中药品种开展欧盟注册时,应密切关注欧盟CHM评价中涉及的传统中药,充分利用HMPC已建立CHM的中药(如干姜、亚麻子、姜黄、小茴香、甘草等),同时尽量避免HMPC发布PS的中 药(如当归、丁香、白屈菜、积雪草等)。 4.2 积极组织和参与传统中药CHM的评价工作,推动中药产品欧盟注册
中药在欧盟广泛用于妇产科、皮肤科疾病和胃肠道疾病、精神疾病、过敏性疾病等[1],与CHM适应症范畴基本一致,建立中药CHM具备其可行性。同时,基于已有大量欧洲人群依赖传统中药进行疾病预防和慢性病治疗,中药产品在欧盟药品市场的被迫撤市,不仅对中药产业造成巨大影响,而且也不利于欧洲公众健康保护。近年来,HMPC极为重视中药CHM评价工作[14, 15, 16],自2011年相继针对传统中药CHM试点项目的启动,以及欧盟境内常用传统中药在评价中所存在问题进行了多次讨论,并拟进一步统一中药CHM评价标准并建立相关技术指南。然而,国内中药企业和业内人士对欧盟CHM及其价值的认识十分有限,对传统中药的CHM工作不够重视,因而目前HMPC的CHM评价名单中涉及的中药品种仍然屈指可数。因此,建议从政府和相关行业组织层面牵头,积极与HMPC开展中药CHM评价的合作工作,将有力提升中药产品在欧盟的学术地位并助力相关产品欧盟注册进程,实现中药国际化更好、更快的发展。 4.3 加强中药基础科学研究不仅为草药安全性提供充分证据,也是克服缺乏15年欧盟药用证据的可能有效途径
中药产品开展欧盟注册,应尽可能提供充分的安全性资料,包括从药材采集加工、杂质控制、药理毒理研究资料等。因此,利用现代科学方法加强中药基础研究以阐明中药安全性和毒性特点,明确中药物质基础和作用机制,并在国际发表科学文献对中药的欧盟注册十分重要。同时,根据2004/24/EC法令第16c(4)条规定,如果产品所涉及的草药在欧盟的应用不足15年,但满足简化注册申请的其他要求,针对这种情形,成员国药品审评机构可向HMPC申请“移交(referral)”程序,经HMPC对该产品所有资料进行系统评估后,决定是否仍可通过传统草药简化注册。通过中药产品的相关基础科学研究获得科学数据,是支撑HMPC评估产品药效合理性和安全性的重要基础,因此,加强中药基础研究,仍是克服15年欧盟药用证据这一重要挑战的可能有效途径。
此外,因欧盟CHM主要评价草药安全性和有效性,不涉及产品质量相关问题,本文从CHM角度并未对中药欧盟注册中质量相关关键因素进行讨论。但药品质量是确保安全性和有效性的基础,任何草药产品在欧盟药品注册中,必要确保产品质量符合欧盟对质量控制的现行标准,如良好种植与采集规范(Good Agricultural and Collection Practice,GACP)、良好生产规范(Good Manufacturing Practice,GMP)等,只有满足欧盟对药品质量、安全性、有效性的要求才能成功通过欧盟药品注册批准。
| [1] | Williamson E M, Lorenc A, Booker A, et al. The rise of traditional Chinese medicine and its materia medica: A comparison of the frequency and safety of materials and species used in Europe and China [J]. J Ethnopharmacol, 2013, 149(2): 453-462. |
| [2] | 瞿礼萍, 邹文俊, 姬建新, 等.中药产品欧盟上市可行途径及法规解析 [J]. 中草药, 2014, 45(5): 603-607. |
| [3] | Steinhoff B. The first HMPC community herbal monographs [J]. Phytomedicine, 2006, 13(5): 378-379. |
| [4] | Committee on Herbal Medicinal Products. Guideline on the assessment of clinical safety and efficacy in the preparation of community herbal monographs for well-established and of community herbal monographs/ entries to the community list for traditional herbal medicinal products/substances/preparations [S/OL]. 2006- 09-07. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific _guideline/2009/09/WC500003644.pdf. |
| [5] | European Medicines Agency. Uptake of the traditional use registration scheme and implementation of the provisions of directive 2004/24EC in EU Member States (revision 3) [S/OL]. 2013-05-08. http://www.ema.europa.eu/docs/en_GB/document_library/ Report/2011/05/WC500106706.pdf. |
| [6] | Commission of the European Communities. Communication from the Commission to the Council and the European Parliament concerning the report on the experience acquired as a result of the application of the provisions of Chapter 2a of Directive 2001/83/EC, as amended by Directive 2004/24/EC, on specific provisions applicable to traditional herbal medicinal products [S/OL]. 2008-09-29. http://eur-lex.europa.eu/legal-content/EN/ALL/;jsessionid=v7ryT4lPcvv 3pd2xM1tgJ3QnHbdX-1ltV1bTjpDtlv2RTbnLCwyFH!-1014547573?uri=CELEX: 52008DC0584. |
| [7] | Committee on Herbal Medicinal Products. Overview of assessment work-Priority list [S/OL]. 2013-11-22. http://www.ema.europa.eu/docs/en_GB/document_library/Other/2009/12/WC500017724.pdf. |
| [8] | 邹文俊, 瞿礼萍, 叶祖光, 等. 欧盟传统草药专论述评 [J]. 中国中药杂志, 2011, 36(23): 3386-3388. |
| [9] | Committee on Herbal Medicinal Products. Assessment report on Angelica sinensis (Oliv.) Diels, radix [S/OL]. 2013-07-09. http://www.ema.europa.eu/docs/en_GB/document_library/Herbal_-_HMPC_assessment_report/2013/11/WC500155549.pdf. |
| [10] | Committee on Herbal Medicinal Products. Assessment report on Centella asiatica (L.) Urban, herba [S/OL]. 2010-11-25. http://www.ema.europa.eu/docs/en_GB/document_library/Herbal_- _HMPC_assessment_report/2012/06/WC- 500128144.pdf. |
| [11] | Dutch Medicines Evaluation Board. Public assessment report of Diao Xin Xue Kang capsules for oral use [S/OL]. 2012-03-14. http://db.cbg-meb.nl/Pars/h102142.pdf. |
| [12] | Committee on Herbal Medicinal Products. Reflection paper on the level of purification of extracts to be considered as herbal preparations [S/OL]. 2010-09-16. http://www.ema.europa.eu/docs/en_GB/document_ library/Scientific_guideline/2011/01/WC500100375.pdf. |
| [13] | Medicines and Healthcare Products Regulatory Agency. UK Public assessment report of Phytovein Capsules [S/OL]. 2011-03-24. http://www.mhra.gov.uk/home/groups/par/documents/websiteresources/con123265.pdf. |
| [14] | Committee on Herbal Medicinal Products. Report on 'Action plan for herbal medicines 2010—2011' [S/OL]. 2012-06-08. http://www.ema.europa.eu/docs/en_GB/document_library/Report/2012/06/WC500128647.pdf. |
| [15] | Committee on Herbal Medicinal Products. HMPC meeting report on Community herbal monographs, guidelines and other activities [S/OL]. 2012-10-31. http://www.ema.europa.eu/docs/en_GB/document_library/Committee_ meeting_report/2012/11/WC500134490.pdf. |
| [16] | Committee on Herbal Medicinal Products. HMPC work programme for 2012-2015 [S/OL]. 2011-11-22. http://www.ema.europa.eu/docs/en_GB/ document_library/Work_programme/2011/12/WC500119957.pdf. |
 2014, Vol. 45
2014, Vol. 45


