2. 天津第一中心医院, 天津 300192
2. Tianjin First Center Hospital, Tianjin 300192, China
中药是由多种化学成分所组成的复杂混合体系,并且中医用药经常采用多种药物配伍组成复方,这就给深入、系统的研究中药成分带来了巨大的挑战。丹参为唇形科植物丹参Salvia miltiorrhiza Bunge的干燥根和根茎,具有活血祛瘀、通经止痛、清心除烦、凉血消痛的功效[1]。近年来,丹参及含丹参中药制剂因为显著的治疗作用,特别是在心血管疾病治疗领域,越来越为人们所关注[2],众多科学工作者从化学、药理学、临床应用、安全性评价及质量控制等方面对丹参进行了大量的研究[3]。液质联用技术(LC-MS)集中体现了液相色谱(LC)高效的分离能力和质谱(MS)强大的结构鉴定能力,为混合物的快速、准确分析提供了一种有效的手段,现已广泛地应用于中药化学成分分析[4],MS对于中药中已知物的快速定性及未知物的识别均具有极强的选择性。电喷雾电离(ESI)和大气压化学电离(APCI)为LC-MS最主要的2种离子源。LC-MS最常用的在线检测器包括:三重四级杆(TQ或MS/MS)、离子阱(IT或MSn)、傅里叶变换离子回旋共振(FTICR)、飞行时间(TOF)等。其中,TQ主要用于定量分析,IT可以提供母离子和子离子之间的多极质谱数据,FTICR及TOF可以提供高分辨质谱数据及化合物的元素组成[5]。此外还包括常与LC连接用于定量分析的紫外检测器(UV或DAD)、蒸发光散射检测器(ELSD)以及电化学检测器(ED)等。近年来,基于现代仪器分析技术的丹参及含丹参中药制剂中有效成分的体内外分析有了很大的进展,主要方法包括LC、超高效液相色谱法(UPLC或UFLC)、薄层色谱(TLC)、气相色谱(GC)、红外光谱(IR)及LC-MS等。本文将对近年来国内外有关采用LC-MS技术分析丹参有效成分的文献进行系统的整理,对丹参有效成分分析的研究进展进行综述。
1 体外成分分析 1.1 丹参有效成分分析目前,已从丹参药材中分离出70多种化合物,主要包括水溶性的酚酸类成分和脂溶性的二萜醌类成分(主要成分结构信息见图 1),其中酚酸类成分是主要的活性成分[3],对丹参药材中酚酸类成分的分析都在负离子模式下进行,并且多采用ESI的方式离子化[5],而二萜醌类成分则采用正离子模式[6, 7, 8, 9, 10, 11]。丹酚酸B和丹参酮IIA作为最主要的活性成分,常作为丹参药材及含丹参中药制剂质量控制的标志物[1]。
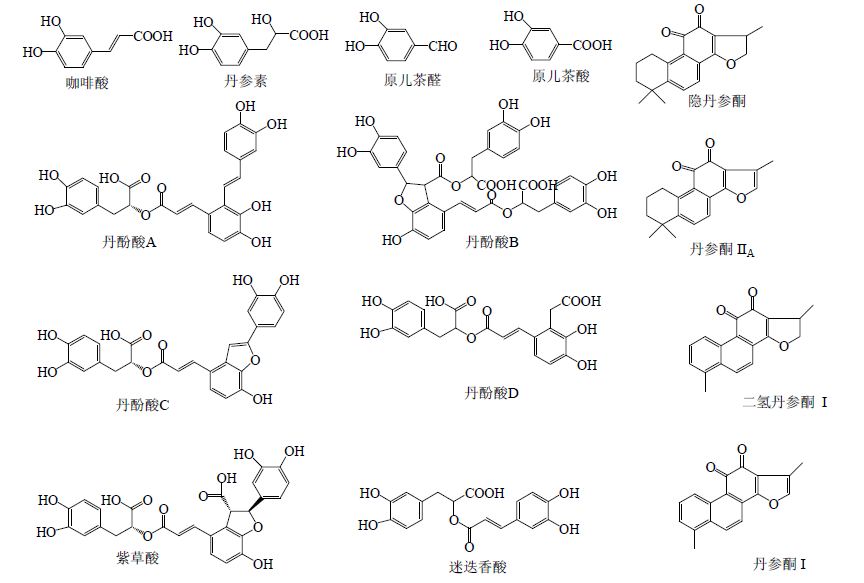 | 图 1 丹参中主要化学成分结构Fig. 1 Structures of main chemical constituents in S. miltiorrhiza |
Zeng等[12]通过LC/ESI-MS/MS对丹参药材中酚酸类成分进行了分析。采用TQ作为检测器,发现咖啡酸及其同系物包含一个容易脱掉CO2的羧基,并确定了提取物中28种成分。宋敏等[13]通过LC建立了丹参脂溶性成分指纹图谱,利用LC-MS/MS对主要特征指纹峰进行了分析,共鉴定出6个化合物。唐小峦等[14]通过LC-UV-MS/MS法分析丹参不同极性提取物,共鉴定出14个成分,并对其中的4个成分进行了定量分析,为相关的谱-效学研究奠定了良好的基础。
IT-MS属于时间上的串联质谱,可以提供多级离子碎片,确定化合物的裂解规律,对于化合物的定性分析具有重要意义。Liu等[15]通过LC-IT-MS对丹参药材的酚酸类成分进行了定性分析,共鉴定42个酚酸类成分,其中16个为首次发现,说明IT比TQ更适合中药有效成分的定性分析。沈建芳等[8]通过LC-IT-MS探讨丹参酮IIA的质谱裂解规律,并建立了丹参酮部位特征图谱,对特征图谱中11种主要化合物进行了归属。董昕等[9]通过LC-IT-MS对丹参药材中的水溶性及脂溶性成分进行较为全面的质谱行为考察,分别对8个丹参对照品进行了多级质谱裂解分析,并总结了丹参酚酸类和丹参酮类成分的裂解规律,根据裂解规律对药材中的目标成分进行归属。赵新锋等[16]利用超临界萃取仪(SCFE)获得丹参总提物,采用LC-IT-MS对总提物的化学成分进行分析,确定了15种化学成分,其中2种为未知成分。韩凤梅等[17]通过LC-IT-MS研究脂溶性丹参酮类成分的裂解规律,建立了脂溶性丹参酮类成分提取物的特征图谱。脂溶性丹参酮类物质具有相似的ESI-MS行为,裂解规律可用于鉴别丹参脂溶性化合物。
TOF也被有效地应用于丹参酚酸类成分分析中,通过获得的准确相对分子质量及分子式数据库,大量的化合物得到了确认[18, 19]。于文佳等[10]利用LC-TOF-MS对丹参脂溶性成分进行了定性分析,共鉴定15个脂溶性成分。刘劼等[11]通过LC-TOF-MS研究二氢丹参酮I、丹参酮I、隐丹参酮和丹参酮IIA的分子结构与MS裂解规律间的关系,并对丹参提取物中的脂溶性成分进行鉴定。结果表明4种化合物因为相似的结构而具有相似的裂解规律,该规律被认为是二萜醌类结构的特征裂解规律。通过TOF提供的精确相对分子质量,共鉴定出16个丹参酮类成分。Zhou等[20]通过LC-TOF-MS对丹参脂溶性成分进行了分析,共鉴定出21个成分,并对其中的12个成分进行了定量分析。Song等[21]采用主成分分析(PCA)与UPLC-UV-TOF-MS相结合的方法,对丹参进行了质量控制方面的研究。通过PCA技术筛选质控标志物,再通过TOF-MS对这些标志物进行准确的定性,结合抗氧化活性筛选,最终制定了与生物活性相关的丹参质量控制方法。董倩倩等[22]建立靶细胞提取与LC/ESI-TOF-MS分析相结合进行丹参活性成分研究的方法,对丹参中可能的活性成分进行了推测。在不同细胞提取液中发现7个水溶性成分。此外,还有一些研究通过单次进样同时分析了水溶性成分与脂溶性成分[23, 24, 25]。
1.2 含丹参中药制剂成分分析近年来在临床中经常使用的、疗效确切的含丹参中药制剂品种越来越多,主要包括复方丹参滴丸、丹参注射液、香丹注射液等,通过LC-MS技术可以对这些制剂的物质组成、含量分布进行系统研究。Zhang等[26]建立了丹参注射液的LC-MS指纹图谱及代谢指纹图谱,从注射液中鉴定出11种丹参酚酸类成分,体内结果表明注射给药后丹参素、丹酚酸B消除迅速,紫草酸、丹酚酸A/D消除缓慢,并且在注射给药后30 min内一直维持相对较高的血药浓度,上述结果说明酚酸类成分可能是丹参注射液中最主要的生物活性成分。Liu等[23]建立了4种含丹参制剂(复方丹参片、丹参滴丸、丹参注射液、香丹注射液)的LC-MSn指纹图谱,共鉴定水溶性及脂溶性成分34个。章弘扬等[27]采用LC-TOF-MS结合LC-MSn对复方丹参滴丸的化学组成进行了分析,共鉴定出来自丹参的成分8个。韦英杰等[28]采用LC-MSn对复方丹参方的化学成分进行分析,共鉴定来自丹参中的成分23个。马晓红等[29]通过LC-MSn从复方丹参片中鉴定出来自丹参的成分6个。胡兴江等[30]通过LC-MS技术研究丹参与丹皮配伍的化学成分,鉴定并归属配伍煎液中19个成分,其中11个来自丹参,8个来自丹皮,配伍后丹参酚酸类、芍药苷类成分的量高于单煎,而鞣质的量降低。傅俊曾等[31]采用LC-MS/MS技术对芪参益气滴丸中丹参有效成分丹参素、原儿茶醛进行了定量分析,为该药的质量控制提供了依据。
2 体内成分分析中药多采用口服的方式给药,机体对药物的处置可分为吸收、分布、代谢及排泄4个相互关联的过程,从血清药理学的角度出发药物口服后只有被血液吸收的成分才有可能成为真正的有效成分[32]。因此,通过LC-MS研究中药有效成分的体内过程对于明确药效物质基础及解释和预测疗效和毒副作用,制定合理的给药方案是非常必要的。
2.1 丹参有效成分的体内分析对丹参有效成分的体内研究主要集中在药动学、组织分布、代谢等方面。丹酚酸B在体内可以产生多种代谢产物[33, 34, 35],通过LC-MS/MS技术可以对丹酚酸B及其代谢产物的药动学特征进行分析[34]。Xu等[35]通过LC-MSn分析了丹酚酸B口服给予正常/抗菌治疗大鼠后,胆汁和尿液中的代谢产物。正常大鼠的胆汁中发现了4个代谢产物,粪便中有5个,并且在尿液中首次分离出2个新的代谢产物。而在抗菌治疗大鼠的胆汁和尿液中没有发现丹酚酸B的代谢产物,粪便中发现丹酚酸B的原型物。结果表明,肠道菌群在丹酚酸B的吸收、代谢和排泄过程中发挥着重要的作用。丹酚酸B可能的体内代谢途径见图 2[35]。
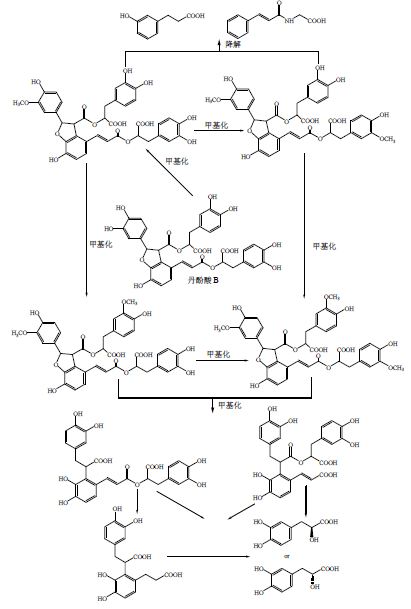 | 图 2 丹酚酸B的体内代谢过程Fig. 2 In vivo metabolic pathways of salvianolic acid B |
隐丹参酮具有显著的杀菌作用,其在体内可以迅速地转化为丹参酮IIA[36],已有研究通过LC-MS/MS对二者的体内药动学过程进行了分析[36, 37]。Sun等[38]通过LC/ESI-DAD-MSn对丹参脂溶性提取物(TTE-50)及其在大鼠胆汁内的代谢产物进行了定性分析,共鉴定16个丹参酮类化合物及17个I相代谢产物。代谢物转化主要发生在丹参酮IIA C-4位侧链,其中从甲基转化为伯醇基再转化为醛基为首次发现。Park等[39]通过LC-MS/MS对丹参标准提取物(PF2401-SF)口服给予大鼠后,丹参酮I、二氢丹参酮I、丹参酮IIA和隐丹参酮的药动学特征进行了研究。丹参酮IIA可能的体内代谢途径见图 3[38]。
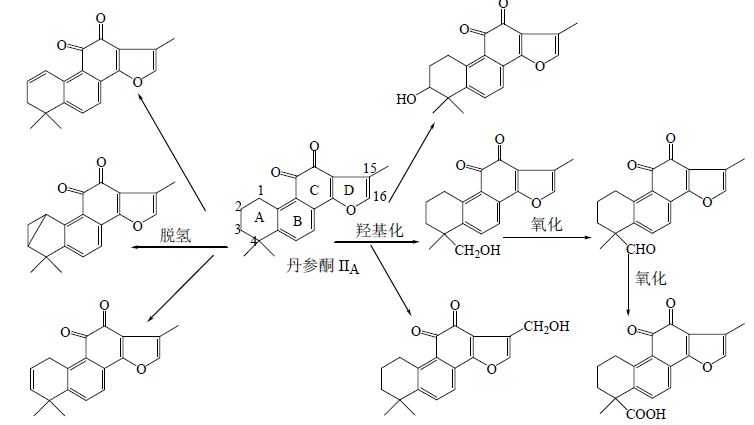 | 图 3 丹参酮ⅡA的体内代谢过程Fig. 3 In vivo metabolic pathways of tanshinone IIA |
Sun等[40]采用LC-MS对丹酚酸A在比格犬体内的药动学特征进行了分析,结果表明丹酚酸A口服后吸收迅速、并且具有较高的清除率及绝对生物利用度低的特点。Cui等[41]通过LC-MS/MS对紫草酸B的药动学特征及其代谢产物进行了分析,在肝细胞培养液、血、尿及胆汁中均发现4个相同的代谢产物,鉴定结果表明甲基化作用是其代谢的主要路径。裴渭静等[42]通过LC-MSn对人血清中的丹参素及其代谢产物进行了研究,发现其主要代谢产物为乙酰化的丹参素。通过LC-MS/MS对Beagle犬血浆中丹参素含量进行测定,发现口服或静脉给予丹参素后血药浓度的达峰时间均在1 h内[43]。张群正等[44]采用LC-MSn对口服丹参滴丸后产生的活性代谢产物丹参素异丙酯的吸收及组织分布进行了系统分析。丁建刚等[45]以地西泮为内标,采用LC-MS/ MS方法,建立Beagle犬血浆中丹参酮IIA的测定方法。
丹参中包含多种类型的化合物,单一成分并不能反映药材的整体特征,因此多成分分析对于明确丹参药材的作用特点具有重要的意义。林力等[46]采用LC-MS/MS方法建立了同时检测Beagle犬血浆中丹酚酸D、丹酚酸B、紫草酸和迷迭香酸的分析方法,并对丹参提取物中4种化合物的药动学特征进行了分析。Li等[47]建立了一种同时测定人血清中6种水溶性成分的LC-MS/MS方法,该法可以用于丹参注射液中该6种成分的药动学研究。Liu等[48]给大鼠口服丹参提取物,通过LC-MS/MS技术建立了一种同时测定血浆中丹参水溶性成分(丹参素、迷迭香酸)与脂溶性成分(隐丹参酮、丹参酮IIA、丹参酮I、二氢丹参酮I)的方法,并对6种成分的药动学参数进行了计算,实现了2类成分的同时测定。
2.2 丹参制剂中有效成分的体内分析与化学药物相比,中药产品中含有大量的化学成分,特别是多种中药配伍组成的复方,复方中多种药物之间可以通过不同的配伍关系而发挥协同增效或减毒等作用。复方的治疗作用与其中所含各种化学成分的协同作用密切相关。一种中药成分具有药物的属性必须满足以下3个条件:(1)广泛的安全范围;(2)适当的药动学性质;(3)在药材中有大量的分布。某些可以在血浆或者尿液等生物样品中检测出的中药有效成分,具有适当的药动学性质,可以用来证实中药的系统暴露水平,就可以作为该种中药的药物代谢标志物[49],而合适的药物代谢标志物的选择对于设计和解释毒性及临床疗效,评估潜在的药物之间相互作用具有重要意义[50]。
Li等[51]通过LC-MS/MS技术对丹参总酚酸盐注射液中紫草酸B、迷迭香酸及紫草酸的药动学、组织分布、代谢、排泄的过程进行了系统分析。注射给药后丹参总酚酸盐快速而广泛地分布于组织内,而后被快速地消除和代谢。韦英杰等[28]对复方丹参方在家兔血浆、尿及粪便中的代谢产物进行了定性分析,共鉴定出10个丹参的转化成分,结果表明丹参酚酸类成分不以原型存在,而会发生羟基化,或与葡萄糖醛酸、硫酸形成结合型代谢产物;丹参二萜醌类成分可能仅在同类成分间转化,不会生成新的成分。Geng等[52]对仙灵骨葆在大鼠体液中的代谢指纹图谱进行了分析,通过UPLC/Q-TOF-MS共鉴定出5个丹参酚酸类成分,7个丹参酮类成分。Qiao等[53]对冠心II号方代谢指纹图谱的化学组成进行了分析,通过LC-DAD-IT-MS技术共鉴定丹参原型成分及代谢产物16个。Yang等[54]对扶正化瘀方口服给予大鼠后血中来自丹参的成分进行了分析,采用LC/ESI-MSn技术共鉴定原型成分11个、代谢产物2个。姜璇等[55]采用LC-MS/MS法,对大鼠尿和粪中复方丹参滴丸3种成分(原儿茶醛、原儿茶酸、丹参素)的代谢产物进行分析和鉴定。在大鼠尿中检测到2种原型成分和6种代谢物,在粪中检测到1种原型成分和1种代谢物。郑晓晖等[56]通过LC-IT-MS研究复方丹参滴丸的人含药血清中丹参相关代谢产物,检测到5个新的代谢产物,并分析了各代谢物的体内形成机制。
Xu等[57]采用UFLC-MS/MS方法对大鼠口服补肾活血方后血中隐丹参酮和丹参酮IIA的药动学特征进行了分析,并计算了二者的药动学参数。游燕等[58]通过LC-MS/MS技术对复方丹参方口服后的药动学进行研究,发现丹参有效成分丹参素、丹酚酸A、隐丹参酮、丹参酮IIA的吸收均符合二室模型。杨荣等[59]通过建立LC-MS/MS分析方法,研究丹参-郁金中丹参素在兔体内的组织分布,表明丹参素在各组织中的分布特征:肾>脑>肝>脾>肺>心。Yang等[60]采用UPLC-MS/MS法对比了复方丹参方单味药材与全方中主要有效成分的药动学差异,发现与冰片配伍后丹参酮IIA的吸收速率变快,丹酚酸B的体内暴露量明显变大,说明复方配伍后可能产生了药物之间的相互作用。
3 结语丹参中包含两大类活性成分,即水溶性的酚酸类成分和脂溶性的二萜醌类成分,此两类成分对丹参及其制剂临床疗效的发挥起着关键作用。有效成分分析对于保证药材及制剂的安全有效意义重大,这就需要适宜的分析方法提供可靠的技术支持。LC-MS作为近年来应用广泛的现代分析技术,具有灵敏度高、选择性强的特点,通过其提供的详细化学信息,可以对以中药为代表的复杂混合体系进行快速、准确的定性及定量分析。对于MS数据的解析需要具有较高水平的专业技术知识,现阶段商业化的MS数据库提供的都是电子轰击电离(EI)数据,而LC-MS最主要使用的是ESI和APCI,由这2种软电离方式产生的碎片与EI大不相同。因此,发展和建设LC-MS的专用数据库是非常有必要的,对于易受质谱条件影响的ESI及APCI来说现在还处于初级摸索阶段。目前,高分辨质谱(TOF、FTICR)的广泛应用对于中药有效成分定性分析提供了很好的帮助,再结合色谱峰保留时间、UV、碎片信息及文献数据等可以对有效成分进行准确的分析。在定量分析时复杂基质可能引起离子抑制或增强作用,进而影响LC-MS结果的准确度和精密度。样品前处理方法的选择、LC及MS的工作参数的优化对于解决这些问题至关重要。本文从体内、体外2个方面,综述了LC-MS在丹参及其制剂成分分析中的应用,大部分文献仅仅是采用LC-MS对其中所含化合物进行测定,还缺少深入的研究。因此,通过LC-MS技术研究丹参所含化学成分与功效之间的相关性是十分有必要的。以中医药理论为指导,以LC-MS技术为研究手段,深入系统地进行成分分析对于提高质量控制标准、更好的利用丹参药材及其制剂、明确其治疗疾病的物质基础具有重要意义。随着现代科技的不断发展,LC-MS将日臻完善,在中药及制剂成分分析中的应用也将更加深入。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | Cheng T O. Danshen:what every cardiologist should know about this Chinese herbal drug [J]. Int J Cardiol, 2006, 110(3):411-412. |
| [3] | Li Y G, Song L, Liu M, et al. Advancement in analysis of Salviae miltiorrhizae Radix et Rhizoma (Danshen) [J]. J Chromatogr A, 2009, 1216(11):1941-1953. |
| [4] | Li M, Hou X F, Zhang J, et al. Applications of HPLC/MS in the analysis of traditional Chinese medicines [J]. J Pharm Anal, 2011, 1(2):81-91. |
| [5] | Yang M, Sun J, Lu Z, et al. Phytochemical analysis of traditional Chinese medicine using liquid chromatography coupled with mass spectrometry [J]. J Chromatogr A, 2009, 1216(11):2045-2062. |
| [6] | 戴海学, 徐艳霞, 刘 蕴, 等. 隐丹参酮的电子电离和电喷雾电离质谱分析 [J]. 质谱学报, 2006, 27(4):198-202. |
| [7] | 戴海学, 李晓蓉, 李宇航, 等. 丹参酮IIA和丹参酮I的电子轰击与电喷雾电离质谱分析 [J]. 分析实验室, 2008, 27(5):24-29. |
| [8] | 沈建芳, 汪 红, 王 强, 等. 丹参中丹参酮成分的HPLC-MSn研究 [J]. 中国现代应用药学, 2010, 27(10):944-947. |
| [9] | 董 昕, 徐 立, 娄子洋. 丹参药材中水溶性及脂溶性成分的电喷雾离子阱质谱研究 [J]. 中国药学杂志, 2010, 45(14):1048-1054. |
| [10] | 于文佳, 何 坚, 沈金灿, 等. 高分辨率电喷雾飞行时间质谱测定丹参脂溶性组分 [J]. 高等学校化学学报, 2003, 24(4):621-623. |
| [11] | 刘 劼, 杨黄浩, 黎先春, 等. 高效液相色谱-电喷雾飞行时间质谱分析丹参中的丹参酮类化合物 [J]. 质谱学报, 2008, 29(5):261-267. |
| [12] | Zeng G F, Xiao H B, Li J X, et al. Identification of phenolic constituents in Radix Salvia miltiorrhizae by liquid chromatography/electrospray ionization mass spectrometry [J]. Rapid Commun Mass Spectrom, 2006, 20(3):499-506. |
| [13] | 宋 敏, 杭太俊, 张正行. 丹参脂溶性成分指纹图谱标准的对照品对照法研究 [J]. 药物分析杂志, 2007, 27(1):8-12. |
| [14] | 唐小峦, 李焕德. HPLC-UV/ESI-MS法分析丹参不同提取组分 [J]. 中南药学, 2008, 6(6):707-711. |
| [15] | Liu A H, Guo H, Ye M, et al. Detection, characterization and identification of phenolic acids in Danshen using high-performance. liquid chromatography with diode array detection and electrospray ionization mass spectrometry [J]. J Chromatogr A, 2007, 1161(1/2):170-182. |
| [16] | 赵新锋, 王中秋, 赵 欣, 等. 丹参的HPLC-ESI-MSn分析 [J]. 中成药, 2005, 27(9):1068-1069. |
| [17] | 韩凤梅, 张 玲, 陈怀侠, 等. 丹参脂溶性成分的ESI-MS行为及其特征图谱研究 [J]. 中草药, 2006, 37(1):122-125. |
| [18] | Zhu Z, Zhang H, Zhao L, et al. Rapid separation and identification of phenolic and diterpenoid constituents from Radix Salvia Miltiorrhizae by high-performance liquid chromatography diode-array detection, electrospray ionization time-of-flight mass spectrometry and electrospray ionization quadrupole ion trap mass spectrometry [J]. Rapid Commun Mass Spectrom, 2007, 21(12):1855-1865. |
| [19] | 赵洪芝, 王 静, 姜 民, 等. 丹参总酚酸提取物UPLC指纹图谱及成分定性研究 [J]. 药物分析杂志, 2012, 32(4):620-622. |
| [20] | Zhou Y, Xu G, Choi F F, et al. Qualitative and quantitative analysis of diterpenoids in Salvia species by liquid chromatography coupled with electrospray ionization quadrupole time-of-flight tandem mass spectrometry [J]. J Chromatogr A, 2009, 1216(24):4847-4858. |
| [21] | Song J Z, Li S L, Zhou Y, et al. A novel approach to rapidly explore analytical markers for quality control of Radix Salviae Miltiorrhizae extract granules by robust principal component analysis with ultra-high performance liquid chromatography-ultraviolet-quadrupole time-of-flight mass spectrometry [J]. J Pharm Biomed Anal, 2010, 53(3):279-286. |
| [22] | 董倩倩, 李 萍, 宋 越, 等. 靶细胞提取和高效液相飞行时间质谱联用分析预测丹参中的活性成分 [J]. 分析化学, 2007, 35(5):648-652. |
| [23] | Liu A H, Lin Y H, Yang M, et al. Development of the fingerprints for the quality of the roots of Salvia miltiorrhiza and its related preparations by HPLC-DAD and LC-MSn [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 846(1/2):32-41. |
| [24] | Wu J L, Yee L P, Jiang Z H, et al. One single LC-MS/MS analysis for both phenolic components and tanshinones in Radix Salviae Miltiorrihizae and its medicinal products [J]. Talanta, 2007, 73(4):656-661. |
| [25] | 刘 梅, 夏鑫华, 侴桂新, 等. 丹参药材超高效液相色谱指纹图谱研究 [J]. 广州中医药大学学报, 2009, 26(6):559-564. |
| [26] | Zhang J L, Cui M, He Y, et al. Chemical fingerprint and metabolic fingerprint analysis of Danshen injection by HPLC-UV and HPLC-MS methods [J]. J Pharm Biomed Anal, 2005, 36(5):1029-1035. |
| [27] | 章弘扬, 胡 坪, 梁琼麟, 等. 结合两种LC/MS方法用于复方丹参滴丸中多成分的鉴定 [J]. 中成药, 2009, 31(1):60-64. |
| [28] | 韦英杰, 李 萍, 舒 斌, 等. 高效液相色谱-电喷雾离子阱质谱法鉴定复方丹参方化学及代谢成分 [J]. 分析化学, 2007, 35(1):13-18. |
| [29] | 马晓红, 张 铃, 蔡 敏, 等. 复方丹参片的高效液相色谱/质谱特征图谱研究 [J]. 分析科学学报, 2008, 24(2):163-166. |
| [30] | 胡兴江, 贺 庆, 程冀宇. HPLC-MS研究丹参与丹皮配伍的化学成分 [J]. 药物分析杂志, 2007, 27(5):621-624. |
| [31] | 傅俊曾, 宋生有, 姜 民, 等. 液相色谱-质谱联用同时测定芪参益气滴丸中黄芪甲苷、丹参素、原儿茶醛、人参皂苷Rg1和Rb1含量 [J]. 中国药学杂志, 2012, 47(1):61-64. |
| [32] | Wang X J, Sun W J, Sun H, et al. Analysis of the constituents in the rat plasma after oral administration of Yin Chen Hao Tang by UPLC/Q-TOF-MS/MS [J]. J Pharm Biomed Anal, 2008, 46(3):477-490. |
| [33] | Zhang J, He Y, Cui M, et al. Metabolic studies on the total phenolic acids from the roots of Salvia miltiorrhiza in rats [J]. Biomed Chromatogr, 2005, 19:51-59. |
| [34] | 万仁忠, 许妍妍, 谷 元, 等. 丹酚酸B及其活性代谢产物在大鼠体内药动学研究 [J]. 中草药, 2011, 42(2):335-339. |
| [35] | Xu M, Guo H, Han J, et al. Structural characterization of metabolites of salvianolic acid B from Salvia miltiorrhiza in normal and antibiotic-treated rats by liquid chromatography-mass spectrometry [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 858(1/2):184-198. |
| [36] | Hao H, Wang G, Li P, et al. Simultaneous quantification of cryptotanshinone and its active metabolite tanshinone IIA in plasma by liquid chromatography/tandem mass spectrometry (LC-MS/MS) [J]. J Pharm Biomed Anal, 2006, 40(2):382-388. |
| [37] | Li J, Wang G, Li P, et al. Simultaneous determination of tanshinone IIA and cryptotanshinone in rat plasma by liquid chromatography-electrospray ionisation-mass spectrometry [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2005, 826(1/2):26-30. |
| [38] | Sun J H, Yang M, Wang X M, et al. Identification of tanshinones and their metabolites in rat bile after oral administration of TTE-50, a standardized extract of Salvia miltiorrhiza by HPLC-ESI-DAD-MSn [J]. J Pharm Biomed Anal, 2007, 44(2):564-574. |
| [39] | Park E J, Ji H Y, Kim N J, et al. Simultaneous determination of tanshinone I, dihydrotanshinone I, tanshinone IIA and cryptotanshinone in rat plasma by liquid chromatography-tandem mass spectrometry:application to a pharmacokinetic study of a standardized fraction of Salvia miltiorrhiza, PF2401-SF [J]. Biomed Chromatogr, 2008, 22(5):548-555. |
| [40] | Sun J, Zhang L, Song J, et al. Pharmacokinetic study of salvianolic acid A in beagle dog after oral administration by a liquid chromatography-mass spectrometry method:A study on bioavailability and dose proportionality [J]. J Ethnopharmacol, 2013, 148(2):617-623. |
| [41] | Cui L, Chan W, Wu J L, et al. High performance liquid chromatography-mass spectrometry analysis for rat metabolism and pharmacokinetic studies of lithospermic acid B from danshen [J]. Talanta, 2008, 75(4):1002-1007. |
| [42] | 裴渭静, 赵新锋, 胡 震, 等. 采用柱切换色谱-离子阱质谱联用法研究复方丹参滴丸中丹参素及其代谢产物 [J]. 分析化学, 2005, 33(4):505-508. |
| [43] | 盖芸芸, 沙春洁, 刘万卉. 液相色谱-串联质谱法测定血浆中丹参素浓度 [J]. 烟台大学学报, 2008, 21(1):35-39. |
| [44] | 张群正, 李仲瑾, 王世祥, 等. HPLC-MS法测定兔血浆和组织中丹参素异丙酯的含量 [J]. 西安交通大学学报, 2009, 30(5):635-638. |
| [45] | 丁建刚, 高允生, 刘江林, 等. HPLC-MS/MS法测定比格犬血浆中丹参酮ⅡA的含量 [J]. 药物分析杂志, 2009, 29(5):769-772. |
| [46] | 林 力, 刘建勋, 张 颖, 等. LC-MS/MS法同时测定犬血浆中丹酚酸A、丹酚酸B、紫草酸和迷迭香酸及其在丹参提取物的药代动力学研究应用 [J]. 世界科学技术—中医药现代化, 2012, 14(3):1567-1571. |
| [47] | Li X, Yu C, Cai Y, et al. Simultaneous determination of six phenolic constituents of danshen in human serum using liquid chromatography/tandem mass spectrometry [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2005, 820(1):41-47. |
| [48] | Liu Y, Li X, Li Y, et al. Simultaneous determination of danshensu, rosmarinic acid, cryptotanshinone, tanshinone IIA, tanshinone I and dihydrotanshinone I by liquid chromatographic-mass spectrometry and the application to pharmacokinetics in rats [J]. J Pharm Biomed Anal, 2010, 53(3):698-704. |
| [49] | Lu T, Yang J, Gao X, et al. Plasma and urinary tanshinol from Salvia miltiorrhiza (Danshen) can be used as pharmacokinetic markers for Cardiotonic Pills, a cardiovascular herbal medicine [J]. Drug Metab Dispos, 2008, 36(8):1578-1586. |
| [50] | Liu H, Yang J, Du F, et al. Absorption and disposition of ginsenosides after oral administration of Panax notoginseng extract to rats [J]. Drug Metab Dispos, 2009, 37(12):2290-2298. |
| [51] | Li X, Yu C, Lu Y, et al. Pharmacokinetics, tissue distribution, metabolism, and excretion of depside salts from Salvia miltiorrhiza in rats [J]. Drug Metab Dispos, 2007, 35(2):234-239. |
| [52] | Geng J L, Dai Y, Yao Z H, et al. Metabolites profile of Xian-Ling-Gu-Bao capsule, a traditional Chinese medicine prescription, in rats by ultra performance liquid chromatography coupled with quadrupole time-of-flight tandemmass spectrometry analysis [J]. J Pharm Biomed Anal, 2014, 96:90-103. |
| [53] | Qiao X, Han J, Xu M, et al. Metabolic profiling of Guan Xin II prescription based on metabolic fingerprinting and chemical analysis [J]. J Pharm Biomed Anal, 2011, 25, 54(4):789-798. |
| [54] | Yang T, Shen D P, Wang Q L, et al. Investigation of the absorbed and metabolized components of Danshen from FuzhengHuayu recipe and study on the anti-hepatic fibrosis effects of these components [J]. J Ethnopharmacol, 2013, 148(2):691-700. |
| [55] | 姜 璇, 金 艺, 袁 波, 等. 复方丹参滴丸的体内代谢产物分析 [J]. 沈阳药科大学学报, 2012, 29(2):126-131. |
| [56] | 郑晓晖, 王世祥, 赵新锋, 等. 复方丹参滴丸人含药血清中丹参相关代谢产物的分析 [J]. 第四军医大学学报, 2007, 28(5):435-437. |
| [57] | Xu Y, Huang K, Pan Y, et al. A rapid UFLC-MS/MS method for simultaneous determination of formononetin, cryptotanshinone, tanshinone IIA and emodin in rat plasma and its application to a pharmacokinetic study of Bu Shen Huo Xue formula [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2013, 932:92-99. |
| [58] | 游 燕, 张启云, 郑 琴, 等. 丹参和三七多种有效成分在大鼠体内的药物动力学研究 [J]. 中药新药与临床药理, 2010, 21(6):614-618. |
| [59] | 杨 荣, 卫引茂, 李 霞, 等. LC-MS/MS法研究活血化瘀方中丹参素在兔体内的组织分布 [J]. 中国药科大学学报, 2008, 39(2):155-158. |
| [60] | Yang S, Zhang K, Lin X, et al. Pharmacokinetic comparisons of single herb extract of Fufang Danshen preparation with different combinations of its constituent herbs in rats [J]. J Pharm Biomed Anal, 2012, 67/68:77-85. |
 2014, Vol. 45
2014, Vol. 45


