《中国药典》2010年版一部收载的成方制剂和单味制剂中,有641个方剂经过提取,其中以水为溶剂提取的就有524个,占提取工艺的绝大部分[1]。可见,水提取工艺是当今中成药产业化的主流提取方式,具有经济、安全、极性大等特点。提取工艺是中药制剂的关键步骤,有效成分转移率的高低关系到药物能否实现预期疗效。而目前中成药生产中所采用的水提取工艺(图 1),则普遍存在有效成分转移率低的问题。在浸泡过程中,浸泡不完全或含油量多的药材影响溶剂的浸润与渗透。在煎煮过程中,溶解度小的有效成分不易被水解吸、溶解;相对分子质量大的有效成分又不易扩散出胞外;大分子等共存物也影响着水与有效成分间的置换。
 | 图 1 水提取的一般工艺流程Fig. 1 General technological process of water extraction |
提取过程是指溶剂进入药材细胞组织,溶解其有效成分后变成浸出液的过程。实质是有效成分从固体向液体转移的传质过程。提取过程可分为4个阶段:浸润与渗透阶段、解吸和溶解阶段、扩散阶段、置换阶段。各阶段相互联系,其中任何一个阶段受阻碍或是限制,都将导致有效成分转移率降低,并将直接影响中成药的疗效。本文以水提取的4个阶段为主线,分析中药水提取工艺中有效成分转移率低的问题。
1 浸润与渗透阶段提取必须经过浸润、渗透阶段。溶剂加入到药材中,首先附着于药材表面使之润湿,然后通过毛细管和细胞间隙渗入细胞内。这种润湿作用对浸出影响极大,如药材不能被浸出溶剂润湿,浸出则无法进行。药材的润湿效果可以借用以下杨氏润湿方程加以解释:
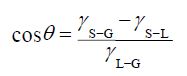
γS-G表示固-液界面张力,γS-L表示固体表面张力,γL-G表示液体表面张力。从接触角(θ)的数值可看出液体对固体润湿的程度:θ≤180°时可发生沾湿润湿;当θ≤90°时可发生浸湿润湿;当θ≈0时才能发生铺展润湿。由方程可知,液体表面张力越小越易被润湿。纯水的表面张力为72.7 mN/m(293.15 K),醋酸乙酯为24.0 mN/m,甲醇为23.1 mN/m,而乙醇仅为22.4 mN/m[2, 3]。所以,以水作为提取溶剂,其润湿效果较乙醇等其他有机溶剂差。
浸润的难易还取决于溶剂与药材之间液固界面情况,浸出溶剂与药粉间的界面张力愈大,药材愈不易被润湿。如药材含蛋白质、淀粉、纤维素等极性成分,水就容易浸润,进而通过毛细管及细胞间隙渗透进入药材细胞内。反之,如药材富含油脂,直接以水作为溶剂则无法充分浸润药材,有效成分的提取也就无法顺利进行。火麻仁含油量35.5%、郁李仁58.3%~74.2%、柏子仁36.1%~47.6%、桃仁37.6%、紫苏子约45%,沙苑子、海金沙等种子类药材含油率一般在35%~60%[4, 5]。例如,《中国药典》2010年版中就有中风回春丸等15个含有桃仁药材的水提取方剂,这使得水浸润、渗透困难,药材有效成分不易提取,转移率不高。此外,中药所含高分子物质,遇沸水后易形成胶体,亦不利于有效成分渗出。如某些含淀粉、蛋白质较多的药材若不浸泡,立即煎煮,就会因淀粉糊化、蛋白质变性凝固而包在药材表面,形成一个“屏障层”,堵塞了药材表面的毛细孔道,使其有效成分向外的扩散能力大大减小。茯苓块按常规方法煎煮后,外糊内干,有效成分没有完全溶出。黄河等[6]经实验表明,茯苓水溶性煎出物随浸泡时间的延长而增多,浸泡1.5 h后再按常规方法煎煮浸出物量达到最高。
2 解吸和溶解阶段药材细胞内有效成分被其他成分及组织所吸附,若渗透进入药材细胞内的溶剂与有效成分亲和力更大时,能够有效地将其溶解、解吸并转移至溶剂中。以水作为提取溶剂时,只有溶解度高的大极性成分才能溶出。而现代药理研究表明,许多溶解度较小的弱极性成分也具有一定功效,因此简单的水提取无法使药尽其效。
在《中国药典》2010年版一部成方制剂和单味制剂中,以水作为溶剂提取含有小檗碱的成方制剂至少有37个,常用药黄柏、黄连、三颗针、功劳木等中都含有小檗碱。现代药理学研究表明,小檗碱具有抑菌[7, 8]、抗炎、抗过敏[9, 10]等作用,即中医上认为的“清热解毒”功效,小檗碱转移率的高低将直接影响整个方剂的疗效。然而小檗碱作为一种半极性化合物,在冷水中的溶解度为0.05 mg/mL[11]。雷杨等[12]考察了不同体积分数的乙醇及水对黄连中小檗碱转移率的影响,结果表明水提取转移率最低,仅为16.7%,以80%乙醇为提取溶剂,转移率可达72.2%。以水作为提取溶剂,在置冷至室温后,一部分小檗碱就会析出而被滤除,导致转移率偏低。
在《中国药典》2010年版一部成方制剂和单味制剂中,丹参以水作为提取溶剂的就有48个方,其功效多为活血化瘀、滋补肝肾、行气止痛。现代研究表明,丹参中的丹参酮IIA具有脑缺血神经保护[13]、预防肝损伤[14]等药理作用,与方剂的功效密切相关。然而丹参酮IIA在水中的溶解度仅为2.8 μg/mL[15],谢凯[16]考察了溶剂对丹参酮IIA提取转移率的影响,结果随含醇量增加,转移率呈递增趋势。水提取液几乎不含目标成分,而30%乙醇转移率仅为4.7%,95%乙醇转移率可达96.06%。表 1列举了《中国药典》2010年版一部水提取方剂中影响复方功效的有效成分的溶解度与转移率之间的关系。
| 表 1 《中国药典》水提取方剂中影响复方功效的弱极性有效成分 Table 1 Low polar active components in water extract prescriptions from Chinese materia medica recorded in Chinese Pharmacopoeia |
溶剂溶解有效成分后在细胞内形成高浓度,细胞内外出现浓度差,促进药物由细胞内向细胞外扩散,同时细胞外高浓度区药物也逐渐向低浓度区扩散,这一过程为扩散阶段。浸出成分的扩散速度符合Fick’s第一扩散定律。
dM/dt=-DS (dC/dx),D=1/6πrη (RT/N)
dM/dt为扩散速度(即一定时间物质扩散的量);dt为扩散时间;S为扩散面积;D为扩散系数;dC/dx为浓度梯度;负号表示成分扩散方向与浓度梯度方向相反;R为气体克分子常数;T为绝对温度;N为阿伏伽德罗常数;r为扩散分子半径;η为黏度
上式说明药物的扩散速度与扩散系数、扩散面积、浓度梯度呈正比。扩散系数由药材本身性质决定,也受浸出条件影响,提高提取温度,降低介质黏度,药物的扩散系数加大,有利于提取。分子较小的扩散物质,扩散系数也较大,有利于扩散;反之,则会使扩散速度变慢,甚至无法扩散。
中药多糖相对分子质量大小各异,但大多数在1×104~5×105。这样的大分子必然难以扩散出胞外。此外,溶液的黏度随浓度的增大而升高,并且与多糖的相对分子质量有关,相对分子质量越大黏度越高。这也就进一步加大了扩散的难度。现代研究发现茯苓、黄芪、枸杞、柴胡、人参、灵芝等中药其生物活性成分之一是多糖,具有免疫调节、抗肿瘤、降血糖等功效[46, 47]。除此之外,随着国内外研究的进一步深入,一些蛋白质、维生素、鞣质等之前被认为是杂质的大分子,也逐渐显现出其功效而备受关注[48, 49, 50]。《中国药典》2010年版一部水提取方剂中与功效相关的大分子有效成分见表 2。
| 表 2 《中国药典》水提取方剂中与功效相关的大分子有效成分 Table 2 Macromolecular active components in water extract prescriptions recorded in China Pharmacopoeia |
黄芪多糖是黄芪的主要活性成分之一,具有增强血细胞活性[73]、保护心肌[72]等作用,发挥益气养血、宁心安神之功效。黄芪多糖相对分子质量约8×105,要透过细胞壁被溶剂提取就比较困难。贺义恒等[97]研究了黄芪多糖的提取工艺,结果表明,黄芪饮片水提取量仅为1.63%,碱水提取比纯水提取高2.69%,而经过粉碎的细颗粒其提取率则有更明显的提高。中药有机大分子的溶出需通过细胞壁和细胞膜的释放,碱溶液对植物细胞起到破壁作用,而超细粉碎则是利用超细切割技术将材料进行超细化处理,直接达到细胞级破碎效果后使有效成分直接暴露在溶剂中。
中药提取中,其有效成分的溶出需经过浸润、溶胀、渗透及扩散等过程。相对分子质量较大而难以穿透细胞生物膜是限制中药多糖、蛋白质等大分子有效成分提取转移率的主要原因。将药材进行适当粉碎能使有效成分溶出阻力减小,特别是大分子成分提取率的提高更为明显。
4 置换阶段
药材细胞内可溶性成分经脱吸附、溶解和胶溶后,形成较浓的溶液,使之具有较高的渗透压。由于渗透压的作用,细胞外面的溶剂不断进入细胞内(内渗透),而细胞内溶质则不断透过细胞膜向外扩散(外渗透)。
可知,置换的过程是细胞生物膜两侧的物质相互渗透、相互交换的过程。一些含大分子较多的药材,由于置换困难,不仅导致大分子物质扩散困难,也会阻碍小分子有效成分的溶出。以党参为例,党参含糖量一般为17%以上,部分品种甚至高达77%[98],在水提取的置换阶段,由于多糖等大分子的存在,使得党参中的一些其他有效成分也难以置换完全,结果表明党参皂苷水提取转移率仅有20%左右。
此外,在置换过程中浓度差作为渗透和扩散的推动力,使得胞内物质与溶剂相互置换直至整个浸出体系中浓度相等而达到平衡。因此,在整个浸出过程中,加水倍量在药物提取中的影响不容忽视。溶液量过少,浓度梯度过低,有效成分转移率自然就低;反之,则浪费人力、物力,增加后续浓缩的工作量。然而,在《中国药典》2010年版一部成方制剂的水提取工艺中,极少处方规定加水倍量,这就使得药品生产企业各自为规,同一处方药物品种多、规格杂、疗效各异,各厂家间产品质量千差万别。
5 讨论 5.1 水提取有效成分转移率低的问题亟需解决中成药水提取有效成分转移率低的原因与整个提取过程息息相关。在浸润与渗透阶段,一方面是水的渗透性较差,另一方面是含油量较多,大分子量高的药材以水作为溶剂难以浸润;在解吸与溶解阶段,溶解度较小的非极性、中极性成分与水亲和力较小,难以溶解完全;在扩散过程中,一些中药大分子由于相对分子质量较大,难以穿透细胞屏障扩散至溶媒中,造成扩散困难;置换阶段是物质相互交换的过程,药材中大分子共存物也将影响其他物质在细胞生物膜两侧的交换。在上述水提取过程的4个阶段,任何一个阶段受到阻碍,都将直接影响最后的提取效果,导致有效成分的转移率降低。《中国药典》是国家监督管理药品质量的法定技术标准,对于中成药企业的产业化生产更是一个指南性的引导和规范。而在《中国药典》2010年版一部水提取的524个制剂中就有516个未注明浸泡工艺,523个未注明加水倍量,126个未注明提取时间,9个未注明提取次数。这就使得中成药生产无章可循,制药企业各自为章,中成药质量良莠不齐。
5.2 对古今中药水提取方式的思考中成药产业化生产的水提取物不同于传统汤剂。水煎饮片至今仍是中医临床最重要、最有效的用药方式。中药传统用的汤剂,多用中药饮片直火煎煮,且一般要求温服或热服,加热不仅可以增大部分有效成分的溶解度外,还可能与其他成分产生“助溶”现象,增加了一些水中溶解度小的、亲脂性强的成分的溶解。而现代工业水提取的中成药均经过静置阶段,静置冷却后,一些溶解度较小的有效成分析出后被滤除,其中又有相当一部分中成药经过醇沉步骤,导致又一部分有效成分被沉淀去除。这就导致有些中成药疗效不如原始汤剂,甚至无效。沿袭至今的传统汤剂有其价值所在,但也存在一些问题。古代由于溶媒的获得和提取设备的限制,大多数的汤剂不得不采用水煎煮的方法。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 宫寅慧. 含离子液体-醇-水体系密度粘度及表面张力的测定及关联 [D]. 北京:北京化工大学, 2012. |
| [3] | 张新菊, 程黎明, 黄瑞龙, 等. 渗透检测中渗透液的润湿现象与接触角 [J]. 无损检测, 2013,35(3):70-73. |
| [4] | 林金莺. 火麻仁蛋白水解及其抗氧化肽的研究 [D]. 广州:华南理工大学, 2010. |
| [5] | 彭小玉, 邓焕彩. 紫苏子化学成分初探 [J]. 江西医学院学报, 1997, 17(4):105-106. |
| [6] | 黄 河, 金玉琴. 不同茯苓饮片有效成分含量提取的研究 [J]. 中国药业, 2012, 21(22):89. |
| [7] | Yan D, Xiao X H, Jin C, et al. Microcalorimetric investigation of the effect of berberine alkaloids from Coptis chinensis Franch on Staphylococcus aureus growth [J]. Sci China Series B:Chem, 2008, 51(7):640-645. |
| [8] | Jin J L, Hua G Q, Meng Z, et al. Antibacterial mechanisms of berberine and reasons for little resistance of bacteria [J]. Chin Herb Med, 2011, 3(1):27-35. |
| [9] | Xu L H, Liu Y, He X H, et al. Inhibitory effects of berberine on the activation and cell cycle progression of human peripheral lymphocytes [J]. Cell Mole Immunol, 2005, 2(4):295-301. |
| [10] | Tang Q L, Lai M L, Zhong Y F, et al. Antinociceptive effect of berberine on visceral hypersensitivity in rats [J]. World J Gastroenterol, 2013, 4(28):4582-4589. |
| [11] | 马素英, 张疆莉, 尚校军, 等. 小檗碱β-环糊精包合物研究 [J]. 中国新药与临床杂志, 2010, 29(10):754-757. |
| [12] | 雷 杨, 夏新华, 陈 希. 正交设计优选胃康片醇提工艺 [J]. 中国实验方剂学杂志, 2010, 16(15):28-30. |
| [13] | 何丽娜, 何素冰, 杨 军, 等, 丹参酮对原代大鼠神经细胞缺血性损伤的保护作用 [J]. 中国药理学通报, 2001, 17(2):214-217. |
| [14] | 续洁馄, 栗原博, 郑洁静, 等, 丹参酮类化合物对小鼠应激性肝损伤的保护作用 [J]. 药学学报, 2000, 41(7):631-635. |
| [15] | 何 丹, 杨 林, 范 琦. 丹参酮IIA固体分散体的制备及溶出度考察 [J]. 中国医院药学杂志, 2009, 29(8):649-651. |
| [16] | 谢 凯. 丹参药效部位提取及其缓释制剂中释药模式研究 [D]. 广州:广东药学院, 2008. |
| [17] | 夏翠英, 李 勇, 程建明. 正交试验法制备大黄素包合物工艺优选研究 [J]. 现代中药研究与实践, 2004, 18(3):51-53. |
| [18] | 杨金华, 王登斌, 陈小明. 首乌藤中大黄素的提取工艺研究 [J]. 中草药, 2011, 42(10):2017-2019. |
| [19] | Hei Z Q, Huan H Q, Tan H M, et al. Emodin inhibits dietary induced atherosclerosis by antioxidation and regulation of the sphingomyelin pathway in rabbits [J]. Chin Med J, 2006, 119(10):868-870. |
| [20] | Wang X J, Yang J, Cang H, et al. Gene expression alteration during redox-dependent enhancement of arsenic cytotoxicity by emodin in HeLa cells [J]. Cell Res, 2005, 15(7):511-522. |
| [21] | 杨学东, 伍 勋, 胡立翠, 等. 不同溶剂对川芎药材中有效成分提取效果的影响 [J]. 中国中药杂志, 2012, 37(13):1942-1945. |
| [22] | 李家明, 赵永海, 马逢时, 等. 川芎嗪芳酸衍生物的合成及抗血小板聚集活性 [J]. 有机化学, 2008, 28(9):1578-1583. |
| [23] | Qin F, Huang X. Guanxin II for the Management of coronary heart disease [J]. Chin J Intear Med, 2009, 15(6):472-476. |
| [24] | 罗晨曦. 川芎嗪对肝癌前病变发展不同阶段大鼠的影响和体内药动学研究 [D]. 北京:北京中医药大学, 2013. |
| [25] | 周秋娜, 尉小慧, 王峥涛. 黄芩素-羟丙基-γ-环糊精包合物制备工艺研究 [J]. 上海中医药杂志, 2013, 47(8):82-85. |
| [26] | 李 凤, 王文全, 游佩进, 等. 黄芩中黄酮类成分提取工艺研究进展 [J]. 中国现代中药, 2010, 12(7):5-8. |
| [27] | He H Q, Liu B, Zhang X Y, et al. Development of a high-throughput assay for the HIV-1 integrase disintegration reaction [J]. Sci China, 2010, 53(2):241-247. |
| [28] | Li Z F, Xia X M, Huang C, et al. Emodin and baicalein inhibit pancreatic stromal derived factor-1 expression in rats with acute pancreatitis [J]. Hepatob Pancreat Dis Int, 2009, 2(8):201-208. |
| [29] | Xu X M, Yuan G J, Deng J J, et al. Inhibition of 12-lipoxygenase reduces proliferation and induces apoptosis of hepatocellular carcinoma cells in vitro and in vivo [J]. Hepatob Pancreat Dis Int, 2012, 15(11):193-202. |
| [30] | 马玉坤, 冯 杨, 孔蓓蓓, 等. 微乳对槲皮素增溶作用的实验研究 [J]. 齐鲁药事, 2004, 9(3):46-48. |
| [31] | 何 勤, 徐雄良, 柯尊洪, 等. 正交试验法优选槐米中槲皮素的提取工艺 [J]. 中草药, 2003, 34(5):409-412. |
| [32] | Liu J J, Li X, Yue Y, et al. The inhibitory effect of quercetin on IL-6 production by LPS-stimulated neutrophils [J]. Cell Mole Immunol, 2005, 2(6):455-460. |
| [33] | 周新妹, 姚 慧, 夏满莉, 等. 槲皮素与芦丁对离体大鼠主动脉环的舒张作用及机制 [J]. 浙江大学学报:医学版, 2006, 35(1):29-33. |
| [34] | 任 科, 张志荣, 鞠静红, 等. 穿心莲内酯-羟丙基-β-环糊精包合物的鉴定和热力学稳定性研究 [J]. 中草药, 2008, 39(4):518-521. |
| [35] | 赵玉江, 李 勇, 吴修红, 等. 不同提取方法对穿心莲内酯含量的影响 [J]. 黑龙江医药, 2006, 19(3):181-182. |
| [36] | 赵珍珍, 王 俊, 朱玮珉, 等. 穿心莲内酯对脓毒症小鼠的保护作用及机制探讨 [J]. 第二军医大学学报, 2013, 34(8):846-851. |
| [37] | 杜 红. 穿心莲内酯新型载药系统抗炎作用及其机制研究 [D]. 北京:北京中医药大学, 2005. |
| [38] | 程惠娟, 刘 江, 张 庚. 穿心莲内酯抗铜绿假单胞菌生物被膜及与阿奇霉素协同抗菌作用 [J]. 中国微生态学杂志, 2012, 24(2):120-123. |
| [39] | 李 伟, 文红梅, 崔小兵, 等. 白术健脾有效成分研究 [J]. 南京中医药大学学报, 2006, 22(6):366-367. |
| [40] | 张奕强, 许实波, 林永成. 白术内酯系列物的胃肠抑制作用 [J]. 中药材, 1999, 22(12):636-640. |
| [41] | 张 静, 张裕华, 姜荣平, 等. 维生素E对孕鼠及胎鼠脑组织受手机辐射影响的保护作用 [J]. 山东大学学报:医学版, 2011, 49(9):33-36. |
| [42] | 石礼锋. 不同剂量维生素E在早产儿贫血预防中的临床疗效观察 [D]. 济南:山东大学, 2012. |
| [43] | 张 林, 刘伏友, 彭佑铭, 等. 维生素E对顺铂所致的小鼠肾毒性的影响及其机制研究 [J]. 肿瘤药学, 2012, 2(5):343-346. |
| [44] | 王喜军, 李廷利, 孙 晖. 茵陈蒿汤及其血中移行成分6, 7-二甲氧基香豆素的肝保护作用 [J]. 中国药理学通报, 2004, 20(2):239-240. |
| [45] | 范 颖, 李 智, 迟天燕, 等. 滨蒿内酯对豚鼠哮喘模型的炎性介质抑制作用 [J]. 中国医科大学学报, 2006, 35(2):132-133. |
| [46] | 黄 灿, 王玉明, 赵 骏. 抗肿瘤活性茯苓多糖的提取、纯化与结构分析 [J]. 中草药, 2012, 43(11):2146-2149. |
| [47] | 张 磊, 杨 薇, 吴 瑕, 等. 不同分子量段黄芪多糖的肠道粘附及对肠道呼吸道防御素分泌的研究 [J]. 中药药理与临床, 2012, 28(1):80-83. |
| [48] | 徐 铌, 宋学军. B族维生素的镇痛和神经保护作用 [J]. 中国疼痛医学杂志, 2013, 19(10):609-613. |
| [49] | 马雪瑛, 林成仁, 刘志去, 等. 重组水蛭素抗凝和抗血栓形成作用的实验研究 [J]. 中国中医药科技, 2004, 11(1):33-35. |
| [50] | 关 月, 田 云, 杨志福, 等. 壳聚糖-鞣质复合膜的止血促愈合作用 [J]. 解放军药学学报, 2011, 27(2):110-112. |
| [51] | 王德伟, 刘金涛, 朱洪艳. 药物及饮食补充叶酸、B族维生素治疗心血管神经官能症的临床研究 [J]. 河北中医, 2010, 32(12):1906-1908. |
| [52] | 张囡囡, 刘 鹏, 赵丽娟, 等. 维生素B12对肝硬化贫血患者血液影响的临床研究 [J]. 胃肠病学和肝病学杂志, 2009, 18(4):322-323. |
| [53] | 庞 飒. 超氧化物岐化酶的分离纯化与性质研究 [D]. 杭州:浙江大学, 2001. |
| [54] | 严令耕, 黄臣虎, 陆 茵. 水蛭素抗凝血和抗肿瘤转移的研究进展 [J]. 中药新药与临床药理, 2010, 21(6):667-670. |
| [55] | 胡 平, 吴耿伟, 夏 青, 等. SOD模拟及其抗氧化和抗炎症功能的研究进展 [J]. 化学进展, 2009, 21(5):873-879. |
| [56] | Gong P, Wang Z Y,Wang H J. Protective effects of pLNCX-SOD gene transfection on hepatocyte injury induced by obstructive jaundice in rats [J]. Hepatob Pancreat Dis Int, 2007, 6(2):194-198. |
| [57] | 石 磊, 李 娟, 徐 琪, 等. 应用基质辅助激光解吸质谱快速分析重组水蛭素产物的纯度与分子量 [J]. 分析化学, 2002, 30(5):608-610. |
| [58] | 李淑莉, 宋志前, 刘振丽. 超滤膜截留分子量对金银花单味药超滤效果的影响及与醇沉法的比较 [J]. 中药材, 2005, 28(10):86-88. |
| [59] | 卢文彪, 张倍恩, 王 静, 等. 番石榴叶止泻作用有效部位的筛选 [J]. 中药材, 2010, 33(5):732-735. |
| [60] | 郭晓萍, 尹 苗, 陈希文, 等. 石榴皮鞣质的提取及体外抑菌活性 [J]. 江苏农业科学, 2011, 39(3):403-405. |
| [61] | 李 丰, 杨欣秀, 胡维国, 等. 栝楼籽中一种新的具有蛋白质生物合成抑制活性的多肽--TrichokirinS1的分离、纯化和性质 [J]. 生物化学与生物物理学报, 2003, 35(9):841-846. |
| [62] | 黄益玲, 黄利鸣, 胡火军, 等. 天花粉蛋白对宫颈癌HeLa细胞凋亡及bax、bcl-2基因表达的影响 [J]. 肿瘤防治研究, 2007, 34(7):483-485. |
| [63] | 王媛媛, 欧阳东云, 郑永唐. 天花粉蛋白体外抗人白血病和淋巴瘤细胞的作用机制 [J]. 中国实验血液学杂志, 2007, 15(4):729-732. |
| [64] | 杨新科, 陈章良, 段淑敏, 等. 天花粉蛋白在组织培养上抗病毒作用的研究 [J]. 病毒学报, 1990, 6(3):219-223. |
| [65] | 孟丽莉. 人参及鹿茸蛋白的分离纯化 [D]. 延吉:延边大学, 2008. |
| [66] | 李红艳, 曹 阳, 白雪媛, 等. 人参蛋白对β淀粉样蛋白(1-40)和H2O2损伤神经元的保护作用及其机制 [J]. 吉林大学学报:医学版, 2013, 39(6):1138-1142. |
| [67] | 徐云凤, 赵 雨, 邢楠楠, 等. 人参蛋白对小鼠抗疲劳作用的研究 [J]. 食品工业科技, 2011, 32 (11):406-407. |
| [68] | 徐云凤, 赵 雨, 张 惠, 等. 人参蛋白对小鼠的耐缺氧及抗氧化作用 [J]. 食品科技, 2012, 37(3):79-82. |
| [69] | 严铭铭. 人参鹿茸中蛋白多肽的纯化及活性研究 [D]. 长春:长春中医药大学, 2007. |
| [70] | 严铭铭, 曲晓波, 钟英杰, 等. 梅花鹿鹿茸中促进海马神经细胞增殖蛋白的分离纯化 [J]. 中草药, 2007, 38(8):1163-1167. |
| [71] | 李立军, 路来金, 陈 雷, 等. 鹿茸多肽促进大鼠坐骨神经再生的实验研究 [J]. 辽宁中医杂志, 2004, 31(4):343-344. |
| [72] | 周振华, 王洪新, 赵素玲, 等. 黄芪多糖对脂多糖诱导大鼠心肌细胞肥大的保护作用 [J]. 中草药, 2012, 43(3):524-528. |
| [73] | 张竞之, 陈利国, 贾会欣, 等. 黄芪多糖对高血压病血瘀证患者血清损伤的人脐静脉内皮细胞形态学、活性的影响 [J]. 中国实验方剂学杂志, 2010, 16(16):170-173. |
| [74] | 颜 玲, 黄德斌. 黄芪多糖对缺血脑损伤大鼠海马神经递质及c-fos mRNA表达的影响 [J]. 中国病理生理杂志, 2012, 28(2):263-268. |
| [75] | 袁振林. 枸杞多糖的提取及含量和分子量分布的测定 [J]. 广东化工, 2003(3):43-45. |
| [76] | 古 赛, 蒋小黎. 枸杞多糖治疗酒精性脂肪肝大鼠的实验研究 [J]. 重庆医学, 2007, 36(1):60-62. |
| [77] | 张鸣号, 王秀玉, 王秀梅, 等. 枸杞多糖对小鼠移植性肝癌抑制作用的实验研究 [J]. 中草药, 2012, 43(6):1142-1146. |
| [78] | Tian X M, Wang R, Zhang B K, et al. Impact of Lycium barbarum polysaccharide and danshensu on vascular endothelial growth factor in the process of retinal neovascularization of rabbit [J]. Int J Ophthalmol, 2013, 6(1):59-61. |
| [79] | 赵世华, 姚文兵, 庞秀炳, 等. 灵芝多糖分离鉴定及抗肿瘤活性的研究 [J]. 中国生化药物杂志, 2003, 24(4):173-176. |
| [80] | Zhao S, Zhang S C, Wang S Q. Ganoderma lucidum spore powder modulates Bcl-2 and Bax expression in the hippocampus and cerebral cortex, and improves learning and memory in pentylenetetrazole-kindled rats [J]. Neural Regen Res, 2011, 6(30):2347-2351. |
| [81] | Zhao S, Wang S Q, Zhang S C, et al. Effects of Ganoderma lucidum spore powder on astrocyte expression and glutamine synthetase activity in the hippocampal region of epileptic rats [J]. Neural Regenn Res, 2008, 3(12):1304-1307. |
| [82] | Zhang G L, Wang Y H, Ni W, et al. Hepatoprotective role of ganoderma lucidum polysaccharide against BCG-induced immune liver injury in mice [J]. World J Gastroenterol, 2002, 8(4):728-733. |
| [83] | 杨春霞. 一种酸性党参多糖CPP1b的结构分析及抗肿瘤活性研究 [D]. 兰州:兰州大学, 2013. |
| [84] | 赵玉萍, 贾建波. 中药多糖对鼠李糖乳杆菌性质的影响 [J]. 食品科技, 2005, 3(8):13-15. |
| [85] | 赵世清, 温 鹏, 李茹柳, 等. 党参、甘草皂苷和黄酮部位对IEC-6细胞迁移的影响 [J]. 中药药理与临床, 2012, 28(2):79-82. |
| [86] | 颜 军, 刘 嵬, 邬晓勇, 等. 柴胡多糖的分子量测定及单糖组成分析 [J]. 安徽农业科学, 2010, 38(9):4550-4552. |
| [87] | 王 蕾, 周四元, 梅其炳. 多糖治疗胃溃疡的研究进展 [J]. 中成药, 2003, 25(8):52-53. |
| [88] | 林 波, 章蕴毅, 徐 晗, 等. 柴胡总多糖对急性肺损伤大鼠的抗氧化作用 [J]. 中国临床药学杂志, 2010, 19(1):6-10. |
| [89] | 刘 娟, 彭仁琇, 乐 江, 等. 当归多糖的分离纯化及其部分理化性质的研究 [J]. 华西药学杂志, 2004, 19(6):412-414. |
| [90] | Liu S P, Dong W G, Luo H S, et al. Protective effect of angelica sinensis polysaccharide on experimental immunological colon injury in rats [J]. World J Gastroenterol, 2003, 9(12):2786-2790. |
| [91] | Wang P P, Zhang Y, Dai L Q, et al. Effect of Angelica sinensis polysaccharide-lron complex on iron deficiency anemia in rats [J]. Chin J Integr Med, 2007, 13 (4):297-300. |
| [92] | 李德耀. 淫羊藿多糖的分离纯化结构分析和免疫活性研究 [D]. 郑州:郑州大学, 2005. |
| [93] | 贺 今, 王秀英, 李晓东. 淫羊藿多糖对苯中毒致再生障碍性贫血免疫治疗进展 [J]. 预防医学论坛, 2012, 18(9):686-687. |
| [94] | 李 超. Fe3O4/PSF磁性超滤膜分离麦冬多糖的研究 [D]. 合肥:合肥工业大学, 2010. |
| [95] | 徐德生, 冯 怡, 周跃华, 等. 麦冬多糖中抗急性心肌缺血活性部位研究 [J]. 中成药, 2004, 26(10):60-65. |
| [96] | 许燕萍, 陈 琪. 麦冬多糖对大鼠脑缺血损伤的抗缺氧作用 [J]. 镇江医学院学报, 1996, 6(3):217-218. |
| [97] | 贺义恒, 张 红 夏, 赵 晔, 等. 恒山黄芪中黄芪多糖提取工艺研究 [J]. 中国中医药信息杂志, 2013, 20(3):52-54. |
| [98] | 蒋小飞, 张宝顺. 党参总皂苷的提取、分离和纯化 [J]. 安徽农业科学, 2011, 39(4):2061-2063. |
 2014, Vol. 45
2014, Vol. 45


