2. 天士力研究院药理毒理研究所, 天津 300410
2. Tasly R&D Institute, Tianjin Tasly Group Co., Ltd., Tianjin 300410, China
强心苷(cardiac glycosides)是一类具有强心作用的甾体苷类化合物,临床上主要用于治疗慢性心力衰竭及某些心律失常,在抗肿瘤方面也有一定疗效[1, 2, 3]。自1785年Withering使用洋地黄叶治疗水肿,现在已从十几个科一百多种植物中发现强心苷类化合物,越来越多来自于植物及半合成的新型强心苷被广泛使用。常见强心苷类药物结构见图 1。
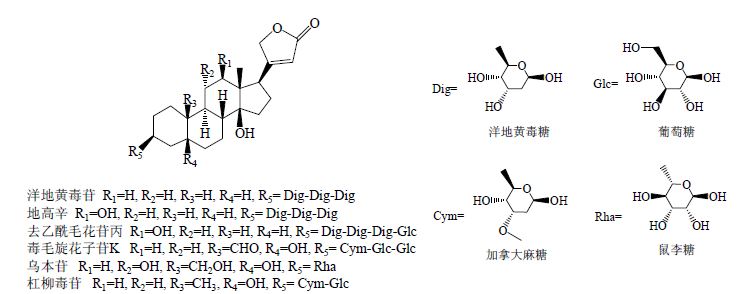 | 图 1 常见强心苷类化合物结构Fig. 1 Chemical structures of common cardiac glycosides |
强心苷类药物疗效显著,但治疗安全范围狭窄,作用机制复杂,可能出现蓄积现象,给临床用药带来风险。目前已有文献对杠柳毒苷和地高辛的药动学研究现状进行概述,本文拟从该类药物的化学结构入手,通过系统归纳药动学特点及代谢途径,分析并讨论不同结构对药动学行为产生的影响,为现有药物的安全使用及新药开发提供一定的参考依据。
1 吸收洋地黄毒苷吸收不规则且局部刺激性很强,多口服给药,吸收稳定完全,生物利用度较高。地高辛生物利用度较洋地黄毒苷低,个体差异显著,不同片剂产品的吸收率差异更大,这与片剂中原料药颗粒大小有关。《中国药典》2010年版规定地高辛片剂1 h的溶出度不得低于65%[4]。Hu等[5]通过将地高辛制成固体脂质纳米粒,显著提高了地高辛的生物利用度。地高辛是P-糖蛋白(P-gp)的底物,会受到P-gp抑制剂的影响使其血药浓度改变,对联合用药产生影响。目前已有较多体外实验针对P-gp抑制剂(如利福平、大环内酯类抗生素、奎尼丁等)对地高辛及其代谢物肠道吸收的影响进行了研究。结果表明,利福平、阿奇霉素和奎尼丁能明显增强地高辛的肠道吸收;红霉素对地高辛的吸收无影响,但能减少二氢地高辛和地高辛糖苷的外排;克拉霉素和罗红霉素几乎抑制了地高辛的外排[6, 7, 8, 9]。Chen等[10]发现地高辛与P-gp底物来那度胺合用对地高辛的药动学特性无显著影响。Pauli-Magnus等[11]还证实了洋地黄毒苷、α-甲基地高辛、β-乙酰基地高辛和乌本苷也是P-gp底物,与P-gp抑制剂合用会造成其血药浓度的增加,临床用药需引起注意。
杠柳毒苷是中药香加皮的主要效应成分,其药理效应与香加皮的功效密切相关,但同时也是香加皮中的有毒成分,其生物利用度很低。Yi等[12]发现杠柳毒苷ig给药后,血浆中未能检测到。Liang等[13]推测P-gp的外排作用是造成杠柳毒苷生物利用度较低的因素之一。马志会等[14]在实验中发现,杠柳毒苷的代谢物杠柳苷元在给药后的血药浓度出现2个高峰,提示杠柳苷元存在肝肠循环。体外吸收实验得出,杠柳毒苷几乎完全在小肠内吸收,且不同浓度药物对小肠吸收无影响,得出小肠吸收为被动扩散过程[15, 16]。
2 分布强心苷类药物进入血液后可与血浆蛋白发生可逆性结合而分布全身。洋地黄毒苷可结合较多血浆蛋白但不牢固,在组织中分布广泛且迅速,尤其在肝、胆、肠分布较多,该现象与肝肠循环过程密切相关。地高辛结合较少,主要以原型药物形式分布于各组织中。Kalman等[17]以iv同位素标记的地高辛的方法,研究了地高辛在犬体内的组织分布和消除。在单剂量给药24 h后,肾组织浓度最高,其次为心、肾上腺、肝、胰、肺、脾、骨骼肌,在脑组织中也可检测到地高辛。通过分析洋地黄毒苷和地高辛的化学结构可以看出,二者结构非常相似,地高辛仅比洋地黄毒苷在甾核的C-12位碳原子上多1个羟基,由此导致地高辛的极性强于洋地黄毒苷,在吸收和分布情况上也就产生了很大差异。洋地黄毒苷脂溶性强,易从胃肠道吸收,形成肝肠循环过程,主要以代谢物的形式分布于各组织中,并偏向于分布在胃、肠、肝、胆等组织中;而地高辛水溶性强,不易通过胃肠道吸收,较少形成肝肠循环,主要以原型药物形式分布于各组织中,地高辛在脑中的极少分布也与其低脂溶性、难于通过血脑屏障有关。大鼠iv杠柳毒苷后也未能在脑中检测到杠柳毒苷,这也验证了其较强的极性[18, 19]。对于其他强心苷类药物如乌本苷、毒毛旋花子苷K和去乙酰毛花苷丙的组织分布情况暂无报道,经结构分析得出其极性均较强,推测其也主要以原型分布于各组织中,并极少分布于脑中。
3 代谢洋地黄毒苷的体内代谢研究较早,研究对象多针对特殊人群。研究表明,洋地黄毒苷在人体内的主要代谢产物为洋地黄毒苷元双洋地黄毒糖苷、洋地黄毒苷元单洋地黄毒糖苷、洋地黄毒苷元、二氢洋地黄毒糖苷及地高辛。而在肾功能衰竭的病人体内的二氢洋地黄毒糖苷的浓度比健康受试者高[20]。洋地黄毒苷类药物易产生蓄积且消除缓慢,在体外代谢研究中可通过微生物代谢过程,对洋地黄毒苷类进行结构修饰达到减毒作用。根据这一思路,王丽娟等[21]对洋地黄毒苷在3种常用的微生物菌株中的生物转化情况进行了研究,结果表明,新月弯孢霉AS3.3589转化洋地黄毒苷得到2个产物,转化率分别为27%和5%;蓝色犁头霉CICC40302转化得到1个产物,转化率为6%;雷斯青霉ATCC10490不发生转化反应。Pádua等[22]在镰刀菌中共分离到3种洋地黄毒糖苷生物转化产物,并通过光谱手段明确了其结构,这3种产物分别是地高辛糖苷、digoxigenone和digitoxigenone。经过生物转化动力学推论得出,首先生成的产物是digitoxigenone,其次是具有极性的羟基化产物地高辛糖苷和digoxigenone,表明在地高辛糖苷C-12b位的羟基化和C-3位的氧化过程中有不同的酶参与。
地高辛在人体内一直认为是不经代谢、直接以原型排出,直到二氢地高辛和其水解产物的发现才推翻了这一错误认识。该类代谢物的结构中都含有一个饱和内酯环,与不饱和结构相比强心作用较弱[23]。Luchi等[24]在一个大量服用地高辛患者的尿液中首次发现了二氢地高辛糖苷。随后,Clark等[25]通过脂溶性提取尿液和血浆,发现了还原型强心苷类,即地高辛还原产物(DRP),包括二氢地高辛、二氢地高辛二糖苷、二氢地高辛单糖苷等。在此研究基础上,有大量研究者对DRP的可能影响因素做了推测和研究。Peters等[26]研究发现,DRP的形成与患者年龄、性别、服用剂量和地高辛的血药浓度均无关系,同时服用其他药物也不会影响DRP的产生量。Hinderling等[27]在实验中发现,健康受试者在iv给药后地高辛代谢产物生成较少,而po给药后能检测到大量代谢产物,如二氢地高辛、地高辛苷元双洋地黄毒糖苷和其他极性代谢物。综上,地高辛在体内的主要代谢产物为DRP,代谢产物主要经po给药生成,因此得出代谢产物的形成与肠道菌群作用相关。在体外实验中,Lacarelle等[28]探索了地高辛及其裂解化合物在人肝微粒体中的代谢转化过程及机制。研究表明,地高辛和地高辛苷元双洋地黄毒糖苷在体外实验中并未明显代谢,推断细胞色素P450(CYP450)酶在其糖苷裂解过程中起的作用较小。Gault等[29]发现胃酸分泌的增加,能使地高辛在胃内发生水解产生大量地高辛苷元,尿中的代谢物也增加。体外研究中发现,一些外源性物质也可改变地高辛的结构,使其转化为活性很低或无活性的形式[30, 31]。
王焱等[32]在研究杠柳毒苷在模拟人体消化道液中的稳定性时发现,杠柳毒苷在模拟胃液、小肠液、大肠液中稳定,而在模拟空腹胃液中不稳定(pH 1~3),可被水解为杠柳苷元,原因为在较强的酸性环境中糖苷键发生水解反应。任晓亮等[33]采用离体粪便温孵法测定不同时间的杠柳毒苷及其代谢产物的量,结果表明杠柳毒苷在人和大鼠的肠道菌群作用下,代谢迅速,均生成了杠柳次苷。在人体内杠柳次苷生成量大于大鼠,推测杠柳毒苷在人和大鼠体内代谢途径可能有差异。常见的强心苷类药物的I相代谢途径见图 2。
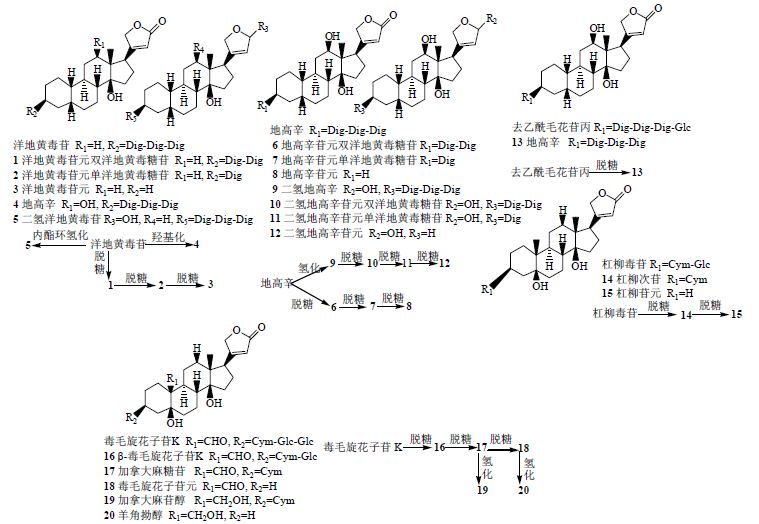 | 图 2 常见强心苷类药物的I相代谢途径Fig. 2 Phase I metabolic pathways of common cardiac glycosides |
强心苷类药物的I相代谢均经过逐级脱糖反应,部分还发生羟基化和内酯环氢化反应,经过脱糖及羟基化的代谢产物仍有活性,而氢化得到的代谢产物强心作用较弱或无强心作用,生成的I相代谢产物最终与葡萄糖醛酸或硫酸结合形成大极性的II相代谢产物排出体外。
4 排泄Nokhodian等[34]对肝硬化病人及健康志愿者iv和ig给予洋地黄毒苷后的排泄情况进行了研究。结果表明,不同给药途径的原型药物及代谢产物总清除率及肾清除率均无显著差异,而肝硬化病人的肾清除率明显低于健康志愿者。Lindenbaum等[35]在实验中发现,地高辛主要以原型排泄,其DRP的排泄量仅占总排泄量的5%。服用红霉素会影响排泄物形成,推测红霉素能抑制肠道菌群活性,造成排泄物中DRP量减少。Marzo等[36]以健康受试者和肾功能衰竭患者为受试对象,分别iv和im毒毛旋花子苷K,发现它们在肾功能衰竭患者的血浆半衰期高于健康受试者,而尿累积排泄量低于健康人受试者。Strobach等[37]将健康志愿者分别po和iv给予K- strophanthin-α、K-strophanthin-γ和G-strophanthin,iv给药后,它们的肾排泄量占总给药剂量的73%,其中70%以原型排泄,而30%以代谢产物排泄;po给药后,肾排泄量占总给药剂量的11%,其中仅6%以原型排泄,80%以代谢产物排泄(如β-毒毛旋花子苷K、加拿大麻糖苷、毒毛旋花子苷元、加拿大麻醇苷和羊角拗醇)。乌本苷iv给药后,总肾排泄量占给药剂量的33%,其中80%为原型,20%为代谢产物,但尚未探明代谢产物结构。王强等[38]对大鼠分别ig和iv给予杠柳毒苷,发现其主要以原型经胆汁排泄,从尿液和粪便排泄很少,尿液中可能存在结合代谢物,粪便中主要为肠菌代谢物。
5 结语强心苷类药物在治疗充血性心力衰竭及某些心律失常疾病方面有不可比拟的优势,在抗癌方面也卓有成效,日益成为国内医药界开发的重点。本文从吸收、分布、代谢、排泄4个角度对其体内处置过程进行了较系统的归纳与总结,如表 1所示。经分析表明化学结构的不同对其药动学行为影响较大。非极性化合物如洋地黄毒苷在吸收过程中会形成肝肠循环,作用持久,组织分布较广。地高辛及其他常见强心苷类药物在甾核骨架上有1个至多个羟基取代,极性较强,较少形成肝肠循环,作用时间较短,难分布于脑组织中。
| 表 1 强心苷类药物药动学特点 Table 1 Pharmacokinetic characteristics of cardiac glycosides |
然而,现有的研究也存在一些不足。部分强心苷类药物如杠柳毒苷和毒毛旋花子苷K口服吸收较差,后续研究应进一步探索其生物利用度较差的原因,并考虑通过化学修饰或剂型改造改善其体内吸收。此外,对于除洋地黄毒苷和地高辛外的其他强心苷类药物的代谢均只报道了脱糖或脱糖和内酯环氢化反应,而无羟基化反应的报道,应对其体内外代谢情况进行更为深入和细致的研究。相信随着药效药理研究的进步和分析手段的发展,强心苷类药物的体内过程将进一步明确,为临床安全用药和新药开发做出贡献。
| [1] | Prassas I, Diamandis E P. Novel therapeutic applications of cardiac glycosides [J]. Nat Rev Drug Discov, 2008, 7(11):926-935. |
| [2] | Lin J, Denmeade S, Carducci M A. HIF-1alpha and calcium signaling as targets for treatment of prostate cancer by cardiac glycosides [J]. Curr Cancer Drug Targets, 2009, 9(7):881-887. |
| [3] | Winnicka K, Bielawski K, Bielawska A, et al. Antiproliferative activity of derivatives of ouabain, digoxin and proscillaridin A in human MCF-7 and MDA-MB-231 breast cancer cells [J]. Biol Pharm Bull, 2008, 31(6):1131-1140. |
| [4] | 中国药典 [S]. 二部. 2010. |
| [5] | Hu L, Jia H, Luo Z, et al. Improvement of digoxin oral absorption in rabbits by incorporation into solid lipid nanoparticles [J]. Pharmazie, 2010, 65(2):110-113. |
| [6] | 李 高, 裘 军. 利福平对地高辛小肠吸收作用的影响 [J]. 同济医科大学学报, 2001, 30(4):321-323. |
| [7] | 于慧斌, 孙成春. 阿奇霉素对地高辛小肠吸收及其P-糖蛋白表达的影响 [J]. 中国医院药学杂志, 2010, 30(9):758-760. |
| [8] | Hughes J, Crowe A. Inhibition of P-glycoprotein-mediated efflux of digoxin and its metabolites by macrolide antibiotics [J]. J Pharmacol Sci, 2010, 113(4):315-324. |
| [9] | Igel S, Drescher S, Mürdter T, et al. Increased absorption of digoxin from the human jejunum due to inhibition of intestinal transporter-mediated efflux [J]. Clin Pharmacok, 2007, 46(9):777-785. |
| [10] | Chen N, Weiss D, Reyes J, et al. No clinically significant drug interactions between lenalidomide and P-glycoprotein substrates and inhibitors:results from controlled phase I studies in healthy volunteers [J]. Cancer Chemother Pharmacol, 2014, 73(5):1031-1039. |
| [11] | Pauli-Magnus C, Mürdter T, Godel A, et al. P-glycoprotein-mediated transport of digitoxin, α-methyldigoxin and β-acetyldigoxin [J]. Naunyn-Schmiedeberg's Arch Pharmacol, 2001, 363(3):337-343. |
| [12] | Yi L, Bi K, Chen X, et al. Determination and pharmacokinetics of periplocin in rat plasma by LC-MS [J]. Biomed Chromatogr, 2010, 24(10):1089-1093. |
| [13] | Liang S, Deng F, Xing H, et al. P-glycoprotein and organic anion-transporting polypeptide-mediated transport of periplocin may lead to drug-herb/drug-drug interactions [J]. Drug Des Devel Ther, 2014, 9(8):475-483. |
| [14] | 马志会, 张 静, 周 昆, 等. 香加皮最大耐受量给药小鼠体内杠柳毒苷及苷元的代谢 [J]. 中药新药与临床药理, 2010, 21(4):400-402. |
| [15] | Xie Y S, Ren X L, Pan G X, et al. The assessment of absorption of periplocin in situ via intestinal perfusion of rats by HPLC [J]. Biomed Chromatogr, 2008, 22(2):196-201. |
| [16] | 杨 颖, 戚爱棣, 潘桂湘. 杠柳毒苷在大鼠体肠吸收动力学研究 [J]. 齐鲁药事, 2009, 28(2):105-107. |
| [17] | Kalman S M, Gullner H G, Gibson T A, et al. A two-compartment model for digoxin disposition in dogs [J]. Arzneim Forsch, 1980, 30(6):943-945. |
| [18] | 高淑红, 谢跃生, 肖学凤, 等. 杠柳毒苷在大鼠体内的组织分布 [J]. 现代药物与临床, 2011, 26(2):116-118. |
| [19] | 周福军, 谢跃生, 肖学凤, 等. 杠柳毒苷在大鼠体内的药动学研究 [J]. 药物评价研究, 2011, 34(2):81-84. |
| [20] | Bodem G, Unruh E V. Enhanced transformation of digitoxin to dihydrodigitoxin in humans with renal failure [J]. J Clin Pharmacol, 1979, 19(4):195-199. |
| [21] | 王丽娟, 王 敏, 温 竹, 等. 三种真菌对洋地黄毒苷的生物转化特性研究 [J]. 天津科技大学学报, 2008, 23(3):8-12. |
| [22] | Pádua R M, Oliveira A B, Souza Filho J D, et al. Biotransformation of digitoxigenin by Fusarium ciliatum [J]. J Braz Chem Soc, 2005, 16(3B):614-619. |
| [23] | Brown B T, Stafford A, Wright S E. Chemical structure and pharmacological activity of some derivatives of digitoxigenin and digoxigenin [J]. Br J Pharmacol, 1962, 18(2):311-324. |
| [24] | Luchi R J, Gruber J W. Unusually large digitalis requirements:a study of altered digoxin metabolism [J]. Am J Med, 1968, 45(2):322-328. |
| [25] | Clark D R, Kalman S M. Dihydrodigoxin:a common metabolite of digoxin in man [J]. Drug Metab Dispos, 1974, 2(2):148-150. |
| [26] | Peters U, Falk L C, Kalman S M. Digoxin metabolism in patients [J]. Arch Intern Med, 1978, 138(7):1074-1076. |
| [27] | Hinderling P H, Hartmann D. Pharmacokinetics of digoxin and main metabolites/derivatives in healthy humans [J]. Ther Drug Monit, 1991, 13(5):381-401. |
| [28] | Lacarelle B, Rahmani R, Sousa G, et al. Metabolism of digoxin, digoxigenin digitoxosides and digoxigenin in human hepatocytes and liver microsomes [J]. Fundam Clin Pharmacol, 1991, 5(7):567-582. |
| [29] | Gault H, Kalra J, Ahmed M, et al. Influence of gastric pH on digoxin biotransformation. II. Extractable urinary metabolites [J]. Clin Pharmacol Ther, 1981, 29(2):181-190. |
| [30] | Robertson L W, Chandrasekaran A, Reuning R H, et al. Reduction of digoxin to 20R-dihydrodigoxin by cultures of Eubacterium lentum [J]. Appl Environ Microbiol, 1986, 51(6):1300-1303. |
| [31] | Frey W A, Vallee B L. Digitalis metabolism and human liver alcohol dehydrogenase [J]. Proc Natl Acad Sci, 1980, 77(2):924-927. |
| [32] | 王 焱, 任晓亮, 潘桂湘, 等. 杠柳毒苷在模拟消化液中的稳定性研究 [J]. 天津中医药大学学报, 2007, 26(2):74-76. |
| [33] | 任晓亮, 谢跃生, 潘桂湘, 等. 香加皮强心成分杠柳毒苷肠菌代谢研究 [J]. 天津中医药, 2007, 24(6):515-518. |
| [34] | Nokhodian A, Santos S, Kirch W. Digitoxin and its metabolites in patients with liver cirrhosis [J]. Eur J Drug Metab Pharmacokinet, 1993, 18(2):207-213. |
| [35] | Lindenbaum J, Tse-Eng D, Butler V P J, et al. Urinary excretion of reduced metabolites of digoxin [J]. Am J Med, 1981, 71(1):67-74. |
| [36] | Marzo A, Ghirardi P, Riva O, et al. Plasma turnover and excretion of K-strophanthoside-3H in human volunteers after parenteral administration [J]. Naunyn-Schmiedeberg's Arch Pharmacol, 1976, 294(2):115-120. |
| [37] | Strobach H, Wirth K E, Rojsathaporn K. Absorption, metabolism and elimination of strophanthus glycosides in man [J]. Naunyn-Schmiedeberg's Arch Pharmacol, 1986, 334(4):496-500. |
| [38] | 王 强, 任晓亮, 王 焱, 等. 杠柳毒苷在大鼠体内排泄的初步研究 [J]. 天津中医药大学学报, 2008, 27(1):29-32. |
| [39] | Smith T W. Pharmacokinetics, bioavailability and serum levels of cardiac glycosides [J]. J Am Coll Cardiol, 1985, 5(Suppl A):43-50. |
| [40] | 李国信, 陈颖萍, 田 原, 等. 八味健骨片中杠柳毒苷在人体内的药物动力学试验研究 [J]. 辽宁中医杂志, 2005, 32(6):595-597 |
| [41] | 阚红玉, 谢跃生, 王跃飞, 等. HPLC法测定小鼠血浆中杠柳毒苷的血药浓度 [J]. 中草药, 2008, 39(10):1493-1496. |
 2014, Vol. 45
2014, Vol. 45


