2. 中国热带农业科学院热带生物技术研究所, 农业部热带作物生物学与遗传资源利用重点实验室, 海南 海口 571101
2. Key Laboratory of Biology and Genetic Resources of Tropical Crops, Ministry of Agriculture, Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101, China
国产沉香为瑞香科植物白木香Aquilaria sinensis (Lour.) Gilg含有树脂的木材[1],主产于我国海南、广东等地,是我国传统的名贵药材[2, 3]。沉香具有行气止痛、温中止呕、纳气平喘功能,用于胸腹胀闷疼痛、胃寒呕吐呃逆、肾虚气逆喘急[4]。化学研究表明沉香中的特征性成分为2-(2-苯乙基) 色酮类化合物(41%)和倍半萜类化合物(52%)[5]。沉香药材中所含倍半萜类和色酮类化合物种类较多,各成分相对量较少。目前,除奇楠沉香被报道其化学成分中2-(4′-甲氧基-2-苯乙基) 色酮和2-(2-苯乙基) 色酮相对量之和达到37.03%以上[6],其他沉香药材中未见有相对量较高的共有成分报道。由于市面上的沉香药材质量良莠不齐,而且假冒伪劣、以次充好的情况时有发生,所以建立一套可靠的沉香真伪鉴定与质量评价的方法意义重大。据文献报道,主要通过GC-MS的方法来评价沉香质量[2, 5, 6, 7, 8, 9, 10, 11],鉴定的化合物主要是倍半萜以及芳香族类成分,近年来色酮类成分也得到了鉴定[2, 6, 10, 11],但一些极性较大不易挥发的成分特别是四氢色原酮类化合物尚未鉴定。而利用HPLC分析沉香样品的文献仅见少量报道[12, 13],如采用HPLC检测沉香中的2-(2-苯乙基) 色酮类和四氢色原酮类化合物[12],以及采用HPLC来测定沉香中化合物6-羟基-2-(4′-甲氧基-2-苯乙基) 色酮和6-羟基-2-(2-苯乙基) 色酮的量。HPLC指纹图谱是一种顺应中药多组分、多靶点,从“全成分”的角度出发的现代中药质量控制方法,现已成为国内外广泛接受的中药质量控制评价模型[14, 15, 16]。目前尚未有利用HPLC指纹图谱法对沉香药材进行真伪鉴定和质量评价的文献报道。本课题组从沉香药材分离鉴定了一系列2-(2-苯乙基) 色酮类化合物[17, 18, 19, 20, 21, 22],本实验在此基础上对10批沉香药材进行分析,建立乙醚提取物的HPLC指纹图谱,并进行相似度评价和聚类分析,以期为沉香的科学鉴定和质量标准提供参考依据。
1 材料Agilent 1260 Infinity高效液相色谱仪,配备G1311C四元泵、G1329B标准自动进样器、G1316A柱温箱、G1315D DAD检测器(Agilent公司,美国);Sartorius BP221S电子天平(塞多利斯公司,德国);BRANSONIC—5510E—DTH超声波清洗仪(Branson,美国)。
乙腈(色谱纯,Tedia公司),甲醇(色谱纯,Tedia公司),甲酸(分析纯),超纯水。所有对照品均为课题组分离鉴定得到,9个对照品分别为 (5S,6R,7R)-4′-甲氧基-5,6,7,3′-四羟基-2-(2-苯乙基)-5,6,7,8-四氢色原酮、8-氯-4′-甲氧基-5,6,7,3′-四羟基-2-(2-苯乙基)-5,6,7,8-四氢色原酮、8-羟基-2-(2-苯乙基) 色酮、6-甲氧基-2-(3′-甲氧基- 4′-羟基-2-苯乙基) 色酮、6-羟基-2-(4′-甲氧基-2-苯乙基) 色酮、6-羟基-2-(2-苯乙基)色酮、6,7-甲氧基-2-(2-苯乙基)色酮、2-(4′-甲氧基-2-苯乙基) 色酮、2-(2-苯乙基) 色酮。经HPLC峰面积归一化法计算,各质量分数均大于98%。10批沉香药材于2013年收集,均由中国热带农业科学院热带生物技术研究所戴好富研究员鉴定,其沉香原植物均为瑞香科沉香属白木香Aquilaria sinensis (Lour.) Gilg。
2 方法与结果 2.1 色谱条件Dionex-Acclaim 120 C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-0.5%甲酸水溶液(B)。梯度洗脱程序:0~60 min,25%~55% A,60~80 min,55%~80% A,80~90 min,80%~100% A,90~95 min,100% A。体积流量0.4 mL/min,检测波长254 nm,柱温26 ℃,进样量20 μL。
2.2 供试品和对照品溶液制备10批药材均为野生国产沉香,药材信息见表 1。 样品提取采用《中国药典》2010年版规定的乙醚超声波提取法[4]。将沉香药材粉碎,精确称量粉末1.000 g,置于三角瓶中,加乙醚30 mL,封口膜密封,15 ℃超声提取30 min,滤过,重复3次。待乙醚挥干,得棕黄色油状物。利用公式计算提取率(提取率=提取物质量/药材质量)。取提取物5.0 mg,置于5 mL量瓶中用甲醇溶解、定容,并用0.45μm微孔滤膜滤过,得供试品溶液,4 ℃保存备用。
| 表 1 沉香药材样品信息 Table 1 Introduction of ARL medicinal materials |
精确称取对照品,分别配制成1.0 mg/mL的对照品溶液,用0.45 μm微孔滤膜滤过,4 ℃保存备用。分别取配制的对照品溶液适量混匀,制成混合对照品溶液。
2.3 方法学考察 2.3.1 精密度考察取同一对照品混合溶液,在“2.1”项的色谱条件下重复进样5次,测得各共有峰相对峰面积的RSD均小于1%,表明仪器精密度良好,符合指纹图谱的技术要求。
2.3.2 稳定性考察取同一供试品溶液,在“2.1”项的色谱条件下,分别在0、2、4、8、12、36、60 h进样,测得各共有峰相对峰面积的RSD均小于2%,表明供试品溶液在60 h内稳定。
2.3.3 重复性考察称取同一样品5份,按“2.2”项的方法制备样品,按照“2.1”项的色谱条件进样测定,结果表明,共有峰相对峰面积的RSD均小于2.5%,符合指纹图谱的技术要求。
2.4 沉香药材指纹图谱的建立及共有峰的鉴定分别取10批沉香药材样品,按上述方法制备并检测,记录其指纹图谱。运用中国药典委员会“中药色谱指纹图谱相似度评价系统2004A版”对10批样品的指纹图谱进行分析,设定S1为参照图谱,选取“时间窗宽度”为0.2 min,选定2个峰面积相对较大的峰进行多点校正,自动匹配,建立了沉香药材指纹图谱,结果见图 1,其中R为指纹图谱共有模式。混合对照品HPLC图见图 2。10批药材共确定了24个共有峰,编号1~24。
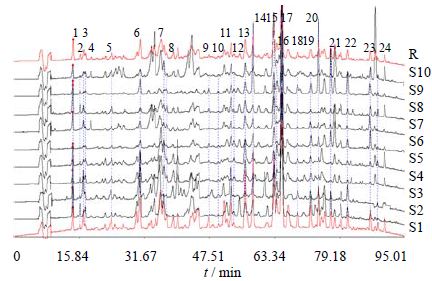 | 1~24: 24个共有峰 2-(5S,6R,7R)-4′-甲氧基-5,6,7,8-四羟基-2-(2-苯乙基)-5,6,7,8-四氢色原酮,4-8-氯-4′-甲氧基-5,6,7,3′-四羟基-2-(2-苯乙基)-5,6,7,8-四氢色原酮,10-8-羟基-2-(2-苯乙基)色酮,11-6-甲氧基- 2-(3′-甲氧基-4′-羟基-2-苯乙基)色酮,13-6-羟基-2-(4′-甲氧基-2-苯乙基) 色酮,14-6-羟基-2-(2-苯乙基)色酮,17-6,7-甲氧基-2-(2-苯乙基)色酮 19-2-(4′-甲氧基-2-苯乙基) 色酮,20-2-(2-苯乙基)色酮,下同 1—24: represents 24 common peaks 2-(5S,6R,7R)-4′-methoxy-5,6,7,8-tetrahydroxy-2-(2-phenylethyl)-5,6,7,8-tetrahydrochromone 4-8-chloro- 5,6,7-trihydroxy-2-[2-(3-hydroxy-4-methoxyphenyl)ethyl]-5,6,7 ,8-tetra- hydrochromone 10-8-hydroxy-2-(2-phenylethyl)chromone 11-6-methoxy- 2-[2-(3-methoxy-4-hydroxyphenyl)ethyl] chromone 13-6-hydroxy-2-[2- (4-methoxyphenyl)-ethyl]chromone 14-6-hydroxy-2-(2-phenylethyl) chromone 17-6,7-dimethoxy-2-(2-phenylethyl) chromone 19-2-[2-(4-methoxyphenyl) ethyl]chromone 20-2-(2-phenylethyl) chromone,same as below图 1 10批沉香药材HPLC指纹图谱和共有模式Fig. 1 New components isolated from mistletoe medium for PSB biotransforming |
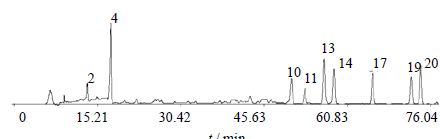 | 图 2 混合对照品HPLC图谱Fig. 2 HPLC of mixed reference substances |
在所建立的色谱条件下,沉香样品的特征峰有较好的分离,保留时间较为稳定,同时24个共有峰均能稳定出现,以2-(4′-甲氧基-2-苯乙基) 色酮(19号峰)为对照峰,计算其他23个特征峰的相对保留时间和相对峰面积,具体见表 2和表 3。
| 表 2 10批样品共有峰的相对保留时间 Table 2 Relative retention time of common peaks for 10 batcges of samples |
| 表 3 10批样品共有峰的相对峰面积 Table 3 Relative peak areas of common peaks for 10 batches of samples |
采用国家药典委员会“中药色谱指纹图谱相似度评价系统2004A版”系统评价软件,以特征指纹图谱共有模式为对照,计算各批次样品的相似度,S1~S10的相似度分别为0.924、0.882、0.878、0.867、0.864、0.857、0.850、0.837、0.823、0.754。相似度可以体现不同批次样品间各成分在种类及其相对量上的整体相似程度。分析结果表明,各药材相似度值在0.754~0.924,相似度在0.850以上的沉香药材占70%,说明药材中化学成分相似度较高,但仍然存在一定差异。从各样品色谱图整体分析,保留时间在20~45 min的色谱峰所代表的化学物差异较大。S10与共有模式图谱的相似度最低,仅为0.754,主要原因可能是34.12、42.32、87.82 min的峰面积比共有模式图谱中对应的峰面积大许多。
3.2 聚类分析以24个共有峰的相对峰面积作为变量,运用SPSS19.0数据处理软件对10批样品进行系统聚类分析,聚类方法为组间连接法,利用欧式距离作为样品的测度,得到样品的聚类分析树状图,见图 3。根据树状图结果,当分类距离取20时,可将10批沉香药材大致分为2个等级,样品S2、S6、S4、S1、S5、S7、S9和S3聚为一类,样品S8和S10聚为一类。该结果与样品相似度分析结果基本一致。
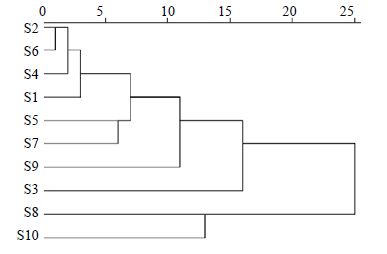 | 图 3 10批沉香药材聚类分析树状图Fig. 3 Hierarchical cluster analysis for 10 batches of ARLmedicinal materials |
流动相分别考察了乙腈-水、乙腈-0.5%乙酸水溶液、乙腈-0.5%甲酸水溶液3个系统,结果表明,采用乙腈-0.5%甲酸水溶液系统时,分离效果好,有利于指纹图谱的建立,因此,确定乙腈-0.5%甲酸水溶液作为流动相系统。
检测波长分别选择210、230、254、280、306、327 nm进行试验,通过比较发现254 nm波长下色谱峰较多,峰形较好且吸光度较大,故选择254 nm作为检测波长。
色谱柱选择Kromasil C18 ODS(150 mm×4.6 mm,5 μm)和Dionex-Acclaim 120 C18 柱(250 mm×4.6 mm,5 μm)对同一样品进行分析,结果表明,后者所得色谱图峰形较好,分离度高,因此选择其对样品进行分析。
4.2 结果分析本研究对10批沉香药材进行分析,建立了沉香药材HPLC指纹图谱共用模式,通过相似度评价,说明药材在化学成分的组成上存在一定差异,药材产地、结香方法和时间均可导致沉香化学成分上的差异,影响其质量。本研究发现24个共有峰,并通过对照品指认了其中9个共有峰,均为色酮类化合物。色酮类化合物和倍半萜类化合物是沉香中量最高的成分也是其特征性成分。共有峰2和4为四氢色原酮类化合物,根据文献报道[3],沉香中已鉴定四氢色原酮类化合物10多个,推测共有峰1和3以及保留时间较接近的成分可能均属于四氢色原酮类化合物。其中峰2所代表的化合物的相对分子质量是348,是鉴定沉香样品真伪的特征性相对分子质量[23],报道的文献中利用DART-TOFMS检测125个沉香样品和其他25种有香味的木材,结果证明只有沉香中能检测到相对分子质量为348的色原酮类化合物,这为利用HPLC指纹图谱鉴定沉香提供了有利证据。共有峰10、11、13、14、17、19和20根据对照品鉴定为2-(2-苯乙基) 色酮类成分,其中19号共有峰2-(4′-甲氧基-2-苯乙基) 色酮和20号共有峰2-(2-苯乙基) 色酮据报道在150 ℃时即可裂解产生简单芳香族化合物苯甲醛和对甲氧基苯甲醛[24],是沉香加热时散发香味的重要贡献者,两者在奇楠沉香中相对量之和高达37.30%~84.71%,而普通沉香中这两个化合物相对量之和仅为0.16%~13.30%,其在样品中的相对量之和也是评价沉香品质的重要指标之一[6]。沉香的化学成分非常复杂,目前已经鉴定了130多个成分,其中色酮类化合物50多个,倍半萜类化合物70多个[3, 25]。指纹图谱中其他未鉴定的共有峰未能找到对照品,这些化合物的分离纯化以及结构鉴定工作正在进行中。根据指纹图谱分析结果,运用SPSS数据处理软件将24个共有峰的相对峰面积作为变量进行聚类分析,得到树状图,沉香样品分为2类,其结果与相似度评价结果基本一致。
与已报道的GC-MS检测方法相比较,本研究方法指认了9个色酮类化合物共有峰,其中2个是极性较大的不易挥发的四氢色原酮类化合物,这一类色酮化合物在以往的GC-MS报道中未能检测到。HPLC指纹图谱可以结合GC-MS分析方法,为沉香的鉴定提供更全面的信息。
4.3 结论本研究首次采用HPLC指纹图谱结合聚类分析对10批国产沉香药材样品进行研究,该方法精密度、稳定性、重复性和分离度良好。通过比较确定了24个共有峰,指认其中9个峰。通过相似度评价,发现沉香药材HPLC指纹图谱有一定的差别,结合聚类分析对指纹图谱进行综合评价,评价结果与相似度结果基本一致。本研究方法能比较直观、全面地从整体上反映沉香药材的质量,为沉香的鉴定和质量标准提供科学依据,同时,共有峰中未鉴定的成分有待进一步研究。
| [1] | 刘军民, 翟 明. 国产沉香资源开发利用及化学成分研究进展 [J]. 中国新药杂志, 2012, 21(1):48-51. |
| [2] | 梅文莉, 杨德兰, 左文健, 等. 奇楠沉香中2-(2-苯乙基) 色酮的GC-MS分析鉴定 [J]. 热带作物学报, 2013, 34(9):1819-1824. |
| [3] | Chen H Q, Wei J H, Yang J S, et al. Chemical constituents of agarwood originating from the endemic genus Aquilaria plants [J]. Chem Biodivers, 2012, 9(2):236-250. |
| [4] | 中国药典 [S]. 一部. 2010. |
| [5] | Mei W L, Yang D L, Wang H, et al. Characterization and determination of 2-(2-phenylethyl) chromones in Agarwood by GC-MS [J]. Molecules, 2013, 18(10):12324-12345. |
| [6] | 杨德兰, 梅文莉, 杨锦玲, 等. GC-MS分析四种奇楠沉香中致香的倍半萜和2-(2-苯乙基) 色酮类成分 [J]. 热带作物学报, 2014, 35(6):1235-1243. |
| [7] | 梅文莉, 曾艳波, 刘 俊, 等. 五批国产沉香挥发性成分的GC-MS分析 [J]. 中药材, 2007, 30(5):551-555. |
| [8] | 林 峰, 梅文莉, 吴 娇, 等. 人工结香法所产沉香挥发性成分的GC-MS分析 [J]. 中药材, 2010, 33(2):222-225. |
| [9] | 陈晓颖, 高 英, 李卫民, 等. 不同结香方法与国产沉香挥发性化学成分的相关性研究 [J]. 中国药房, 2012, 23(11):1017-1020. |
| [10] | 林 峰, 戴好富, 王 辉, 等. 两批接菌法所产沉香挥发油化学成分的气相色谱-质谱联用分析 [J]. 时珍国医国药, 2010, 21(8):1901-1902. |
| [11] | Wetwitayaklung P, Thavanapong N, Charoenteeraboon J. Chemical constituents and antimicrobial activity of essential oil and extracts of heartwood of Aquilaria crassna obtained from water distillation and supercritical fluid carbon dioxide extraction [J]. Silpakorn U Science & Tech J, 2009, 3(1):25-33. |
| [12] | Chen D, Xu Z R, Chai X Y, et al. Nine 2-(2-phenylethyl) chromone derivatives from the resinous wood of Aquilaria sinensis and their inhibition of LPS-induced no production in RAW 264. 7 Cells [J]. Eur J Org Chem, 2012, 2012(27):5389-5397. |
| [13] | 陈 亚, 江 滨, 曾元儿. 高效液相色谱法测定沉香药材中两种活性成分的含量 [J]. 时珍国医国药, 2007, 18(7):1697-1698. |
| [14] | 郝子博, 王丽莉, 张铁军. 落花生茎叶HPLC指纹图谱研究 [J]. 中草药, 2012, 43(10):2050-2054. |
| [15] | 丁 婕, 黄 松, 张柏明, 等. 凉粉草的特征指纹图谱研究 [J]. 中草药, 2012, 43(11):2284-2288. |
| [16] | 何新荣, 古 今, 刘 萍. 车前子指纹图谱研究及其2种指标成分的测定 [J]. 中草药, 2013, 44(21):3053-3056. |
| [17] | Dai H F, Liu J, Han Z, et al. Two new 2-(2-phenylethyl) chromones from Chinese eaglewood [J]. J Asian Nat Prod Res, 2010(12):134-137. |
| [18] | Dai H F, Liu J, Zeng Y B, et al. A new 2-(2-phenylethyl) chromone from Chinese eaglewood [J]. Molecules, 2009, 14:5165-5168. |
| [19] | Liu J, Wu J, Zhao Y X, et al. A new cytotoxic 2-(2-phenylethyl) chromone from Chinese eaglewood [J]. Chin Chem Lett, 2008, 19(8):934-936. |
| [20] | 梅文莉, 刘 俊, 李小娜, 等. 海南国产沉香的化学成分研究 [J]. 热带亚热带植物学报, 2010, 18(5):573-576. |
| [21] | Yang D L, Mei W L, Zeng Y B, et al. 2-(2-phenylethyl) chromone derivatives in Chinese agarwood "Qi-Nan" from Aquilaria sinensis [J]. Planta Med, 2013, 79(14):1329-1334. |
| [22] | Yang D L, Wang H, Guo Z K, et al. A new 2-(2-phenylethyl) chromone derivative in Chinese agarwood ‘QiNan'from Aquilaria sinensis [J]. J Asian Nat Prod Res, 2014, 7(16):770-776. |
| [23] | Cady L, Edgard E. Evaluating agarwood products for 2-(2-phenylethyl) chromones using direct analysis in real time time-of-flight mass spectrometry [J]. Rapid Commun Mass Spectrom, 2012, 26(23):2649-2656. |
| [24] | Hashimoto K, Nakahara S, Inoue T, et al. A new chromone from agarwood and pyrolysis products of chromone derivatives [J]. Chem Pharm Bull, 1985, 33(11):5088-5091. |
| [25] | Yang D L, Wang H, Guo Z K, et al. Fragrant agarofuran and eremophilane sesquiterpenes in agarwood ‘Qi-Nan' from Aquilaria sinensis [J]. Phyto Lett, 2014, 8:121-125. |
 2014, Vol. 45
2014, Vol. 45


