2. 南开大学生命科学学院, 天津 300071;
3. 天津中医药大学, 天津 300193
2. College of Life Sciences, Nankai University, Tianjin 300071, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
消岩汤系天津中医药大学第一附属医院肿瘤科贾英杰教授结合多年临证经验总结拟成治疗恶性肿瘤之精方。根据功效将全方拆分为3组:清热解毒组(夏枯草、生牡蛎、白花蛇舌草)以清热解毒、软坚散结;益气扶正组(黄芪、太子参)以滋阴益气、扶正抗癌;活血祛瘀组(姜黄、郁金)以行气散结、活血祛瘀;诸药合用,共奏益气滋阴、活血祛瘀、清热解毒、扶正驱邪之功[1, 2]。消岩汤能有效地辅助化疗治疗中晚期非小细胞肺癌,并对化疗患者有增效减毒作用[3]。本实验选用人肺腺癌A549细胞,采用Western blotting和RT-PCR方法分别检测消岩汤全方及其各拆方组人肺腺癌A549细胞survivin、caspase-3蛋白及基因的表达情况,探讨消岩汤全方及其各拆方组合中药对人肺腺癌A549细胞凋亡的影响及其机制。
1.1 试剂与药物CCK-8试剂盒(武汉博士德生物有限公司);PVDF膜(Millipore公司);辣根酶标记二抗(北京中杉金桥公司);ECL发光剂(Santa Cruz公司);Ultrapure RNA Kit(CWbio. Co. Ltd.),Platinum® SYBR® Green q PCR Super Mix-UDG(Life Technologies公司),RPMI 1640培养液(Gibco公司),胎牛血清(Amresco公司),青-链霉素(南京凯基生物科技公司)。消岩汤各组分中药由天津中医药大学第一附属医院药房提供。中药的浓缩液为棕黄色液体,剂量以原方为准,全方共140 g,包括生黄芪30 g、太子参15 g、郁金10 g、姜黄10 g、夏枯草、生牡蛎、白花蛇舌草共60 g等,消岩汤及其拆方(清热解毒组、益气扶正组、活血祛瘀组)水煎液均由天津中医药大学中药提取室严格按回流提取法进行提取,其终质量浓度分别为含生药2、1、1、1 g/mL。
1.2 细胞人肺腺癌细胞株A549,由南开大学生命科学学院提供。
1.3 仪器Bio-tek Synergy2多功能酶标仪(美国伯腾仪器有限公司),电泳电源(Bio-Rad公司),FluorChem FC2 成像系统(Alpha Innotech公司),Epgiadients PCR仪(Eppendorf 公司),荧光定量PCR仪(ABI7500 fast)。
2 方法 2.1 A549细胞的培养A549细胞置于含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的RPMI 1640培养液中,置于5% CO2培养箱,恒温37 ℃培养。使用0.05%胰蛋白酶和0.02% EDTA常规消化传代,4 g/L台盼蓝染色后计算细胞数和存活率(>98%),取对数生长期的细胞进行实验。
2.2 样品的制备消岩汤及各组拆方浓缩液以10 000 r/min 离心5 min,取上清用0.22 μm过滤器除菌,用培养基稀释成梯度质量浓度的溶液。
2.3 CCK-8法筛选消岩汤及其拆方配伍对A549细胞生长的最有效抑制浓度选取处于对数生长期的细胞进行常规消化,调整细胞浓度至以5×107/L接种于96孔板中,每孔80 μL。待贴壁后,加入RPMI 1640、10%胎牛血清培养基同步化24 h。设立空白对照孔(只加入细胞培养液)、实验孔、调零孔(未加CCK-8试剂)、阴性对照孔(加细胞未加中药)。实验组分别加入不同质量浓度的中药,4组中药用培养基稀释成梯度质量浓度的溶液(经过预试验筛选,消岩汤全方组、清热解毒组、活血化瘀组、益气扶正组以10、20、30、40、50、60、70、80、90 mg/mL进行实验,各组方均相同质量浓度梯度)加入96孔板,每孔200 μL,每个质量浓度重复6孔,培养48 h;48 h后,加入20 μL CCK-8溶液,37 ℃孵育4 h。在酶标仪上(λ=450 nm)测各孔吸光度(A)值,实验重复3次。计算药物对细胞的生长抑制率。
2.4 Western blotting法测定Survivin和Caspase-3蛋白表达取对数生长期A549细胞,以5×105/mL接种于培养瓶中培养,通过CCK-8筛选出的对A549细胞最有效抑制浓度的各组中药作用48 h后,以培养基为对照,加适量预冷的蛋白裂解液RIPA,匀浆,14 000 r/min离心15 min,上清转入新管,BCA法测定蛋白的量,用PBS调至等浓度,加6×SDS上样缓冲液,沸水浴5 min备用。以β-tublin为内参,8%的SDS-PAGE电泳分离后,电转至PVDF膜上。PVDF膜经封闭液封闭1 h后,分别加入小鼠抗人Survivin、Caspase-3单克隆抗体作一抗,室温结合2 h。用辣根过氧化物酶标记的羊抗小鼠作为二抗,室温结合1 h。TBET缓冲液洗涤后,加入化学发光剂,ECL发光法检测蛋白表达,采用AlphaView图像分析系统进行灰度分析。
2.5 荧光定量PCR法检测survivin与caspase-3基因表达培养A549细胞,制备悬液,平均分瓶继续培养,待细胞长满贴壁后按实验分组干预,采用对A549细胞最有效抑制浓度的各组中药作用A549细胞,继续培养24 h,制备细胞悬液,分装入离心管离心收集细胞,用Trizol试剂提取总RNA;用All-in-OneTM First-Strand cDNA Synthesis Kit(Gene Copoeia)进行反转录,RT-PCR反应条件:37 ℃、1 h;85 ℃、5 min。产物于4 ℃备用,-20 ℃冻存。用Platinum® SYBR® Green qPCR SuperMix-UDG进行扩增,退火温度为60 ℃,反应体系由survivin上游引物5’-CACCGATCTCTACATTCAA-3’,下游引物5’-CACTTTCTTCGCAGTTTCCT-3’各1.0 μL;caspase-3上游引物5’-TTCAGAGGGGATCGT- TGTAGAAGTC-3’,下游引物5’-CAAGCTTGTCG- GCATACTGTTTCAG-3’各1.0 μL;2×Super Mix 10 μL、cDNA模板1.0 μL组成。
2.6 统计学分析数据以x±s表示,用SPSS 19.0统计学软件进行数据方差分析。
3 结果 3.1 消岩汤全方及各拆方组药物对A549细胞生长的抑制作用消岩汤全方及各拆方组药物均对A549细胞有一定的抑制作用。其中消岩汤全方组当质量浓度达到50 mg/mL时达到最大抑制率85.60%;活血祛瘀组药物质量浓度达到60 mg/mL时达到最大抑制率82.47%;清热解毒组药物质量浓度达到70 mg/mL时达到最大抑制率81.54%;益气扶正组药物质量浓度达到80 mg/mL时达到最大抑制率85.85%。提示消岩汤及其拆方配伍对A549细胞的生长有明显的抑制作用。见图 1。
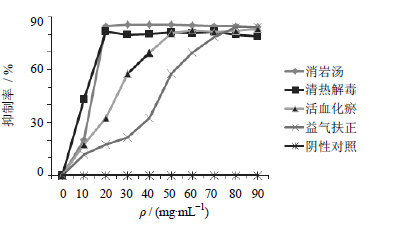 | 图 1 各组药物体外对A549细胞生长的抑制作用Fig. 1 Inhibitory rate of decoction in each group on in vitro growth of A549cells |
分别用消岩汤全方(50 mg/mL)、活血祛瘀药物(60 mg/mL)、清热解毒药物(70 mg/mL)、益气扶正药物(80 mg/mL)作用A549细胞48 h后收集细胞,经定量提取蛋白后进行Western blotting检测。结果显示实验组Survivin蛋白的表达均低于对照组,且清热解毒组Survivin蛋白的表达最低;提示消岩汤剂通过抑制Survivin蛋白表达的途径起到抗肿瘤的作用,其中清热解毒组是全方抗肿瘤的主要组成部分。消岩汤及各拆方组中Caspase-3蛋白表达均低于对照组,提示消岩汤的抗肿瘤作用可能并非通过调控Caspase-3蛋白表达起作用。见图 2。
 | 图 2 各组中药对A549细胞Survivin和Caspase-3蛋白表达的影响Fig. 2 Effects of decoction in each group on expression of survivin and caspase-3 proteins ofpulmonary carcinosis A549 cells |
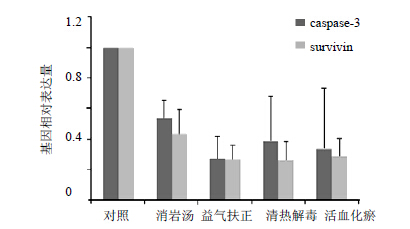 | 图 3 各组中药对A549细胞survivin及caspase-3基因表达的影响Fig. 3 Effectof decoction in each group on expression of survivin and caspase-3 gene in tumor cells |
消岩汤及各组分中药可以抑制survivin基因的表达而起到诱导A549细胞凋亡的作用,其中清热解毒组效果最为明显;但各组分在促进caspase-3基因的表达方面未见明显效果。提示消岩汤剂主要是通过抑制survivin基因表达的途径起到抗肿瘤的作用,其中清热解毒组是全方抗肿瘤的主要组成部分。结果见图 3。
4 讨论肺癌是全球发病率最高的恶性肿瘤,己成为人类因癌症死亡的主要原因[4]。Survivin是新近发现的凋亡蛋白抑制因子(inhibitor of apoptosis protien,IAP)家族的一名新成员,是作用很强的凋亡抑制因子。在肺癌和其他恶性肿瘤中Survivin表达水平上调是一个不良预后指标[5, 6, 7]。Caspase-3则为一组选择性地剪切蛋白质,其功能的丧失或结构变化,可促进细胞凋亡。
消岩汤基于肿瘤病机“正气内虚、毒瘀并存”,以“扶正固本、解毒祛瘀”为治法,结合多年临证经验总结拟成。本实验通过检测survivin及caspase-3基因及蛋白表达,从抑制细胞凋亡及促进细胞凋亡2个不同的角度考察消岩汤剂及其各组分对人肺腺癌A549细胞的影响。发现不同组分中药均对A549细胞生长具有不同程度的抑制作用,且
清热解毒组中药为全方体外抑瘤作用的最重要组分。Western blotting及荧光定量PCR法结果均提示消岩汤剂主要通过抑制A549细胞中survivin基因的表达及蛋白合成而发挥诱导细胞凋亡的作用,其中仍以清热解毒组分中药作用显著;对于调节caspase-3基因的表达效果并不明显。本研究初步阐明了消岩汤体外抗肿瘤作用及部分机制,为中药复方治疗肺癌的临床应用提供了重要的实验依据,但其体内抗肿瘤作用及相关机制仍有待深入研究。
| [1] | 贾英杰,于建春,杨佩颖,等. 扶正解毒祛瘀法防治化疗后骨髓抑制的探讨 [J]. 中医杂志,2014,55(3):198-201. |
| [2] | 贾英杰. 试论癌瘤"正气内虚,毒瘀并存"的病机观点 [J]. 新中医,2013,45(6):9-11. |
| [3] | 彭卫卫,贾英杰. NP方案联合解毒祛瘀法治疗中晚期非小细胞肺癌的临床观察 [J]. 辽宁中医杂志,2010,37(7):1303-1304. |
| [4] | Siegel R,Desantis C,Jemal A. Colorectal cancer statistics,2014 [J]. CA Cancer J Clin,2014,64(2):104-117. |
| [5] | Salz W,Eisenberg D,Plescia J,et al. A Survivin gene signature predicts aggressive tumor behavior [J]. Cancer Res,2005,65(9):3531-3534. |
| [6] | 李奕璇,陈 全,朱大冕. Survivin启动子调控sea基因真核表达质粒的构建及其在肺癌细胞中的特异性表达 [J]. 中国生物制品学杂志,2009,22(2):147-149. |
| [7] | 李姝君,杨志雄,田鲜艳,等. Survivin在肺癌中表达意义及其与Fas/FasL表达的关系 [J]. 中国医药导报,2011,8(20):17-19. |
 2014, Vol. 45
2014, Vol. 45


