2. 上海中医药大学附属曙光医院, 上海 200021
2. Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200021, China
风湿性疾病是一种以侵犯关节、骨骼、肌肉及有关软组织为主的慢性反复发作疾病,属于中医学“痹证”、“历节”等范畴。《素问•痹论》曰:“风寒湿三气杂至,合而为痹也”[1]。腰痛宁胶囊作为治疗风湿痹病的复方中药,以马钱子为君药,并与具有活血化瘀、抗炎镇痛、增强免疫等功效的麻黄、甘草、苍术、乳香、没药、川牛膝及土鳖虫、全蝎、僵蚕这9味药材,按照一定比例打粉制成胶囊,伴以黄酒吞服;具有祛寒止痛、通经活络、消肿化瘀等功效[2]。腰痛宁复方中的多药材及多成分使得对其作用机制与药效物质的现代医学和药理研究难以深入、系统开展,对药物的质量控制、疗效评价及二次开发带来很大困难。
近年有学者对由2~3种药材的提取物或几种主要成分的不同组合构成的复方中药进行细胞水平药理学研究,揭示了不同配伍所产生的协同、拮抗作用[3, 4, 5],为现代中药药理研究提供了新的途径。由于仅用几种主要成分难以全面反映中药复方的物质基础,而直接采用药材粉末或粗提物进行细胞实验容易导致假阳性与假阴性。已有的中药复方分子生物学药理研究多以测试值的显著性差异分析来评估样品,不能量化评价样品的药理活性。本实验以腰痛宁胶囊组方药材中10味药材的16个活性部位(马钱子总生物碱、麻黄总生物碱、甘草总黄酮、甘草总皂苷、川牛膝总皂苷、没药挥发油、乳香挥发油、苍术挥发油、土鳖虫水提液、僵蚕水提液、全蝎水提液、川牛膝多糖、甘草多糖、苍术多糖、麻黄多糖、黄酒多糖)为基础,根据各原料药材在腰痛宁组方中的重要性并借鉴组合化学思想,构造了以马钱子与麻黄生物碱为主、其他9味药材的黄酮、皂苷、挥发油(水提物)、多糖等活性部位为辅的6个腰痛宁拆方、组方及全方样品。
风湿痹病的治则是消肿止痛、去湿除寒、补肾健脾、活血通络。从现代药理角度阐释该治则,这类药物应具有抗炎镇痛、增强免疫和改善血液循环等功效。本实验在细胞水平着重评价腰痛宁组方的抗炎、免疫和活血活性。当生物组织受到某种刺激如外伤、感染等产生炎症时,一些特定的细胞因子就会活化自身的环氧酶/环氧化酵素(COX),其中包括COX-1及COX-2两大类。COX会使花生四烯酸大量转变为前列腺素E2(PGE2),和前列腺素E2α(PGE2α)等前列腺素。因此,PGE2的产生与炎症息息相关[6],常被用来评价细胞抗炎活性[7]。白细胞介素-2(IL-2)又名T细胞生长因子(TCRF),主要由活化的CD4+Th1细胞产生的具有广泛生物活性的细胞因子。IL-2在体外能维持T细胞生长,促进Tc细胞成熟和扩增,也支持Th细胞生长,活化NK细胞、巨噬细胞和B细胞。免疫耐受和免疫抑制的形成与产生IL-2的功能缺陷或不全有关[8]。一氧化氮(NO)是重要的内源性血管舒张因子,对维持血管张力的恒定与调节血压稳定起着重要作用[9]。因此本研究选取PGE2、IL-2与NO为指标分别评价腰痛宁组方在细胞水平的抗炎、免疫与活血活性。通过测定各样品对巨噬细胞(Ana-1)上清液中PGE2的半数抑制浓度(IC50)、小鼠脾淋巴细胞上清液中的IL-2和人脐静脉内皮细胞中上清液中NO的半数有效浓度(EC50),并比较实验IC50/EC50值与IC50/EC50叠加值来探究腰痛宁各活性部位间的相互作用类型,以考察腰痛宁组方的合理性及其抗炎、免疫、活血的活性与作用机制。
1 材料 1.1 试剂脂多糖(LPS)、花生四烯酸(AA)、刀豆蛋白A(ConA)购自Sigma公司,新生小牛血清(FBS)购自杭州四季青生物工程材料有限公司,DMEM培养基购自北京清大天一科技有限公司,IL-2、PGE2 ELISA试剂盒购自美国R&D公司,CCK-8试剂盒购自东仁化学科技有限公司,NO试剂盒购自南京建成科技有限公司,其余试剂均为国产分析纯。
1.2 药材制马钱子(Strychnos nux-vomica L.,种子,批号Y302-09091-10)、苍术[Atractylodes lambncea (Thunb.) DC.,根和地下茎,批号Y002-101001-2]、麻黄(Ephedra sinica Stapf,茎,批号Y412-100601-12)、土鳖虫(Eupolyphaga sinensis Walker,虫体,批号Y803-110101-5)、川牛膝(Cyathula officinalis K. C. Kuan,根,批号Y012-110401-1)、僵蚕(Bombyx mori L. 白僵菌感染的虫体,批号Y805-1011054)、甘草(Glycyrrhiza uralensis Fisch.,根,批号Y013-110301-1)、乳香(Boswellia sacra Flueck.,树脂,批号110301-2)、没药[Commiphoramyrrha (Nees) Engl.,树脂,批号110401-1)]、全蝎(Buthus martensii Karsch,虫体,批号Y804-11302-4)由承德颈复康药业集团有限公司提供,经承德颈复康药业集团有限公司执业药师王春民鉴定,样本保存于华东理工大学化学与分子工程学院分析化学实验室。黄酒,承德颈复康药业集团有限公司提供(批号291110,10 mL/支)。
1.3 实验动物C57小鼠,SPF级,6~8周龄,雌性,购自上海西普尔-必凯实验动物有限公司,许可证号SCXK(沪)2008-0016。
1.4 实验仪器YP2002分析天平(上海越平科学仪器有限公司),NU—4850E CO2培养箱(美国NUAIRE),双人垂直超净台(日本Air Tech),LD5—10离心机(北京离心机厂),SS—325电脑控制消毒柜(日本TOMY),680多功能酶标仪(美国Bio-Rad),GL—88B漩涡混合器(海门市其林贝尔仪器制造有限公司),S10—3恒温磁力搅拌器(上海司乐仪器有限公司),DS—3510DTH超声仪(上海生析超声仪器有限公司),TS100—F荧光倒置显微镜(NIKON公司),Scepter 2.0手持细胞计数器(美国Millipore)。
2 方法 2.1 样品制备各药材的活性部位由本实验室提取,其制备方法、得率、质量及药效见表 1。腰痛宁组方中马钱子为君药[2],麻黄为佐药[33],这两味药材的活性部位是生物碱,因此本实验将马钱子生物碱与麻黄生物碱作为活性部位组方中的基本单元,其余活性部位则根据腰痛宁组方原则及组合化学理念,按各药材活性部位在腰痛宁组方中的功效及其重要性,按黄酮、皂苷、挥发油/水提物及多糖的顺序依次分别加入生物碱中。构建表 2所示的腰痛宁拆方及组方样品I~VI,其中腰痛宁全方(样品VI)是所有药材活性部位组合加腰痛宁药引黄酒的浓缩物溶解配制。各活性部位在样品I~VI中的处方量按照下式计算:某活性部位的处方量=腰痛宁处方中该活性部位的组方药材的处方量×该活性部位在药材中的质量分数/该活性部位在提取物中的质量分数。固体活性部位(各药材的生物碱、黄酮、皂苷和多糖)的处方量遵照上式计算;各挥发油是整体入药,在上式中分母为1;土鳖虫、僵蚕和全蝎均取为10倍量提取的水提液入药,因此在计算处方量时,直接用腰痛宁处方中该活性部位的组方药材的处方量乘以0.10即可。例如,麻黄生物碱的处方量=腰痛宁中麻黄的处方量×麻黄生物碱在麻黄中的质量分数/麻黄生物碱提取物中生物碱质量分数=6.7 g×(15 mg/g) / 0.5=201 mg。
按照上式计算各中药活性部位处方量,精密称取表 1中所列各中药活性部位,先取热稳定性活性部位置烧杯中,加入适量PBS缓冲液搅拌初步溶解,沸水浴加热10 min,待其完全溶解,冷却并加入热不稳定性活性部位,混合超声20 min,冷却,定容,配成1.200 mg/mL母液并稀释至各质量浓度(3.125、6.25、12.5、25、50、100、200、400 μg/mL),备用。
| 表 1 腰痛宁组方药材中各活性部位的制备方法、质量指标与药理活性 Table 1 Preparation,quality standards,and pharmacological activities of active fractions extracted from materia medica in YTNC |
| 表 2 腰痛宁胶囊药材活性部位拆方及组方 Table 2 Disassembled prescription and prescription of blending active fractions of materia medica in YTNC |
小鼠腹腔巨噬细胞(Ana-1细胞)购自中国科学院上海细胞研究所。在37 ℃、5% CO2条件下,用含10%小牛血清、青霉素(1×105 U/L)及链霉素(100 mg/L)的DMEM培养液进行传代培养,实验用细胞均处于对数生长期。参照文献方法[7]将密度为4 000个/孔的Ana-1细胞接种于96孔培养板中,设溶剂DMSO空白组、LPS对照组及待测药物组(终质量浓度3.125、6.25、12.5、25、50、100、200、400 μg/mL),于37 ℃、5% CO2培养2 h。加入LPS(终质量浓度为1 mg/L)培养9 h,溶剂DMSO组不加LPS。弃去旧培养液,用新鲜培养液洗涤3次,分别加入各质量浓度的待测药物孵育30 min,加入底物AA(终浓度为10 μmol/L),37 ℃,20 min,收集上清液。细胞上清液中PGE2的测定按照PGE2 ELISA试剂盒使用说明书进行测定,每组重复3次,计算IC50。同时,按照CCK8试剂盒使用说明,每孔加入100 μL CCK8试剂,用多功能酶标仪于450 nm处检测细胞活力(A450)。
2.3 小鼠脾淋巴细胞的制备及IL-2检测10只雌性C57小鼠,体质量20 g左右,脱颈处死,用75%酒精浸泡消毒,剪开腹腔取脾,将其置于盛有适量无血清的DMEM培养基中清洗。将脾脏碾碎,用无血清DMEM培养基清洗2次,用吸管收集冲洗液至离心管中,离心10 min(4 ℃、1 000 r/min),弃上清。加入红细胞裂解液3 mL,轻轻吹打,静置5 min,待红细胞完全破碎,离心5 min(4 ℃、1 000 r/min);弃上清去除红细胞,重复操作2次;加入无血清DMEM,轻轻吹打,离心5 min(4 ℃、1 000 r/min),弃上清。用含10% FBS的DMEM完全培养液重悬细胞,用细胞计数器计数调整细胞浓度为1×107个/mL,制成脾淋巴细胞悬液备用。
参照文献方法[34]将密度为1×106个/孔的脾淋巴细胞接种于96孔培养板中,设溶剂DMEM对照组、ConA处理组及待测药物组(终质量浓度3.125、6.25、12.5、25、50、100、200、400 μg/mL)。每组分别加入50 μL ConA(终质量浓度5 μg/mL)和50 μL相应的药物(溶剂DMEM对照组加入DMEM培养基)。37 ℃、5% CO2细胞培养箱培养48 h,收集上清液。细胞上清液中IL-2的测定按照IL-2 ELISA试剂盒使用说明书进行测定,计算EC50。
2.4 NO检测人脐静脉内皮细胞HUVEC,购自上海博升生物技术有限公司。HUVEC细胞传代培养,用含10% FBS的DMEM培养基制成2×106个/mL细胞悬液,细胞接种96孔板,每孔100 μL,设3个复孔;药物组(终质量浓度3.125、6.25、12.5、25、50、100、200、400 μg/mL)加药每孔100 μL,空白组每孔加入100 μL不含10% FBS的DMEM培养液;37 ℃、5% CO2培养48 h。取细胞上清液,用酶标仪在550 nm处测定吸光度(A)值,检测NO水平,计算EC50。
2.5 数据处理实验数据以x±s表示,并均采用SPSS 18.0软件进行单因素方差分析。
两种药物A、B配方后进入细胞后产生的作用,通常存在以下3种情况:
(1)两种药物的作用之间不存在相互影响时,配方药物的作用关系为叠加作用:即IC50实验值-s<XA·IC50A+XB·IC50B(即IC50叠加值)<IC50实验值+s。其中XA为药物A在配方中所占的百分比,XB为B药物在配方中所占的百分比,IC50A与IC50B分别代表药物A与B单独作用时的IC50;SD为IC50实验值的标准方差。本研究将XA·IC50A+XB·IC50B定义为IC50叠加值。
(2)两种药物的作用产生拮抗作用,即IC50-s>IC50叠加值。
(3)两种药物的作用产生协同作用,即IC50+s<IC50叠加值。
假设上述配方中药物之间不存在相互影响,求解lim G=‖XA·IC50A+XB·IC50B-IC50‖的最小值问题,即可求得各IC50A与IC50B。以上计算过程通过MATLAB实现,详细过程及程序源代码见文献报道[35]。
3 结果 3.1 腰痛宁各样品对Ana-1细胞产生PGE2的影响 3.1.1 腰痛宁各样品对Ana-1细胞活力的影响为了探究PGE2的减少是否与细胞的大量死亡有关,本实验对6个样品的Ana-1细胞毒性进行了检测。各样品作用于细胞后并未出现大量的细胞死亡情况,各样品在不同质量浓度下对Ana-1细胞基本无杀伤作用,故PGE2检测结果可信。
3.1.2 腰痛宁各样品对Ana-1细胞产生PGE2的影响由图 1可知,Anal-1细胞中产生的PGE2随着各样品质量浓度的升高而降低,且样品质量浓度低时PGE2降低速度较慢,样品质量浓度高时PGE2降低速度较快,在样品浓度最高(400 μg/mL)时PGE2水平达到最低,即样品对PGE2抑制作用在高浓度时达到最大。由此得出,各样品在考察质量浓度范围内均对小鼠巨噬细胞生成PGE2产生了抑制作用,且此抑制作用与药物质量浓度呈正相关关系。其中样品III对小鼠巨噬细胞产生PGE2的抑制作用最强。
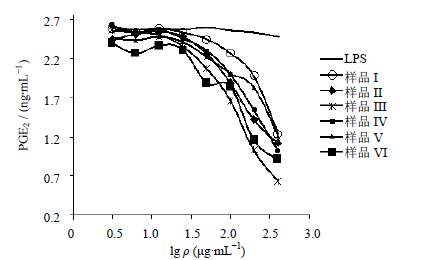 | 图 1 腰痛宁各样品对Ana-1细胞产生PGE2的影响 (n=3)Fig. 1 Effect of samples from YTNC on PGE2 production (n=3) |
根据图 1求得各样品的IC50实验值的平均值,进而可以求得各样品的IC50叠加值,各样品的IC50实验值均值、s及IC50叠加值见图 2。可知,样品I的IC50实验值-s>其IC50叠加值,表明样品I中的两种生物碱在抑制PGE2产生时呈现拮抗作用。样品II在样品I的基础上,加入了甘草总黄酮,其质量浓度最高时Anal-1细胞的PGE2水平较样品I略高(图 1),但无统计学意义;而样品II的IC50实验值-s<其IC50叠加值<IC50实验值+s,说明甘草总黄酮与2个生物碱混合物产生的作用仅仅为简单的叠加作用,无增效减效功能。而当川牛膝总皂苷和甘草总皂苷加入样品II组成样品III后,其在最高质量浓度时较其余样品具有最强抑制PGE2产生的作用(图 1,样品II、III之间具有显著性差异,P<0.01);且样品III的IC50叠加值>IC50实验值+s,表明加入的2种总皂苷与样品II中的生物碱+总黄酮混合物组合后,产生了较强的协同增强样品III抗炎的作用。该结果与中医理论中甘草具有调和诸药使其药性达到最佳、川牛膝具有引药下行更好到达用药靶点的观点相符;同时,从甘草总皂苷与生物碱+总黄酮混合物的作用为协同作用,而甘草总黄酮与生物碱混合物的作用仅为叠加作用来看,可初步推测,甘草调和诸药的功能主要来自于其中的总皂苷成分。样品IV为各药材挥发油(含水提物)与生物碱+总黄酮+总皂苷混合物的组合,样品IV的IC50实验值-s>IC50叠加值,表明挥发油(含水提物)对样品III中各活性部位的组合产生了拮抗作用,导致样品IV的IC50大于样品III;样品V为多糖与样品IV中各活性部位的组合,样品VI为黄酒浓缩物(黄酒多糖)与样品V的组合,样品V与VI的IC50叠加值在实验IC50波动区间内,表明多糖活性部位对样品IV、黄酒多糖对样品V产生的作用均为叠加作用。鉴于样品V的IC50高于样品IV,说明腰痛宁中的多糖部位并未增强样品IV的抗炎活性反而使其有所降低;而样品VI的IC50大大低于样品V,说明黄酒多糖作为药引有利于促进腰痛宁中各药物的抗炎作用。
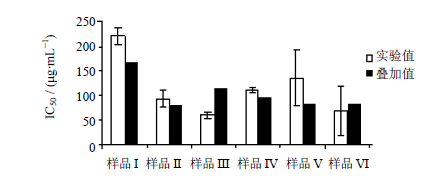 | 图 2 腰痛宁各样品对Ana-1细胞产生PGE2的相互作用关系Fig. 2 Interactions of each sample of YTNC on PGE2 productioninduced by Ana-1 |
由图 3可知,小鼠脾淋巴细胞中产生的IL-2在腰痛宁各样品质量浓度较低时基本保持不变,样品质量浓度达到50 μg/mL后,IL-2产生量逐渐增大,从100 μg/mL开始,样品组与ConA处理组间均有显著差异(P<0.05)。由此可知,腰痛宁各样品在考察质量浓度范围内均可对小鼠脾淋巴细胞有较好的促进IL-2分泌的作用,且在高质量浓度时,促进作用与样品质量浓度呈正相关关系。样品I和III的促进IL-2分泌作用最为明显。各样品的EC50实验值均值、s及EC50叠加值见图 4。
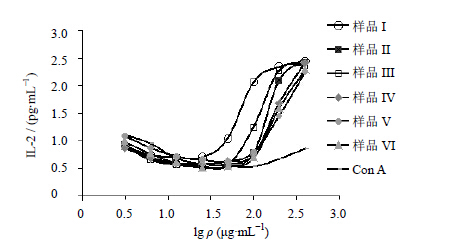 | 图 3 腰痛宁各样品对小鼠脾淋巴细胞产生IL-2的影响 (n=3)Fig. 3 Effectof each sample of YTNC on IL-2 production induced by splenic lymphocytes of mice (n=3) |
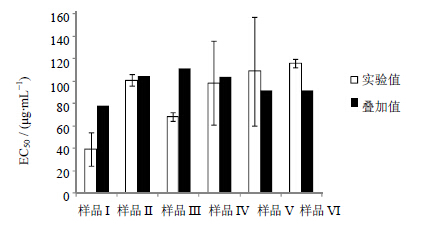 | 图 4 腰痛宁各样品对小鼠脾淋巴细胞产生IL-2的相互作用关系Fig. 4 Interactions of each sample ofYTNC on IL-2 production induced by splenic lymphocytes of mice |
由图 4可知,样品I的EC50实验值+s<其EC50叠加值,表明样品I中的马钱子总生物碱与麻黄总生物碱配伍时,两者相互作用关系呈现协同作用,可更好地促进小鼠脾淋巴细胞产生IL-2。样品II在样品I的基础上,加入了甘草总黄酮,其EC50实验值-s<其EC50叠加值<EC50实验值+s,说明甘草总黄酮与2个生物碱混合物之间产生的作用为简单的叠加作用,对细胞因子IL-2的分泌无增强减弱功能。在样品II的基础上,继续加入皂苷活性部位(甘草总皂苷、川牛膝总皂苷)后组成样品III。样品III的EC50实验值+s<其EC50叠加值,说明活性部位总皂苷与样品II之间产生了较好的协同作用,可显著促进小鼠脾淋巴细胞产生IL-2以增强免疫作用。样品II、样品III结果中的相互作用关系与“3.1”项中LPS诱导Ana-1细胞释放PGE2的模型结果完全一致,进一步为甘草调和诸药的功能主要来自于其皂苷成分的推论提供了依据。样品IV的EC50实验值-s<其EC50叠加值<EC50实验值+s,说明腰痛宁中的挥发油(水提物)在ConA诱导小鼠脾淋巴细胞产生IL-2的模型下,与样品III之间为叠加作用。同样的叠加作用也可见于样品V中,样品V的EC50实验值-s<其EC50叠加值<EC50实验值+s。在样品V中加入腰痛宁胶囊药引-黄酒浓缩物后,样品VI的EC50实验值-s>其EC50叠加值。该数据表明,药引-黄酒的浓缩物与样品V之间产生的主要作用为拮抗作用。在该免疫模型下,黄酒提取物并不能很好地促进脾淋巴细胞分泌IL-2,而是会一定程度上减弱该种细胞产生IL-2的作用。
3.3 腰痛宁各样品对HUVEC细胞产生NO的影响由图 5可知,大部分腰痛宁样品促进人脐静脉内皮细胞HUVEC产生的NO浓度随着样品质量浓度的升高基本呈现稳态模式,但样品III产生NO的浓度先上升,在100 μg/mL时达到最大,后逐渐下降。样品VI对HUVEC细胞产生NO的浓度随着样品质量浓度的上升不断增大。
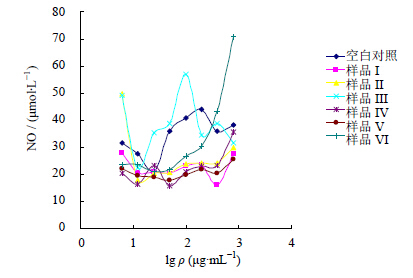 | 图 5 腰痛宁各样品对HUVEC细胞产生NO的影响 (n=3)Fig. 5 Effectof each sample of YTNC on NO production induced by HUVEC (n=3) |
计算各样品的EC50实验值均值、s及EC50叠加值,结果除样品III外,其他5个样品均不存在促进HUVEC产生NO的EC50,样品III含有麻黄总生物碱、马钱子总生物碱、甘草总黄酮、甘草总皂苷、川牛膝总皂苷,并且其EC50实验值+s(15.37±12.81 μg/mL)远小于其EC50叠加值(36.81 μg/mL),说明样品III中的活性部位之间有很强的协同作用。样品IV、样品V、样品VI分别在样品III的基础上加入了挥发油(水提物)类有效部位和多糖类有效部位及黄酒浓缩物,这3个样品没有表现出促进HUVEC细胞分泌NO的作用,说明在样品III基础上加入的这些有效部位与样品III中所含的有效部位产生了很强的拮抗作用,以致样品IV~VI没有促进HUVEC产生NO的活性。
4 讨论尽管腰痛宁中不同活性部位的组合在各模型下显示出不同的相互作用关系,但无论是腰痛宁胶囊的拆方样品Ⅰ~IV、组方样品V还是全方样品VI,在抗炎模型和免疫模型下均有抑制PGE2炎症因子产生和促进IL-2免疫因子分泌的实验IC50/EC50值,说明这些样品均有良好的抗炎和免疫作用,表明了腰痛宁组方的合理性与科学性。
鉴于只有样品III在抗炎、免疫和活血3个模型下均有实验IC50/EC50值,且该样品只有3味药材(马钱子、麻黄、甘草)所对应的总生物碱、总黄酮及总皂苷3个活性部位,其组方比腰痛宁全方要精简得多。综合活血化瘀、抗炎镇痛、增强免疫这些指标的评价结果,样品III是一个备选治疗风湿痹病的良方,以其为基础进一步开展体内药理实验及临床研究,可望研发组方更为精简、疗效好、质量易于控制的风湿痹病新药。
依据中医君臣佐使组方原则,采用药材活性部位进行组合构建样品库开展腰痛宁复方的分子生物学药理研究,可更好地描述中药复方的有效物质基础并消除非活性物质的干扰,有助于组方药物的溶解及细胞实验的开展,为中药复方药效和作用机制的研究提供新思路,基于最小二乘优化评价组方中各活性部位的相互作用对于中药复方作用机制的研究提供了简便可行的路线。
| [1] | 唐·王冰. 黄帝内经素问 [M]. 北京:人民卫生出版社,1963. |
| [2] | 中国药典 [S]. 一部. 2010. |
| [3] | Wang L,Zhou G B,Liu P,et al. Dissection of mechanisms of Chinese medicinal formula Realgar-Indigo naturalis as an effective treatment for promyelocytic leukemia [J]. Proc Natl Acad Sci USA,2008,105(12):4826-4831. |
| [4] | Ma B L,Ma Y M,Yan D M,et al. Effective constituents in Xiexin Decoction for anti-inflammation [J]. J Ethnopharmacol,2009,125(1):151-156. |
| [5] | Lau K M,Lai K K,Liu C L,et al. Synergistic interaction between Astragali Radix and Rehmanniae Radix in a Chinese herbal formula to promote diabetic wound healing [J]. J Ethnopharmacol,2012,141(1):250-256. |
| [6] | 郭瑞珍,于燕妮. 病理学 [M]. 贵阳:贵州科技出版社,1997. |
| [7] | 陈美珺,梁 统,周克元. 原花青素对脂多糖诱导RAW264. 7细胞COX-2酶活性、mRNA及蛋白表达的影响 [J]. 药学学报,2005,40(5):406-409. |
| [8] | 林飞卿. 医学基础免疫学 [M]. 上海:上海医科大学出版社,1992. |
| [9] | 周红宇,陈醒言. 临床药理学与治疗学 [M]. 杭州:浙江大学出版社,2005. |
| [10] | 倪力军,盖 群,陈 露,等. 不同粒径马钱子粉中马钱子碱、士的宁的含量分析与比较 [J]. 华东理工大学学报:自然科学版,2012,38(2):195-199. |
| [11] | 王银亮. 中药挥发油与马钱子生物碱混合物微囊的制备及评价 [D]. 上海:华东理工大学,2013. |
| [12] | Yin W,Wang T S,Yin F Z,et al. Analgesic and anti-inflammatory properties of brucine and brucine N-oxide extracted from seeds of Strychnos nux-vomica [J]. J Ethnopharmacol,2003,88(2):205-214. |
| [13] | 蒋袁絮,闫 琳,余建强. 麻黄碱、伪麻黄碱及其水杨酸衍生物对小鼠中枢神经系统作用的比较 [J]. 中草药,2004,35(11):1274-1277. |
| [14] | 倪力军,王媛媛,何婉瑛,等. 八种多糖的单糖组成、活性测定及其相关性分析 [J]. 天津大学学报:自然科学版,2014,47(4):1-5. |
| [15] | 王媛媛. 腰痛宁胶囊等组方中药材多糖的制备与质量评价 [D]. 上海:华东理工大学,2013. |
| [16] | 孟达理,严士海,许芝银. 麻黄多糖对绵羊红细胞所致小鼠溶血素生成的影响 [J]. 江苏大学学报:医学版,2007,17(5):379-380. |
| [17] | 张立国,闫志慧,陈 露,等. 粒径对甘草粉末中甘草酸、甘草苷的影响 [J]. 中草药,2013,44(23):3328-3333. |
| [18] | 张强组. 中药材黄酮的大孔吸附树脂分离工艺研究及其生产线设计 [D]. 上海:华东理工大学,2013. |
| [19] | 管 燕,谢强敏. 甘草黄酮对肺部炎症小鼠细胞因子表达和氧化反应的调节作用 [J]. 中草药,2009,40(8):1254-1259. |
| [20] | Zhang L G,Fang C Y,Ouyang X W,et al. Simultaneous determination of saponins in Radix Glycyrrhizae,notoginseng and ginseng by high performance liquid chromatography [J]. Trans Tianjin Univ,2013,19(6):430-435. |
| [21] | 方聪颖. 腰痛宁胶囊组方及三七、人参中皂苷的制备、分析与活性评价 [D]. 上海:华东理工大学,2013. |
| [22] | 李开龙,贾昆霞,张建国,等. 甘草酸对实验性梗阻性肾病大鼠的保护作用 [J]. 第三军医大学学报,2001,23(5):573-575. |
| [23] | 王岳五,张海波,吕 杰,等. 甘草残渣中多糖GPS抗肿瘤作用的研究 [J]. 南开大学学报:自然科学版,2000,33(4):46-48. |
| [24] | 高昌琨,高 建,马如龙. 牛膝总皂苷抗炎、镇痛和活血作用研究 [J]. 安徽医药,2003,7(4):248-249. |
| [25] | 张宇明. 牛膝的药理作用研究进展 [J]. 中国医学创新,2009,6(6):112-113. |
| [26] | Zhang L G,Zhang C,Ni L J,et al. Rectification extraction of Chinese herbs' volatile oils and comparison with conventional steam distillation [J]. Sep Pur Technol,2011,7(2):261-268. |
| [27] | 李 霞,杨静玉,孟大利,等. 麸炒北苍术挥发油成分的分析和镇痛活性的研究 [J]. 中草药,2003,34(10):886-887. |
| [28] | Singh G B,Atal C K. Pharmacology of an extract of salai guggal ex-Boswellia serrata,a new non-steroidal anti-inflammatory agent [J]. Agents Actions,1986,18(3/4):407-412. |
| [29] | 李舍予,田报春,张勇刚. 没药挥发油对大鼠神经胶质瘤细胞体外增殖的抑制作用 [J]. 中草药,2009,40(7):1103-1106. |
| [30] | Wang Y,Yan H,Wang Y,et al. Proteomics and transcriptome analysis coupled with pharmacological test reveals the diversity of anti-thrombosis proteins from the medicinal insect,Eupolyphaga sinensis [J]. Ins Biochem Mol Biol,2012,42(8):537-544. |
| [31] | Mazzei de Dàvila C A,Dàvila D F,Donis J H,et al. Sympathetic nervous system activation,antivenin administration and cardiovascular manifestations of scorpion envenomation [J]. Toxicon,2002,40(9):1339-1346. |
| [32] | 张廷模. 临床中药学 [M]. 上海:上海科技出版社,2012. |
| [33] | 王兆铭. 中西医结合治疗风湿类疾病 [M]. 天津:天津科学技术出版社,1989. |
| [34] | 李海瑞,吴希哲,徐韶瑜,等. 海洋真菌多糖 (YCP) 对小鼠淋巴细胞免疫功能的影响 [J]. 中国生化药物杂志,2007,28(2):91-93. |
| [35] | Ni L J,Xu X L,Zhang L G,Shi W Z. Quantitative evaluation of the in vitro effect and inter actions of active fractions in Yaotongning-based formulae on prostaglandin E2 production [J]. J Enthnopharmacol,2014,154:807-817. |
 2014, Vol. 45
2014, Vol. 45


