海巴戟天Morinda citrifolia L. 是一种茜草科(Rubiaceae)巴戟天属Morinda L. 热带常绿多年生阔叶灌木。发源于太平洋南部岛屿,在我国海南、西沙与台湾有野生分布[1],其果实、叶子、枝干、根部均可入药。现代药理实验揭示,海巴戟天具有抗细菌、抗病毒、抗真菌、抗寄生虫、镇痛、降压、消炎和提高免疫力的作用[2]。现已发现,海巴戟天含有7-羟基-6-甲氧基香豆素、萜类化合物、蒽醌类化合物、生物碱、β-谷甾醇、黄酮糖苷、茜素、芸香苷等药用成分,但这些成分与药效的关系未得到证实,含量较多、效果确定的化合物是蒽醌[3]。药用植物中很多有效成分属于植物细胞的次生代谢物,而植物细胞悬浮培养则是高效合成次生代谢物的重要方法,也是实行工业化生产的重要技术手段。目前在国内外有关海巴戟天离体组织培养植株再生[4, 5, 6]和细胞悬浮培养合成蒽醌[7, 8]方面的研究已有报道,取得了一定的进展。
在植物细胞悬浮培养过程中,必须通过添加外源激素来促进细胞的生长和代谢产物的合成[9, 10, 11];而诱导子作为一种特殊的生化信号在植物次生代谢过程中,能快速和有选择地诱导某些特定基因的表达,从而调节细胞中次生代谢产物的合成[12]。本实验通过优化外源激素配比,并向海巴戟天悬浮体系中添加诱导子,以提高次生代谢物蒽醌的量。
1 材料与试剂 1.1 材料海巴戟天Morinda citrifolia L. 采自海南大学农学院试验基地,经海南大学食品学院钟秋平教授鉴定。其愈伤组织通过诱导其叶脉而获得[13]。
1.2 仪器JB—CJ—1FC超净工作台(苏州佳宝净化工程设备有限公司),NRY—200全温培养摇床(上海南荣实验设备有限公司),SYQ—DSX—180B手提式高压蒸汽灭菌锅(上海申安医疗器械厂),723N可见分光光度计(上海精密科学仪器有限公司),RE 52—99旋转蒸发仪(上海亚荣生化仪器厂)。
1.3 试剂B5培养基,青岛日水生物技术有限公司;萘乙酸(NAA)、激动素(KT)、酶水解酪蛋白,美国Sigma公司;1,8-二羟基蒽醌对照品,德国Dr. Ehrenstorfer公司;水杨酸(SA),美国Sigma公司;茉莉酸甲酯,东京化成工业株式会社。
2 方法 2.1 海巴戟天悬浮细胞培养500 mL三角瓶装100 mL液体培养基(B5+2 mg/L NAA+0.2 mg/L KT+4.0%蔗糖+0.1%酶水解酪蛋白+0.05%聚乙烯吡咯烷酮,pH 5.8),接种10 g愈伤组织,于100 r/min、27 ℃暗条件下培养,每10天继代换液1次,共继代培养5代。以此做种子液,500 mL三角瓶装80 mL液体培养基,接种20 mL种子,于100 r/min、27 ℃暗条件下进行悬浮培养,27 d后收获细胞。
2.2 测定方法 2.2.1 悬浮细胞生长量的测定取培养液2 mL,4 ℃下5 000 r/min离心5 min,取上清液测定pH。用蒸馏水洗涤细胞2次,再离心称得细胞鲜质量;将所得细胞置于50 ℃鼓风干燥箱中干燥10~12 h至恒质量,即为细胞干质量。
细胞生长速度以比生长速率计,公式如下:
比生长速率=[(收获细胞鲜质量-接种细胞鲜质量)/接种细胞鲜质量]/培养时间
2.2.2 悬浮细胞中总蒽醌的测定采用醋酸镁-甲醇分光光度法[14]测定。取一定量烘干的细胞研磨成粉末,甲醇浸泡24 h后超声提取40 min,滤过,滤液转移至具塞三角瓶中,减压浓缩至浸膏状,加2 mL蒸馏水超声混匀,加40% FeCl3溶液1.0 mL,沸水浴30 min,再加浓盐酸1 mL,沸水浴加热水解,并不断振摇,30 min后流水冷却至室温,转移至分液漏斗中,另加4 mL蒸馏水洗涤,合并洗液至分液漏斗中。加氯仿萃取2次,每次10 mL,合并萃取液,水洗萃取液至pH值显中性。旋转浓缩至干,残渣加10 mL 1%醋酸镁-甲醇溶液,超声混匀,避光放置30 min,于510 nm处测定吸光度(A)值。以1,8-二羟基蒽醌浓度(X)和A值(Y)制得回归方程,回归方程为Y=0.044 4 X-0.013 6,R2=0.999 3。
2.3 数据处理本试验数据为3个平行实验的平均值,数据以x±s表示。利用SPSS 19.0统计软件进行数据分析,Duncan法进行多重比较,Origin 8.0进行绘图,P<0.05视为差异显著。
3 结果与分析 3.1 外源激素对海巴戟天悬浮细胞生长和代谢产物合成的影响在较低的NAA和KT浓度配比条件下,海巴戟天悬浮细胞分裂较慢,活力较低,培养液呈褐色,细胞的生长速率和蒽醌的合成均受到抑制,这与不添加外源激素的对照组情况相似,且对照组在第10天细胞已全部褐化死亡。在较高的NAA和KT质量浓度配比条件下,悬浮细胞分裂较快,培养液呈黄色,细胞的比生长速率较高,但蒽醌的合成受到抑制,说明底物向生物量转化。综合来看,NAA 2 mg/L、KT 0.1 mg/L和NAA 2 mg/L、KT 0.3 mg/L 2个激素搭配较为适合细胞生长与产物合成,采用NAA 2 mg/L+KT 0.1 mg/L配比,结果见表 1。
| 表 1 不同外源激素质量浓度对海巴戟天悬浮细胞培养的影响 Table 1 Effects of hormones on suspension cell culture of M. citrifolia |
据Stalmn等[15]和Zenk等[16]报道,相比于2,4-D和6-BA,NAA和KT对海巴戟天细胞生长及蒽醌的生物合成有显著的促进作用。Plas等[17]在对海巴戟天细胞悬浮培养体系的研究中也有过类似报道:NAA是合成蒽醌的必要条件。而这可能是因为NAA具有调节蒽醌合成途径相关基因的表达[18]。向红等[19]也利用不同浓度配比的NAA和KT对海巴戟天同属植物巴戟天进行了悬浮培养研究,获得了较好的生物量和蒽醌量。
3.2 海巴戟天悬浮培养细胞生长和蒽醌类物质合成动力学曲线在最适外源激素配比NAA 2 mg/L+KT 0.1 mg/L的B5培养基中,海巴戟天细胞生长及蒽醌合成动态变化见图 1。细胞鲜质量和细胞干质量的动态生长曲线基本一致,都呈“S”型,细胞的生长周期约为30 d。初期生长缓慢,9 d后细胞分裂活跃,开始进入生长对数期,细胞生物量快速增长,至21 d左右生长速度有所降低,27 d达到最大生物量,到30 d悬浮细胞开始出现较多褐化,生物量有下降趋势。海巴戟天悬浮培养细胞中蒽醌的合成与细胞生长有相关性,即蒽醌量的积累随细胞生物量的增加而增加,成相似的曲线。在细胞生物量快速增长的第18天,蒽醌量开始快速增加,至培养27 d时达到最高产量。
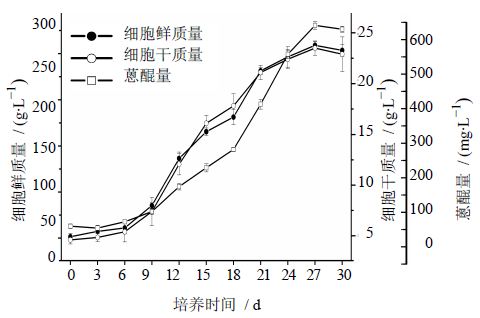 | 图 1 海巴戟天悬浮培养细胞生长和蒽醌合成动力学Fig. 1 Dynamic change of cell growth and anthraquinone content in M. citrifolia suspension cells |
水杨酸是植物体内普遍存在的一种小分子酚类物质,参与调节植物体内的多种生理生化过程[20]。水杨酸在诱导植物产生过敏反应和建立系统获得性抗性中伴有植物抗毒素的产生,从而能够调节植物次生代谢物合成。Komaraiah等[21]证实紫雪花细胞培养中添加乙酰水杨酸和水杨酸类似物能够诱导体细胞胚胎发生和提高白花丹素的积累。另外,Komaraiah等[22]的研究也表明,水杨酸也能刺激海巴戟天蒽醌的积累。水杨酸能够引起小麦幼苗激素水平的变化[23],并能抑制许多植物中乙烯的合成[24],在抵御病原微生物方面起着重要作用[25]。因此,水杨酸与海巴戟天细胞膜受体相互作用,刺激海巴戟天中次生代谢物合成,从而达到增强蒽醌合成的效果。如图 2所示,于第9天添加水杨酸,其浓度在1~100 μmol/L时,海巴戟天悬浮细胞比生长速率随水杨酸浓度的增加有所升高,但幅度不大(小于10%)。当水杨酸浓度大于100 μmol/L,细胞比生长速率下降明显(大于10%)。水杨酸在1~50 μmol/L时,对蒽醌合成的抑制作用明显,水杨酸在100和200 μmol/L时,培养基中蒽醌量比对照分别增加12.9%和17.05%。当水杨酸为500 μmol/L时,细胞在加入水杨酸后逐渐褐化死亡,收获细胞鲜质量仅为对照的33.8%,蒽醌量为对照的42.68%。水杨酸在100~200 μmol/L时,虽然对海巴戟天悬浮细胞生长有所抑制,但对细胞合成蒽醌能力有明显促进作用。因此,200 μmol/L为水杨酸最佳添加浓度。
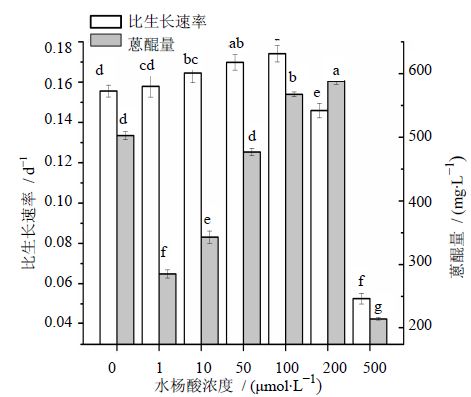 | 不同字母表示差异显著P<0.05 Different lowercase letters indicate significant difference at P < 0.05 图 2 不同浓度的水杨酸对海巴戟天悬浮细胞生长和蒽醌合成的影响Fig. 2 Effects of SA concentration on cell growth and anthraquinone production of M. citrifolia |
茉莉酸甲酯能促进植物细胞防御应答与次生代谢产物合成,其作用已经在很多植物细胞培养中得以证实[26, 27, 28]。茉莉酸甲酯在植物防御反应中起到氧化裂解、激发苯丙氨酸解氨酶的作用,同时也是一种重要的次生代谢合成酶激活剂[22]。如图 3所示,于第9天添加茉莉酸甲酯,其浓度在0~50μmol/L时,海巴戟天悬浮细胞比生长速率随着浓度的增加逐渐降低,细胞生长受到抑制,但较低浓度的茉莉酸甲酯对悬浮细胞蒽醌的合成没有促进作用。当茉莉酸甲酯浓度为50 μmol/L时,悬浮细胞比生长速率为对照的93.4%,蒽醌量达到最高(595.49 mg/L),与对照相比增加了18.47%。茉莉酸甲酯浓度达到100μmol/L时,培养后期,培养基褐化严重,收获的悬浮细胞蒽醌量为对照的72.34%。因此,50 μmol/L为茉莉酸甲酯最佳添加浓度。
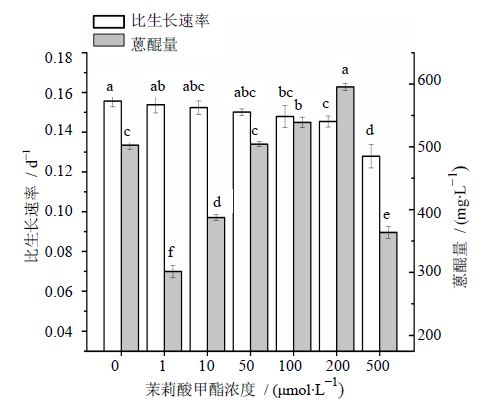 | 图 3 不同浓度的茉莉酸甲酯对海巴戟天悬浮细胞生长和蒽醌合成的影响Fig. 3 Effects of methyl jasmonate concentration on cell growth and anthraquinone production of M. citrifolia |
激素对悬浮细胞生长与产物合成有很大影响,因此在悬浮细胞系建立后,需对液体培养基中的外源激素种类和浓度进行优化,以达到更好的促进细胞生长与次生代谢物的合成。本研究结果表明,NAA 2 mg/L和KT 0.1 mg/L最适于海巴戟天悬浮细胞生长和蒽醌的合成,培养结束后总蒽醌积累量达595.87 mg/L,外源激素浓度过高或过低都会抑制培养液中次生产物蒽醌的积累,这与文献报道[15, 16, 17, 18]结果一致。较高NAA浓度会影响海巴戟天悬浮细胞的分散度,易使细胞聚集成为大块细胞团,并长出不定根,不利于营养物质及氧气的传递,较低NAA浓度则对细胞的增殖作用较小。由此可以推测,通过调节外源激素种类和比例,可提高海巴戟天细胞中蒽醌的量,为其大量积累及未来的产业化提供科学依据。
在植物细胞工程中,水杨酸和茉莉酸甲酯常作为诱导子有目的地进行次生代谢调控和生物合成,进一步促进植物细胞次生代谢物的合成。不同植物细胞对相同诱导子的反应不同,0~100 μmol/L 茉莉酸甲酯对贯叶连翘细胞生长和贯叶金丝桃素产量均有一定的促进作用[29],高浓度的茉莉酸甲酯对黄芩悬浮细胞中黄芩苷的合成有促进作用,但抑制细胞的成长[12]。本研究在优化外源激素的基础上,于海巴戟天悬浮细胞指数生长初期(培养9 d)添加不同浓度的水杨酸和茉莉酸甲酯,结果表明,200 μmol/L的水杨酸和50 μmol/L的茉莉酸甲酯最适于海巴戟天细胞合成蒽醌,产量分别为588.34 mg/L和595.49 mg/L,与对照蒽醌产量相比,分别提高了17.05%和18.47%。这与Klessig等[20]对海巴戟天悬浮细胞蒽醌诱导的研究结果不一致,可能是由于悬浮细胞来源的外植体不同,导致对诱导子的反应有所不同。此外,不同的培养条件也会影响海巴戟天悬浮细胞对诱导子的反应。高浓度的水杨酸和茉莉酸甲酯则会使悬浮细胞逐渐褐化,生物量和蒽醌产量显著降低。水杨酸和茉莉酸甲酯对海巴戟天悬浮细胞蒽醌的生物合成均有诱导作用,但其在信号通路作用的确切机制目前尚不清楚。
| [1] | 中国科学院植物研究所. 中国高等植物图鉴 (第4册). [M]. 北京: 科学出版社, 1994. |
| [2] | Wang M Y, West B J, Jensen C J, et al. Morinda citrifolia (Noni): a literature review and recent advances in Noni research [J]. Acta Pharmacol Sin, 2002, 23(12): 1127-1141. |
| [3] | Srivastava M, Singh J. A new anthraquinone glycoside from Morinda citrifolia [J]. Inter J Pharmacogn, 1993, 31: 182-184. |
| [4] | 黄 骐, 何文锦, 叶冰莹, 等. 海巴戟组织培养研究 [J]. 天然产物研究与发展, 2006(18): 910-913. |
| [5] | 韦丽君, 吕 平, 苏文潘. 海巴戟组织培养及快速繁殖 [J]. 植物生理学通讯, 2006, 42(3): 475. |
| [6] | 陈雄庭, 张秀娟, 王 颖, 等. 海巴戟天的离体快速繁殖 [J]. 热带作物学报, 2007, 28(4): 44-46. |
| [7] | Stalmn M, Koskamp A M, Luderer R, et al. Regulation of anthraquinone biosynthesis in cell cultures of Morinda citrifolia [J]. J Plant Physiol, 2003, 160: 607-614. |
| [8] | Komaraiah P, Kishor P B K, Carlsson M, et al. Enhancement of anthraquinone accumulation in Morinda citrifolia suspension cultures [J]. Plant Sci, 2005, 168: 1337-1344. |
| [9] | 戴梓茹, 黎继烈. 激素对植物细胞悬浮培养代谢产物的影响研究进展 [J]. 中国生物工程杂志, 2007, 27(6): 118-122. |
| [10] | 王 莉, 管江红, 史玲玲, 等. 长鞭红景天细胞悬浮培养体系优化研究 [J]. 中草药, 2012, 43(11): 2272-2278. |
| [11] | 李 蕤, 谭晓芳, 陈 群, 等. 霍山石斛细胞悬浮培养及条件优化 [J]. 中草药, 2011, 42(2): 358-362. |
| [12] | 张进杰, 徐茂军. NO和茉莉酸甲酯对黄芩悬浮细胞生长及黄芩苷合成的影响 [J]. 植物学通报, 2006, 23(4): 374-379. |
| [13] | 张志强,李永成. 海巴戟天愈伤组织诱导及细胞悬浮培养试验 [J]. 广东农业科学, 2014, 41(4): 108-112. |
| [14] | 李玉林, 索有瑞, 王洪伦, 等. 人工栽培唐古特大黄中总蒽醌含量水平的分析 [J]. 天然产物研究与开发, 2006(18): 1020-1022. |
| [15] | Stalmn M, Koskamp A M, Luderer R, et al. Regulation of anthraquinone biosynthesis in cell cultures of Morinda citrifolia [J]. J Plant Physiol, 2003, 160: 607-614. |
| [16] | Zenk MH, EI-Shagi H, Schulte U. Anthraquinone production by cell suspension cultures of Morinda citrifolia [J]. Planta Med, 1975, 28(S 01): 79-101. |
| [17] | Plas L H W, Eijkelboom C, Hagendoorn M J M. Relation between primary and secondary metabolism in plant cell suspensions: competition between secondary metabolite production and growth in a model system (Morinda citrifolia) [J]. Plant Cell Tiss Org, 1995, 43: 111-116. |
| [18] | Hagendoorn J M, Plas H W, Segers G J. Accumulation of anthraquinones in Morinda citrifolia cell suspensions: a model system for the study of interaction between secondary and sprimary metabolism [J]. Plant Cell Tiss Org, 1994, 38: 227-234. |
| [19] | 向 红, 郭 勇. 巴戟天细胞悬浮培养产生蒽醌类物质的研究 [J]. 华南理工大学学报: 自然科学版, 1997, 25(2): 62-67. |
| [20] | Klessig D F, Malamy J. The salicylic acid signal in plants [J]. Plant Mol Biol, 1994, 26: 1439-1458. |
| [21] | Komaraiah P, Jogeswar C, Ramakrishna S V, et al. Acetylsalicylic acid and ammonium-induced somatic embryogenesis and enhanced plumbagin production in suspension cultures of Plumbago rosea L. [J]. In Vitro Cell Develop Biol-Plant, 2004, 40(2): 230-234. |
| [22] | Komaraiah P, Kishor P B, Carlsson M, et al. Enhancement of anthraquinone accumulation in Morinda citrifolia suspension cultures [J]. Plant Sci, 2005, 168(5): 1337-1344. |
| [23] | Shakirova F M, Sakhabutdinova A R, Bezrukova M V, et al. Changes in the hormonal status of wheat seedlings induced by salicylic acid and salinity [J]. Plant Sci, 2003, 164(3): 317-322. |
| [24] | Pierpoint W S. Salicylic acid and its derivatives in plants: Medicines, metabolites and messenger molecules [J]. Adv Bot Res, 1994, 20: 164-235. |
| [25] | Raskin I. Role of salicylic acid in plants [J]. Ann Rev Plant Biol, 1992, 43(1): 439-463. |
| [26] | Sharan M, Taguchi G, Keiichi G, Takashi J, et al. Effects of methyl jasmonate and elicitor on the activation of phenylalanine ammonia-lyase and the accumulation of scopoletin and scopolin in tobacco cell cultures [J]. Plant Sci, 1998, 132: 13-19. |
| [27] | Ketchum R E B, Gibson D M, Croteau R B, et al. The kinetics of taxoid accumulation in cell suspension cultures of Taxus following elicitation with methyl jasmonate [J]. Biotech Bioengin, 1999, 62: 97-105. |
| [28] | Menke F L H, Parchmann S, Mueller M J, et al. Involvement of the octadecanoid pathway and protein phosphorylation in fungal elicitor-induced expression of terpenoid indole alkaloid biosynthetic genes in Catharanthus roseus [J]. Plant Physiol, 1999, 119: 1289-1296. |
| [29] | 王保军, 张秀清, 孙立伟, 等. 茉莉酸甲酯 (MeJA) 对贯叶连翘悬浮细胞生长和贯叶金丝桃素产量的影响 [J]. 植物生理学通讯, 2008, 44(4): 669-672. |
 2014, Vol. 65
2014, Vol. 65



