2. 中国医学科学院, 北京协和医学院药用植物研究所, 濒危药材繁育国家工程实验室, 北京 100193
2. National Engineering Laboratory for Breeding of Endangered Medicinal Materials, Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
板蓝根和大青叶是我国传统中药材,具有清热解毒、凉血利咽作用,《中国药典》2010年版规定两者来源均为十字花科植物菘蓝Isatis indigotica Fortune[1],然而在Flora of China(2001)[2]中,我国的菘蓝已被并入欧洲菘蓝I. tinctoria L.,原因是两者在形态上具有多样性,存在种间过渡,不应作为2个独立的物种。我国菘蓝初见于《新修本草》[3],分布于全国各地,具有悠久的栽培药用历史,主产于河北、安徽等省,而欧洲菘蓝产于中、南欧洲和中、西亚洲。那么我国传统大宗药材板蓝根和大青叶的原植物到底是菘蓝还是欧洲菘蓝,是否为一个物种?它们的遗传背景如何,尚需进一步从分子水平进行研究。
近年来,随着非典、禽流感、甲型HIN1流感等一系列流行病的爆发,清热解毒类中药一度成为人们关注的热点,对于板蓝根、大青叶的各方面研究特别是有效成分及药理活性的研究日益深入[4]。明确其物种来源以及深入了解其种质资源的遗传背景,对菘蓝的品种改良以及生产实践无疑具有重要意义[5]。
基于PCR技术的简单序列重复区间扩增ISSR(intersimple sequence repeat),在众多的分子标记中具有稳定、多态性高、操作简单、成本低等优点[6, 7],目前已在多种动植物的亲缘关系、种质鉴定、遗传作图、基因定位、遗传多样性等研究方面得到应用[8, 9, 10, 11]。利用ISSR分子标记研究菘蓝的遗传多样性目前尚未见深入系统报道,本研究选用ISSR标记技术探讨菘蓝在DNA水平上的差异,分析其种质资源遗传多样性,从而为其种质鉴定、亲缘关系分析、育种及合理开发利用提供重要参考。
1 材料和方法 1.1 材料从全国7个省和直辖市采集菘蓝样本共计23份。取新鲜叶片,硅胶干燥保存备用。供试样品来源见表 1,经山东中医药大学周凤琴教授初步鉴定,除EJ03外,其余均为菘蓝或其变异类型。
| 表 1 材料及来源 Table 1 Sources of materials |
Retsch MM400 DNA提取研磨仪(德国),Sigma—1—14型小型台式离心机(德国),HH—2型数显恒温水浴锅(国华电器有限公司),PTC0200 PCR仪(BIO-RAD公司),DYYIII型电泳仪(北京六一仪器厂),凝胶紫外成像系统(BIORAD),ICE MAKER SIM—F140型SANYO制冰机。
植物DNA提取试剂盒(Tiangen Biotech Co.,中国),dNTP、TaqDNA聚合酶(北京赛百盛有限公司)、引物(参照加拿大哥伦比亚大学UBC公司2006年公布的ISSR引物序列,由上海Sangon合成)、DL2000 Marker(大连赛恩斯公司)、琼脂糖、EB(上海Sangon公司),其余试剂均为分析纯。
1.3 DNA的提取取样约10 mg,用DNA提取研磨仪研磨1 min(30次/s)后,利用植物DNA提取试剂盒提取总DNA。
1.4 PCR扩增及产物检测反应体系为25 μL:模板DNA 1.0 μL(约30 ng),1.0 μL引物(10 μmol/L),2.5 μL PCR 缓冲液(10×)(Mg2+),Mg2+ 2 μL(25 mmol/L),dNTPs混合物2 μL(2.5 mmol/L),Taq DNA聚合酶1.0 U,加灭菌双蒸水至25 μL。反应程序:94 ℃ 5 min;94 ℃0.5 min,55 ℃ 1 min,72 ℃1.5 min,35个循环后于72 ℃延伸10 min,扩增完成后置于4 ℃保存。扩增产物于1.5%琼脂糖(内含1 μg/mL EB)凝胶电泳检测(5 V/cm,1~2 h),用DL2000 Marker作相对分子质量标记,观察记录结果,分析扩增谱带。
1.5 数据分析及品种的鉴定每一条引物均重复扩增、电泳3次,选取稳定清晰的条带进行统计分析。电泳图谱的每条带(DNA片段),均为一个分子标记,代表一个引物的结合位点。根据分子标记的迁移率及其有无统计所有的二元数据,“有”赋值为“1”(包括强带和重复性好的弱带),“无”赋值为“0”,从而得到原始数据矩阵,计算多态性条带比率,用NTSYS-pc软件(Version 2.00)计算各品种间的Jaccard遗传相似系数,按非加权配对算术平均法(UPGMA)建立各品种间的聚类图。
2 结果 2.1 ISSR扩增多态性分析从50个加拿大哥伦比亚大学(UBC)设计的引物9#系列筛选出10个能扩增出清晰且具多态性条带的引物,用以对23份菘蓝及其变异类型进行扩增,结果扩增出109个条带,扩增条带长度范围多集中在250~1 000 bp(图 1)。其中多态性条带为88条,占总扩增条带数的80.7%,见表 2。
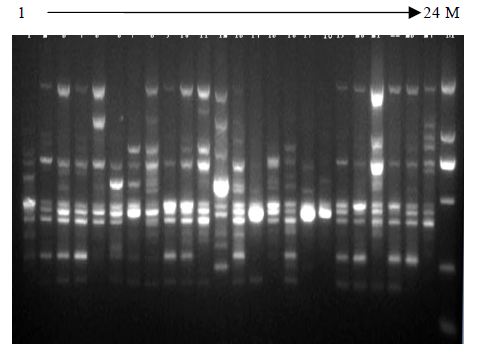 | 图 1 引物UBC855扩增的ISSR带谱Fig. 1 ISSRbandsamplified by Primer UBC855 |
| 表 2 ISSR分析所用引物及其扩增结果 Table 2 Primers used for ISSR and amplified results |
由基于ISSR扩增结果构建的UPGMA聚类图(图 2)看出,以甘蓝型油菜(EJ03)为外类群,所研究菘蓝及其变异类型23份样本被明显聚为3支,其中江苏省中国科学院植物研究所药用植物园的2份样本在遗传相似度0.62处左右即被分开,与其他样本距离较远,为第III支;第II支为采自中国医学科学院药用植物研究所的2样本(叶片被毛);而第I支所包含样本最多,来自于8个不同地区,其中LX04和LX06、LM01和LM04、LZ01和LZ05、AG01和AG02、EJ01和EJ11、ZY01和ZY02,同一产地的样本均最早聚在一起。
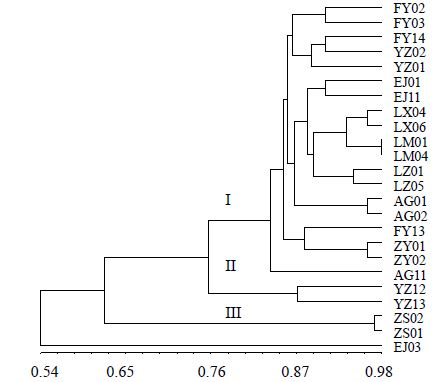 | 图 2 不同产地菘蓝基于ISSR分析数据的聚类图Fig. 2 Cluster dendrogram of I. indigotica and its variation from different habitsts based on ISSR data |
关于板蓝根与大青叶的原植物问题,长期以来国内外植物分类学界和药学界对此存有争议。通过王希平等[12]对菘蓝学名的考证认为欧洲菘蓝I.tinctoria非我国原产,而我国原产的菘蓝应是I. indigotica;欧洲菘蓝和菘蓝2个种之间过去有混淆,并将后者误认为前者的变种,即I. tinctoria L. var. indigotica Cheo et Kuan。乔传卓等[13]的研究表明:菘蓝和欧洲菘蓝不仅在外部形态,而且在染色体数、花粉形态及同工酶和可溶性蛋白的生化特征等方面均有明显的差异。本研究发现来自全国不同地区(包括主产区河北和安徽)的菘蓝及其变异类型基本为一大类群,而采自江苏植物研究所药用植物园的2样本与其余样本距离较远,从遗传相似度0.62处即被分开,表明应为一独立类群,后调查发现,该样本确为引种的欧洲菘蓝[14],此结果与本课题组基于DNA条形码研究结果一致。
来自安徽太和县李兴镇、山东济南市力明学院、河南原阳县路寨乡、中国药科大学、上海第二军医大学、河北安国(小叶型),同一产地的样本均最早聚在一起,表明居群内变异要小于居群间变异,但也有例外,研究发现来自中国医学科学院药用植物研究所药用植物园的YZ12与YZ13两样本,与大多数样本距离较远,在相似度0.76处被分开,这2样本外形上叶片较绿,被有明显的毛,通过DNA条形码研究发现,二者核ITS2序列碱基有杂合现象,推断可能发生了基因流现象,因为在同一块样地里,也引种过欧洲菘蓝。此外,采自安徽阜阳的几个样本彼此并未聚在一起,这是因为所取样本来自安徽阜阳广州白云山板蓝根种植基地的种质园的育种研究基地,目前园内来源比较复杂;取自河北安国的3个样本,其中2个小叶型的聚在一起,而大叶型关系较远,据谢晓亮等[15]报道,小叶板蓝根质量要优于大叶板蓝根,二者种源具有明显的遗传变异。
菘蓝在我国栽培历史悠久,分布广泛,通过分析菘蓝不同产地样本的ISSR扩增多态性,发现菘蓝种质资源具有较丰富的遗传多样性,特别是与其近缘种欧洲菘蓝种间有效地杂交渐渗,可以极大的丰富其生物多样性,为其良种选育及资源开发提供了重要的物质基础。ISSR作为一种分子标记,能较好地反映菘蓝不同居群的遗传多样性,因而可以更好地指导菘蓝种质资源的品种选育与合理开发利用。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | Zhou T Y, Lu L L, Yang G, et al. Brassicaceae [A]//Wu Z Y, Raven P H, et al. Flora of China [M]. Beijing: Science Press; St. Louis: the Missouri Botanical Garden Press, 2001. |
| [3] | 楼之岑, 秦 波. 常用中药材品种整理和质量研究 (北方编) 第一册 [M]. 北京: 北京医科大学出版社, 1995. |
| [4] | 林子君, 刘晓秋, 韩 娜, 等. 板蓝根的化学成分研究 [J]. 现代药物与临床, 2011, 26(5): 381-383. |
| [5] | 陈士林, 肖培根. 中药资源可持续利用导论 [M]. 北京: 中国医药科技出版社, 2006. |
| [6] | Zietkiewicz E, Rafalski A, Labuda D. Genome finger- printing by simple sequence repeats (SSR) anchored polymerase chain reaction amplification [J]. Genomics, 1994, 20(2): 176. |
| [7] | 王明明, 宋振巧, 王建华. ISSR 标记技术及其在药用植物遗传育种中的应用 [J]. 中草药, 2007, 38(1): 134-137. |
| [8] | 阳 翠, 刘 萍, 刘姣蓉, 等. 苦豆子ISSR标记的遗传多样性分析 [J]. 中草药, 2013, 44(10): 1323-1327. |
| [9] | 卢家仕, 卜朝阳, 吕维莉, 等. 不同产地石斛属种质资源的ISSR遗传多样性分析 [J]. 中草药, 2013, 44(1): 96-100. |
| [10] | 罗 群, 马丹炜, 王跃华. 川乌遗传多样性的ISSR 鉴定 [J]. 中草药, 2006, 37(10): 1554-1557. |
| [11] | 周延清, 景建洲, 李振勇, 等. 怀区地黄遗传多样性的ISSR鉴定 [J]. 中草药, 2005, 36(2): 257-261. |
| [12] | 王希平, 周太炎. 菘蓝学名的考证 [J].中草药, 1982, 13(11): 37-38. |
| [13] | 乔传卓, 崔 熙. 菘蓝和欧洲菘蓝的鉴别研究 [J]. 植物分类学报, 1984, 22(3): 237. |
| [14] | 张丽萍, 王 斌, 任小峙, 等. 安徽亳州板蓝根种质资源的调查研究 [J]. 中国中药杂志, 2004, 29(12): 1127-1130. |
| [15] | 谢晓亮, 温春秀, 吴志明, 等. 不同板蓝根种质比较研究 [J]. 华北农学报, 2007, 22(增刊): 126-130. |
 2014, Vol. 64
2014, Vol. 64


