唇形科(Lamiaceae)大青属Clerodendrum L. 植物约400种,主要分布于热带和亚热带,少数分布于温带地区[1, 2, 3],中国产33种,大多分布于西南、华南地区[4]。在中国,大青属植物多为民族药用植物,具有清热解毒、祛风除湿、活血散瘀、降压、抗炎镇痛等功效,常用于治疗感冒高热、风湿性关节炎、跌打损伤、高血压、痈疽、疔疮等疾病[5, 6]。在赣、湘、鄂、浙、粤等省民间广泛使用的大青叶,原植物为大青C. cyrtophyllum Turcz.,具明显抗炎作用[7]。此外该属植物很多种的花型奇特,作为观赏植物驯化栽培的有灰毛大青C. canescens Wall.、重瓣臭茉莉C. chinense (Osbeck) Mabb.、垂茉莉C. wallichii Merr.、海州常山C. trichotomum Thunb.、臭牡丹C. bungei Steud. 等[8, 9, 10],从国外引进栽培的有龙吐珠C. thomsoniae Balf. f. 、红萼龙吐珠C. speciosum W. Bull、烟火树C. quadriloculare (Blanco) Merr.、艳赪桐C. splendens G. Don等[11, 12]。可见该属植物作为观赏及重要的中药材资源,具有巨大的开发潜力。
目前,中药资源开发利用普遍存在混淆品和伪品影响药材品质的问题,而大青属很多植物种间外观形态差异不显著,同样存在仅通过营养器官难以区分的难点。随着现代分子生物学的发展,DNA分子标记技术在药用植物真伪鉴定、品种分类及优良种质选育等方面有着很好的应用前景。一方面利用该技术可揭示药用植物“道地性”可能存在的遗传变异规律,从而指导道地性药材的科学栽培、繁育与采集;另一方面,将分子标记技术所揭示的大分子多态性与小分子药用成分的分布规律紧密结合起来,也可指导药用成分的方便、快速、正确的寻找与开发利用[13]。在众多分子标记中,SSR(simple sequence repeat)标记由于其稳定性、共显性遗传、多态性高、分析简单等优点,作为一种重要的分子标记技术,已广泛应用于DNA指纹识别、遗传多样性分析、遗传图谱的构建等遗传学研究。SSR标记的获取一般需要大量的DNA序列作为基础,然而普遍认为SSR引物在近缘种间具有一定的通用性[14, 15, 16],因此,对遗传学研究基础较弱的物种,近缘物种转移法已成为一种简便快速获得SSR标记的有效方法。本研究旨在充分利用已经报道的伊豆大青C. izuinsulare 和海州常山C. trichotomum 2种植物的SSR引物[17],在国内大青属几个主要种中筛选具有通用性的SSR标记,通过建立在SSR标记基础上的DNA指纹识别技术,寻找稳定高效的大青属近缘物种的分子鉴别手段。
1 材料及总DNA的获得材料为大青属的9个本土树种,样品均为野生异地保存于江西省林业科学院中药圃的植物资源,经江西省林业科学院朱培林研究员鉴定确认,采集幼嫩梢叶置于冰壶内带回实验室备用,树种产地信息见表 1。总DNA提取采用SDS法[18, 19],各树种随机选取5个单株相同浓度的DNA样品等量混合,作为代表该树种的DNA样本[20, 21]。
| 表 1 材料 Table 1 Experimental materials |
10 μL PCR反应体系包含:1×缓冲液,Mg2+ 2.5 mmol/L,dNTPs 0.2 mmol/L,引物2.5 pmol,Taq酶1 U,DNA 10~20 ng。筛选引物的PCR扩增反应程序采用Touch-down PCR:94 ℃3 min;94 ℃30 s,60 ℃30 s,72 ℃30 s,20个循环;再进入94 ℃30 s,50 ℃30 s,70 ℃30 s,20个循环;最后72 ℃延伸10 min。种间PCR扩增程序:94 ℃2 min;94 ℃30 s,退火30 s(不同引物退火温度不同),72 ℃60 s,30 循环;72 ℃10 min。SSR-PCR产物采用8%的聚丙烯酰胺凝胶电泳检测。
2.2 数据统计和处理采用在相同迁移率位置上有带记为“1”,无带记为“0”的读带方法,建立原始数据库,并用Popgene 3.2分析软件对统计数据进行遗传分析[22],从而获得各物种间遗传距离和相似性系数矩阵。选用遗传距离数据矩阵利用NTSYS-pc 2.1软件按不加权成组配对法(UPGMA)进行聚类分析[23],建立亲缘关系树状图。
3 结果与分析 3.1 SSR引物的通用性比较本研究所用SSR引物中由伊豆大青C. izuinsulare开发的有10对,由海州常山开发的为9对,共19对[17]。经PCR扩增检测,不同树种和这些引物的扩增成功率存在一定差异(表 2),其中17对引物均可在广布种大青中扩增出清晰稳定的带型,比率最大为89.5%,而臭牡丹能扩增比率最小,为57.9%,其他大部分种能扩增比率为75%左右。有7对引物能够在所有供试大青属植物中扩增出清晰稳定的带型,占所用引物的36.8%,扩增等位基因数为3~5个(表 3)。7对引物中,引物CT040、CT042具通用性,海州常山的引物通用比率为22.2%,其他5对引物来自伊豆大青C. izuinsulare,其引物通用比率为50%。7对引物中引物CT040表现为单态性,其他6对引物多态性较好,部分引物的电泳图见图 1。
| 表 2 9种大青属植物的扩增结果 Table 2 Results of cross-species amplification of nine species from Clerodendrum L. |
| 表 3 通用性的引物 Table 3 Transferability microsatellite primers |
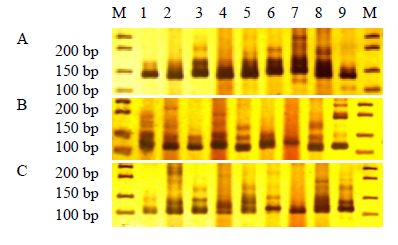 | 图 1 引物CI107 (A)、CI132 (B)、CI142 (C) 在9种大青属植物DNA样品中的扩增结果Fig. 1 Bandingpatterns of SSR marker CI107 (A),CI132 (B),and CI142 (C) amplified on DNAsample of nine Clerodendrum L. species |
由表 3中6对有多态性的引物对9个大青属树种供试样品PCR扩增结果(图 1)建立原始数据库,采用Popgene 3.2软件统计数据,9个种的Shannon’s多样性指数为1.152 3,Nei’s基因多样度为0.266 9,9种大青属植物的遗传距离在0.239 8~1.892 6,相似系数在0.150 7~0.786 8(表 4),白花灯笼和赪桐间遗传距离最大,为1.892 6;大青和海通之间的遗传距离最小,为0.239 8。
| 表 4 根据SSR分析的大青属9个种间的遗传距离 (下) 和相似系数 (上) Table 4 Genetic distance (down) and genetic similarity (up) of nine speeies of Clerodendrum L. based on SSR analysis |
以遗传距离矩阵为分析对象,利用NTSYS-pc 2.1软件按不加权成组配对法(UPGMA)进行聚类分析,建立大青属9个树种间的亲缘关系树状图(图 2)。
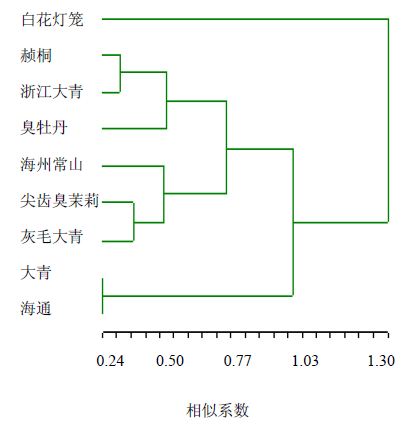 | 图 2 基于SSR标记的9个大青属树种UPGMA系统树Fig. 2 UPGMA dendrogram of nine wild species of Clerodendrum L. based on SSR markers |
从聚类结果来看,遗传距离等于0.50时可将9个树种分为4个组,海通和大青显示最近的亲缘关系组成一组,臭牡丹、赪桐和浙江大青聚成一组,海州常山、尖齿臭茉莉和灰毛大青聚成另一组,而白花灯笼自成一组。
3.3 DNA指纹识别分析SSR标记构建的指纹图谱可作为大青属种间区别的参考。根据多态引物扩增的电泳结果,以6个SSR标记构建大青属9个树种的指纹图谱,由表 5可见,引物CI140多态性最为丰富,可一次性鉴定除白花灯笼与尖齿臭茉莉之外的7个树种,此外引物CI132与CT042可分别一次性将白花灯笼与其他树种区分开,而引物CI107和CI143可各自将尖齿臭茉莉和其他树种区别开,故可用以上5对引物进行两两组合将所有供试的9个树种区分开。
| 表 5 大青属部分种6个SSR标记的指纹图谱 Table 5 Six SSR fingerprints of some wild species in Clerodendrum L. |
SSR引物的通用性在一定程度上依赖于近缘物种之间 SSR 侧翼序列的保守性和进化过程中SSR的稳定性。SSR两端的侧翼序列在生物的基因组中特别是在亲缘关系比较近的种间具有不同程度的保守性,许多研究表明微卫星侧翼序列在属内种间和亲缘关系较近的属间是相当保守的,且表现出亲缘关系越近其通用性越高[24]。本研究使用的19对引物都是通过磁珠富集法开发的gSSR标记[17],共有7对有通用性,属内不同种间通用性比率为36.8%,通用性比率相对较高,从另一个侧面也能反映供试树种亲缘关系较近。另外,分子标记SSR普遍存在侧翼序列保守的现象,在属内不同种间引物通用性仍有较大差别[25]。总之,来至日本伊豆群岛的特有种C. izuinsulare开发的引物中虽然有5对能在9个树种中得到很好的扩增,而海州常山所开发引物仅有2对具有很好的通用性,但对两者不具通用性的引物进行比较,相比由海州常山所开发引物能在9个树种的大部分种得到扩增,由C. izuinsulare开发的5对不具通用性引物,只在极个别供试树种间得以扩增,仅通过本实验还不足以判断上述2树种引物的通用性高低。此外,由海州常山开发的标记CT021和CT041在本实验用本种个体尚未能扩增出条带,有待今后通过更多的本种个体来验证以上2对引物是否可用。
供试9种大青属植物在属下等级分属于腋序系Ser. Axilliflorae schauer(白花灯笼)、密序系Ser. Densiflora schauer(灰毛大青、尖齿臭茉莉、臭牡丹)、疏序系Ser. Paniculata schauer(海州常山、浙江大青、海通)、鳞叶系Ser. Squamata schauer(赪桐)和垂序系Ser. Penduliflorae schauer(大青)[4]。Yuan等[26]使用4个进化速率较快的叶绿体DNA区域trnT-L、trnL-F、trnD-T、trnS-fM研究了大青属产自亚洲的16个种和1个亚种的系统发育关系,密序系形态很接近的臭牡丹和尖齿臭茉莉2个种聚类在一起,但也将密序系灰毛大青和垂序系大青聚类在一起,将腋序系白花灯笼和疏序系海州常山聚类在一起。可见,大青属属下等级的分子系统研究和其形态学分类存在一定差距。本研究中,利用Nei’s遗传距离进行UPGMA聚类,分析结果能很好地把属于腋序系的白花灯笼和其他种区分开,显示该种与其他系树种有较远的亲缘关系,而垂序系的大青属于灌木,它和疏序系属于高大乔木的海通聚到了一起,遗传距离为0.239 5,表现出最为接近的亲缘关系;同时,属于密序系的灰毛大青和尖齿臭茉莉也聚集在一起,但属于疏序系的海州常山和它们显示关系较近,这与海州常山和灰毛大青都有宿萼宽大且变成鲜红色的表型特点一致;此外,属于疏序系的浙江大青和鳞叶系的赪桐(其花序也是属于疏序)聚到了一起。总之,采用CI107、CI132、CI140、CI143和CT042标记进行两两组合均可将所有供试的9个树种区分开,研究结果为今后森林药材的甄别奠定了技术基础,而由于受供试样品个体数、物种数及引物数量等的限制,本研究基于SSR的大青属属内种间亲缘关系分析仅能反应部分物种的种间关系,其中分子数据与形态分类差别最大的是疏序系,初步分析作为属下等级它很可能不是个自然类群。
| [1] | 梁汉兴, 彭 华. 广义马鞭草科花器官发生研究 [J]. 植物学报, 2001, 43(7): 673-679. |
| [2] | Dorothy A S, Rogier P J K, Richard G O. Phylogenetic relationships between Clerodendrum L. (Lamiaceae) and other Ajugoid genera inferred from nuclear and chloroplast DNA sequence data [J]. Mol Phylog Evol, 2004, 32(1): 39-45. |
| [3] | 杨金宏, 孔卫青. 基于rbcL和matK序列探讨马鞭草科部分植物的系统学位置 [J]. 热带亚热带植物学报, 2013, 21(2): 116-122. |
| [4] | 中国科学院中国植物志编辑委员会. 中国植物志 (第65卷) [M]. 北京: 科学出版社, 1982. |
| [5] | 敏 如, 星 炜. 中国民族药志要 [M]. 北京: 中国医药科技出版社, 2005. |
| [6] | 刘时乔, 周福军, 高 贤, 等. 大青属常见药用植物的研究进展 [J]. 药物评价研究, 2011, 34(6): 469-473. |
| [7] | 吴明美, 王利勤, 华 燕. 大青属植物的化学成分及药理作用研究进展 [J]. 化学工程与装备, 2011, 42(4): 112-116. |
| [8] | 郝洪波. 优良的园林植物臭牡丹 [J]. 中国花卉盆景, 2008, 30(10): 16. |
| [9] | 庄茂长. 奇特可爱的怪花—海州常山 [J]. 园林, 1995, 30(5): 9. |
| [10] | 邓绍勇, 朱培林, 贺义昌, 等. 基于logistic模型的灰毛大青播种苗生长规律 [J]. 林业科技开发, 2013, 27(4): 58-60. |
| [11] | 兑宝峰. 栩栩如生的龙吐珠 [J]. 花木盆景, 2001, 30(11): 27. |
| [12] | 杨 勇, 赖永超, 刘 楠, 等. 艳桢桐的生态生物学特征 [J]. 安徽农业科学, 2010, 38(19): 1004. |
| [13] | 傅荣昭, 邵鹏柱, 高文远, 等. DNA分子标记技术及其在药用植物研究上的应用前景 [J]. 生物工程进展, 1998, 18(4): 14-17. |
| [14] | 胥 猛, 李火根. 鹅掌楸 EST-SSR引物开发及通用性分析 [J]. 分子植物育种, 2008, 6(3): 615-618. |
| [15] | Selvadurai D, Bawa K S, Rick K. Conservation of microsatellites among tropical trees (Leguminosae) [J]. Am J Bot, 1997, 84(12): 1658. |
| [16] | Claire A, Maurizio R, Jody M, et al. The application of SSRs characterized for grape (Vitis vinifera) to conservation studies in Vitaceae [J]. Am J Bot, 2002, 89(1): 22-28. |
| [17] | Leiko M, Shingo K, Masami H, et al. Development of nuclear SSRs for the insular shrub Clerodendrum L. izuinsulare (Verbenaceae) and the widespread C. trichotomum [J]. Am J Bot, 2011, 98(11): 333-336. |
| [18] | Edwards K, Johnstone C, Thompson C. A simple and rapid method for the preparation of plant genomic DNA for PCR analysis [J]. Nucl Acids Res, 1991, 19(6): 1349. |
| [19] | 顾红雅. 植物分子生物学: 实验手册 [M]. 北京: 高等教育出版社, 1998. |
| [20] | 王铁固, 陈彦惠, 吴连成, 等. 利用若干单株混合提取DNA方法进行玉米群体SSR的分析 [J]. 华北农学报, 2005, 20(1): 6-11. |
| [21] | 罗永聪. 多花黑麦草品种 (系) 农艺性状综合评价及SSR指纹图谱构建 [D]. 成都: 四川农业大学, 2013. |
| [22] | Yeh F C, Boyle T J B. Population genetic analysis of co-dominant and dominant markers and quantitative traits [J]. Belg J Bot, 1997, 129(10): 157-159. |
| [23] | Yao Q R, Zhao C Z, Wang W Q. Analysis of genetic relationship of Hainan Litchi germplasm resources by SSR marker [J]. Bull Bot Res, 2009, 29(5): 628-632. |
| [24] | 钟 敏, 程须珍, 王丽侠, 等. 绿豆基因组SSR引物在豇豆属作物中的通用性 [J]. 作物学报, 2012, 38(2): 223-230. |
| [25] | Gong L, Stift G, Kofler R, et al. Microsatellites for the genus Cucurbita and an SSR-based genetic linkage map of Cucurbita pepo L [J]. Theoreti Appl Genet, 2008, 117(1): 37-48. |
| [26] | Yuan Y W, Mabberley D J, Dorothy A S, et al. Further disintegration and redefinition of Clerodendrum L. (Lamiaceae): implications for the understanding of the evolution of an intriguing breeding strategy [J]. Taxon, 2010, 59(1): 125-133. |
 2014, Vol. 63
2014, Vol. 63


