2. 苏州大学药学院, 江苏 苏州 215123;
3. 铜仁市人民医院 药学部, 贵州 铜仁 554300
2. College of Pharmacy, Suzhou University, Suzhou 215123, China;
3. Department of Pharmacy, Tongren City People's Hospital, Tongren 554300, China
恶性肿瘤是目前危害人类生命健康的严重疾病之一,严重威胁着人类的生存和健康。肝癌是最常见的恶性肿瘤之一,我国每年死于肝癌的人数约为11万,占全世界肝癌死亡人数的45%[1]。手术切除一直是治疗肝癌的首选方法,但肝癌的总体手术切除率仅有20%左右,术后生存率也不高,容易复发和转移,难以实现根治。化疗在肿瘤的治疗中占有极其重要的地位,但其毒副作用和耐药现象限制了化疗药物的应用。故临床上急需开发高效、低毒或作用于新靶点的药物。中药因其毒副作用小,更易于被患者所接受等特点,在抗肿瘤药物中占有重要地位。
白头翁为毛茛科(Ranunculaceae)植物白头翁Pulsatilla chinensis (Bunge) Regel. 的干燥根,别名野丈人、粉草、毛姑杂花、老公花、大将军草、大碗花、老冠花(山东)等,生于山野、荒坡及田野间,喜生向阳处[1]。白头翁皂苷D为白头翁中提取的活性成分,有研究表明白头翁皂苷D有抗肿瘤作用[2],能明显抑制人结肠癌细胞的增殖[3],Son等[4]通过实验证明白头翁皂苷D通过下调Bcl-2、VEGF、HIF1α的表达,上调Caspase-3的表达引起胰腺癌系PANC-1、MIAPaCa-2、BXPC-3、AsPC-1和HPAC细胞的凋亡。Won等[5]发现白头翁皂苷D通过c-Met/Akt/mTOR通路诱导胃癌细胞MKN-45的凋亡,发挥其抗肿瘤作用。本实验对白头翁皂苷D的体外抗肝癌作用进行了初步研究,并进一步探讨其机制,为更好地开发利用白头翁提供实验依据。
1 材料 1.1 试药与试剂白头翁皂苷D[常春藤皂苷元3-O-α-L-吡喃鼠李糖-(1→2)[β-D-吡喃葡萄糖-(1→4)]-α-L-吡喃阿拉伯糖苷],由苏州大学天然药物化学教研室提供,质量分数>95%;5-氟尿嘧啶(5-FU),上海旭东海普药业有限公司生产,批号120603;RPMI 1640培养液、小牛血清(NBS,美国Gibco公司);注射用硫酸链霉素(大连美罗大药厂);注射用青霉素钠(华北制药股份有限公司);二甲基亚砜(DMSO)、胰蛋白酶(Amersco公司);四甲基偶氮唑盐(MTT)(美国Biosharp公司)。
1.2 细胞株人肝癌细胞株BEL-7402购于中国科学院上海细胞库。
1.3 仪器BB—15型二氧化碳培养箱(德国Thermo Scientific公司);KA—1000型飞鸽牌台式离心机;X85—2恒温磁力搅拌器(上海梅颖浦仪器有限公司);SW—CJ—2D型双人单面净化工作台(苏州净化设备有限公司);XDS—1A型倒置式生物显微镜(重庆光电仪器总公司);Eclipse TE2000—U型倒置荧光显微镜(日本Nikon公司);Thermo MULTISKAN FC型酶标仪(德国Thermo Scientific公司);WD—9405B型水平摇床(沃德生物医学仪器公司);THS—10电热恒温水槽(宁波天恒仪器厂);低温高速离心机(湘仪离心机仪器有限公司);BSA223S电子天平[赛多利斯科学仪器(北京)有限公司]。
2 方法 2.1 细胞培养从液氮罐中取出BEL-7402细胞冻存管,迅速置于37 ℃恒温水浴中解冻,离心去除冻存液,加入已配制的含10% NBS的RPMI 1640培养液,吹打均匀并移至细胞培养瓶中,于37 ℃、5% CO2的饱和湿度孵箱中静置培养。次日换液,3~4 d传代,取对数生长期细胞用于实验。
2.2 MTT实验收集对数生长期BEL-7402细胞,用含10% NBS的RPMI 1640培养基调整细胞悬液浓度至1×105/mL,接种于96孔板中,每孔加入100 μL细胞悬液,置于5% CO2、37 ℃培养箱中培养24 h使细胞贴壁完全。次日分组,对照组正常培养,给药组给予白头翁皂苷D(终质量浓度分别为1.562 5、3.125 0、6.250 0、12.500 0、25.000 0、50.000 0 μg/mL),每个质量浓度均设3个复孔,另设5-FU(25 μg/mL)阳性对照组,药物分别与细胞作用24、48、72 h,终止培养前4 h加入MTT(5 mg/mL),10 μL/孔,培养结束后弃去上层液体,每个复孔加入100 μL DMSO溶液,于摇床上振摇10 min使结晶充分溶解,采用酶标仪检测490 nm处各孔吸光度(A)值。取其均值计算药物对细胞的增殖抑制率,并求其半数抑制浓度(IC50)值,重复3次实验。
增殖抑制率=1-A给药组 / A对照组
2.3 细胞形态观察取对数生长期BEL-7402细胞,用含10% NBS的RPMI 1640培养基调整细胞浓度为5×104/mL于6孔板中,37 ℃、5% CO2条件下培养过夜,次日进行分组:给药组加入白头翁皂苷D(终质量浓度为6.25、12.50、25.00 μg/mL),阳性组加入5-FU(25 μg/mL),200 μL/孔,对照组加入等体积培养基,每组均设3个复孔,药物作用24 h后,去掉上清液,置于显微镜下观察形态变化。
2.4 集落形成实验取对数生长期BEL-7402细胞,用含10% NBS的RPMI 1640培养基调整细胞浓度为250/mL,混匀后吸取2 mL细胞悬液于35 mm无菌培养皿中,于37 ℃、5% CO2条件下培养过夜,次日分组给药,给药组加入白头翁皂苷D(终质量浓度为0.781、1.562、3.125 μg/mL),阳性组加入5-FU(25 μg/mL),200 μL/孔,对照组加入等体积培养基,每组均设3个复孔,在37 ℃、5% CO2培养箱中静置10 d,弃去培养基,Gimesa染色,镜下记录含50个细胞以上的细胞集落数,计算集落形成率和集落抑制率,并拍照。
集落形成率=集落数 / 接种细胞数
集落抑制率=1-给药组集落数 / 对照组集落数
2.5 细胞凋亡实验(Annexin V-FITC/PI双染)取对数生长期的BEL-7402细胞,用含10% NBS的RPMI 1640培养基调整细胞浓度为5×105/mL于6孔板中,2 mL/孔,在37 ℃、5% CO2条件下培养过夜,次日进行分组:给药组加入白头翁皂苷D(终质量浓度为12.50、18.75、25.00 μg/mL)继续培养48 h,对照组加入等体积培养基,每组均设3个复孔,在含37 ℃、5% CO2的培养箱中培养后,收集板孔里所有细胞并用PBS液洗涤细胞2遍,加入500 μL的结合缓冲液悬浮细胞,加入5 μL Annexin V-FITC混匀后,加入5 μL PI,混匀,室温避光反应5~15 min,上流式细胞仪进行检测。
2.6 细胞凋亡的形态观察取对数生长期的BEL-7402细胞,按“2.5”项方法分组给药,在含37 ℃、5% CO2的培养箱中培养后小心吸去上层液体,用PBS液轻洗1次,加入结合缓冲液500 μL/孔,使浸满底层细胞,然后每孔加入Hoechest 33342染液5 μL,避光反应15 min,于荧光显微镜下观察并拍照(拍照前先将板内的液体吸出)。
2.7 线粒体膜电位检测取对数生长期BEL-7402细胞,按“2.5”项方法分组给药。培养结束后收集孔内所有细胞,每个组的细胞中加入0.5 mL细胞培养液,并移至对应的1 mL EP管中,加入0.5 mL JC-1染色工作液,充分混匀,使细胞在37 ℃避光孵育20 min。在孵育期间,按照每毫升 JC-1染色缓冲液(5×)加入4 mL蒸馏水的比例,配制适量的JC-1染色缓冲液(1×),并放置于冰浴中备用。37 ℃孵育结束后,4 ℃低温离心机中600 r/min离心3~4 min,沉淀细胞,小心吸除上清,加入1 mL JC-1染色缓冲液(1×)重悬细胞,洗涤细胞2次。每个组加入0.5 mL JC-1染色缓冲液(1×)重悬后,于流式细胞仪上进行检测。
2.8 Western blotting检测细胞Caspase-3和Bcl-2蛋白表达取对数生长期BEL-7402细胞,经胰酶消化后,以1×106/mL接种入细胞培养瓶内。待细胞长至80%~90%,给药组加入白头翁皂苷D(终质量浓度12.50、18.75、25.00 μg/mL),对照组加入等体积培养基,作用48 h后,提取各给药组及对照组的蛋白,BCA法测定蛋白浓度。将蛋白样品加入SDS-聚丙烯凝胶,经电泳、转膜、5%脱脂奶粉封闭,封闭结束后,TBST漂洗3次,每次5 min;加一抗溶液,4 ℃孵育过夜,第2天37 ℃恒温热孵1 h,用TBST液洗3次,每次15 min;加入对应的荧光二抗,37 ℃避光孵育2 h,用TBST液避光洗3次,每次15 min,于荧光扫描仪中扫描。由SigmaScan Pro 5软件分析图片中条带灰度值。实验重复3次。
2.9 统计分析实验结果以x ± s表示,采用SPSS 11.5统计学软件进行One-way ANOVA方差分析。
3 结果 3.1 对BEL-7402细胞的生长抑制作用实验结果显示,白头翁皂苷D在1.562 5~50.000 0 μg/mL内对BEL-7402细胞的增殖有不同程度的抑制作用,作用24、48、72 h的增殖抑制率分别为5.89%~66.19%、18.59%~81.04%及24.21%~84.20%,呈明显量效关系,其IC50值分别为(11.93±2.42)、(7.74±1.09)、(4.91±1.42)μg/mL。结果见图 1。
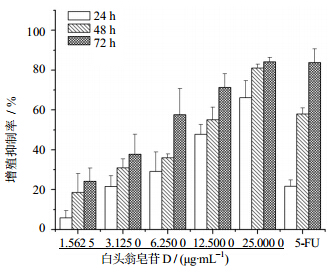 | 图 1 白头翁皂苷D对BEL-7402细胞增殖的影响(x±s,n=3)Fig. 1 Effectof pulchinenoside D on proliferation of BEL-7402 cells(x±s,n=3) |
实验结果显示,对照组细胞生长良好,不同质量浓度白头翁皂苷D处理后贴壁细胞数减少,皱缩变圆,死亡细胞数增加,呈明显剂量依赖性。结果见图 2。
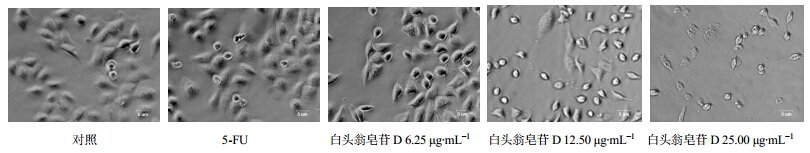 | 图 2 白头翁皂苷D对BEL-7402细胞形态的影响 Fig. 2 Effect of pulchinenoside D on morphological features of BEL-7402 cells |
结果显示,白头翁皂苷D 3.125 μg/mL组及5-FU(25 μg/mL)组均无集落形成;对照组及白头翁皂苷D 0.781、1.562 μg/mL组的集落形成率分别为82.1%、79.7%、65.8%,白头翁皂苷D 0.781、1.562 μg/mL对BEL-7402细胞集落形成的抑制率分别为3.0%和19.8%,其他剂量组抑制率均为100%。结果见图 3。
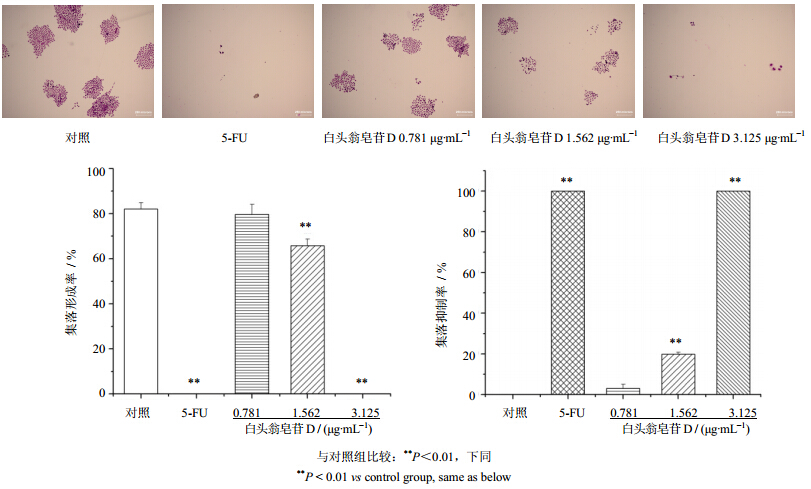 | 图 3 白头翁皂苷D对BEL-7402细胞集落形成的影响(x±s,n=3) Fig. 3 Effect of pulchinenoside D on colony forming of BEL-7402 cells(x±s,n=3) |
结果显示,白头翁皂苷D 12.50 μg/mL组BEL-7402细胞凋亡率为(11.08±0.56)%,与对照组比较差异不显著(P>0.05);白头翁皂苷D 18.75、25.00 μg/mL组细胞凋亡率分别为(24.84±4.29)%、(81.71±3.02)%,与对照组比较差异非常显著(P<0.01)。结果见图 4。
 | 图 4 白头翁皂苷D作用BEL-7402细胞凋亡率的影响(x±s,n=3) Fig. 4 Effect of pulchinenoside D on apoptosis rate of BEL-7402 cells(x±s,n=3) |
白头翁皂苷D作用BEL-7402细胞48 h后,经Hoechest 33342染色观察,结果显示白头翁皂苷D 12.50 μg/mL组对BEL-7402细胞凋亡形态的影响不大,25.00 μg/mL时细胞发出强烈的蓝色荧光,表明被染色的细胞越来越多,大量细胞凋亡。结果见图 5。
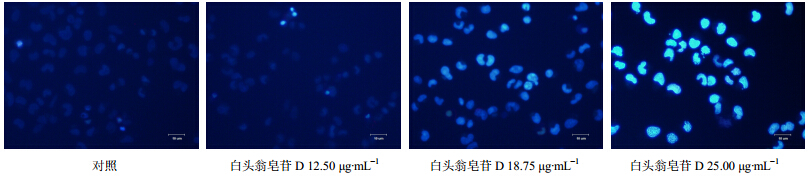 | 图 5 白头翁皂苷D对BEL-7402细胞凋亡形态的影响Fig. 5 Effect of pulchinenoside D on morphological features of BEL-7402 cells |
JC-1是一种用于检测线粒体膜电位的理想探针,在线粒体膜电位高时,JC-1聚集在线粒体的基质中,形成复合物(aggregates JC-1),可以产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,以单体(monomer JC-1)存在,产生绿色荧光,以红、绿荧光强度的相对比值来衡量线粒体膜电位去极化程度。
实验结果显示,白头翁皂苷D(18.75、25.00 μg/mL)组作用BEL-7402细胞48 h后,红色荧光强度与绿色荧光强度的比值呈下降趋势,与对照组比较差异非常显著(P<0.01),表明白头翁皂苷D可导致BEL-7402细胞线粒体膜电位下降。结果见图 6。
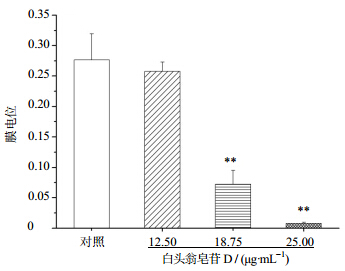 | 图 6 白头翁皂苷D对BEL-7402线粒体膜电位影响(x±s,n=3)Fig. 6 Effect of pulchinenoside D on mitochondrial membrane potential of BEL-7402 cells(x±s,n=3) |
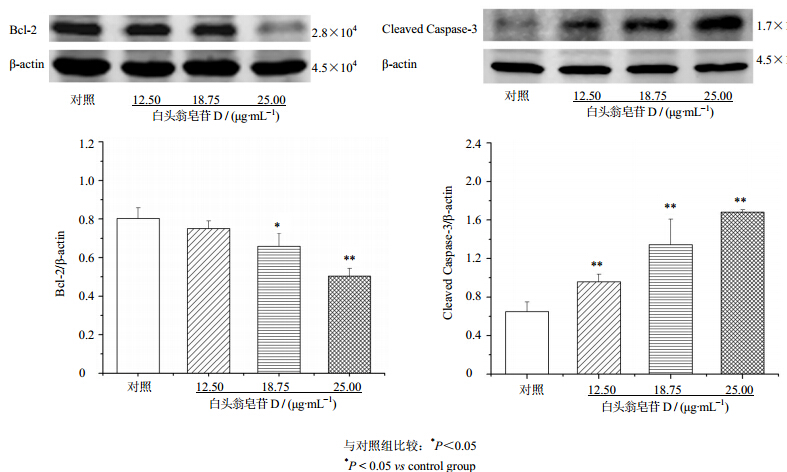 | 图 7 白头翁皂苷D对BEL-7402中Bcl-2和Caspase-3蛋白表达的影响(x±s,n=3)Fig. 7 Effect of pulchinenoside D on expression of Bcl-2 and Caspase-3 proteins in BEL-7402 cells(x±s,n=3) |
结果表明,18.75 μg/mL白头翁皂苷D组BEL-7402细胞中Bcl-2蛋白表达较对照组明显降低(P<0.05),25.00 μg/mL白头翁皂苷D组Bcl-2蛋白表达较对照组显著降低(P<0.01)。结果见图 7。
12.50、18.75和25.00 μg/mL 白头翁皂苷D组BEL-7402细胞中剪切并活化的Caspase-3蛋白表达较对照组显著提高(P<0.01)。结果见图 7。
4 讨论细胞活性测定是体外筛选抗肿瘤药物和临床肿瘤药敏试验的重要方法之一,MTT实验、集落形成实验结果均显示白头翁皂苷D对人肝癌细胞BEL-7402增殖有明显的抑制作用,表明其有良好的抗肝癌活性。
细胞死亡分为两种方式,即坏死与凋亡,细胞凋亡又称程序性细胞死亡(Programmed cell death,PCD)[6]。采用Annexin V-PI双染流式细胞术考察白头翁皂苷D对BEL-7402细胞凋亡的影响,以探讨其对肝癌细胞的细胞毒作用的相关机制。研究发现,白头翁皂苷D在剂量为25.00 μg/mL时作用BEL-7402细胞48 h的凋亡率为81.71%±3.02%,提示白头翁皂苷D能够显著诱导人肝癌细胞凋亡。通过Hoechest 33342染色观察,发现白头翁皂苷D对BEL-7402细胞形态有影响,随着给药浓度的增加,发出强烈蓝色荧光的细胞越来越多,表明大量细胞凋亡,提示其对BEL-7402细胞的凋亡作用呈剂量依赖性,这与凋亡率的结果相吻合。
在细胞凋亡的早期阶段,细胞发生病理改变前,线粒体膜电位就已经下降,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转[7]。线粒体膜电位下降是细胞凋亡的特征性标志,维持正常的线粒体膜电位是抑制细胞凋亡的重要手段[8]。采用流式细胞术考察白头翁皂苷D对BEL-7402细胞线粒体膜电位的影响,研究结果显示,白头翁皂苷D在18.75和25.00 μg/mL作用BEL-7402细胞48 h后,红色荧光强度与绿色荧光强度的比值呈下降趋势,与对照组比较有显著性差异(P<0.01),提示白头翁皂苷D对BEL-7402细胞凋亡作用可能是通过线粒体途径诱导的,白头翁皂苷D通过作用细胞的线粒体,使膜电位下降,进而诱导细胞凋亡。
凋亡是多基因严格控制的过程,涉及一系列凋亡信号转导系统,目前比较清楚的通路主要有外源性途径和内源性途径。Bcl-2家族分子在内源性(线粒体)途径中起重要作用[9]。Caspase-3是ICE(Interleukin-1β-converting enzyme)家族中能够执行细胞凋亡的蛋白酶分子,其底物是聚合多聚酶(PARP)。PARP是修复损伤DNA的酶,被Caspase-3酶破坏后,其修复损伤DNA的功能丧失,从而导致细胞凋亡,它是Caspase家族中的最重要的凋亡执行者之一,是细胞凋亡过程中的主要效应因子[10]。采用Western blotting实验,探讨白头翁皂苷D诱导细胞凋亡的相关机制。研究表明,18.75 μg/mL 白头翁皂苷D可以明显下调BEL-7402细胞中Bcl-2蛋白的表达(P<0.05),25.00 μg/mL 白头翁皂苷D可以显著下调Bcl-2蛋白表达(P<0.01),白头翁皂苷D各组(12.50、18.75、25.00 μg/mL)均可显著上调BEL-7402细胞中磷酸化的Caspase-3蛋白表达(P<0.01)。提示白头翁皂苷D可下调Bcl-2蛋白,使得线粒体发生一系列改变,导致Caspase家族蛋白被激活,启动细胞凋亡程序。综上所述,白头翁皂苷D体外有明显的抗肝癌活性,其抗肝癌活性可能是通过线粒体途径诱导细胞凋亡实现的。
| [1] | 王 英, 李文涛. 肝癌干细胞与肝癌的研究进展 [J]. 中国癌症杂志, 2011, 21(9): 735-738. |
| [2] | Kim Y, Bang S C, Lee J H, et al. Pulsatilla saponin D: the antitumor principle from Pulsatilla koreana [J]. Arch Pharm Res, 2004, 27(9): 915-918. |
| [3] | Son M K, Jung K H, Hong S W, et al. SB365, Pulsatilla saponin D suppresses the proliferation of human colon cancercells and induces apoptosis by modulating the AKT/mTOR signalling pathway [J]. Food Chem, 2013, 136(1): 26-33. |
| [4] | Son Mi K, Jung K H, Lee H S, et al. SB365, Pulsatilla saponin D suppressesproliferation and induces apoptosis of pancreatic cancer cells [J]. Oncol Reports, 2013, 30(2): 801-808. |
| [5] | Won S, Jung K H, Lee H S, et al. SB365, Pulsatilla saponin D, targets c-Met and exerts antiangiogenic and antitumor activities [J]. Carcinogenesis, 2013, 34(9): 2156-2169. |
| [6] | 陆立鹤, 吴伟康. 细胞死亡方式研究进展 [J]. 国际病理科学与临床杂志, 2005, 25(6): 507-510. |
| [7] | Haeberlein S I. Mitochondrial function in apoptotic neuronal cell death [J]. Neurochem Res, 2004, 29(3): 521-530. |
| [8] | 蔡 循, 陈国强, 陈 竺, 等. 线粒体跨膜电位与细胞凋亡 [J]. 生物化学与生物物理进展, 2001, 28(1): 3-5. |
| [9] | 宋 宇, 段 勇. 促凋亡基因puma的研究进展 [J]. 医学综述, 2011, 17(12): 1791-1794. |
| [10] | Yim W, Deng X K, Yin F Z, et al. The cytotoxicity induced by brucine from the seed of Strychnos nux-vomica proceeds via apoptosis and is mediated by cyclooxygenase 2 and caspase 3 in SMMC 7221 cells [J]. Food Chem Toxicol, 2007, 45(9): 1700-1708. |
 2014, Vol. 59
2014, Vol. 59


