2. 江苏省中药高效给药系统工程技术研究中心, 江苏 南京 210046;
3. 南京市中药微丸产业化工程技术研究中心, 江苏 南京 210046;
4. 江苏省儿童呼吸疾病(中医药)重点实验室, 江苏 南京 210023
2. Jiangsu Engineering Research Center for Efficient Delivery System of TCM, Nanjing 210046, China;
3. Nanjing Engineering and Technology Research Center for TCM Pellets, Nanjing 210046, China;
4. Jiangsu Key Laboratory of Pediatric Respiratory Disease, Nanjing 210023, China
消癥丸是苏州雷允上药业有限公司生产的中药6类新药,由柴胡、香附、大黄、青皮等11味中药组成,主治气滞血瘀痰凝所致的乳腺增生病。原方提取后,所得提取液得膏率较高,浸膏黏性大、易吸湿、成型困难,因此本实验采用适合工业化生产的大孔吸附树脂分离技术,以总皂苷、总蒽醌、阿魏酸、橙皮苷比上柱量、比吸附量、比解析量以及多指标活性部分和成分的转移率为综合指标,探索中药复方多指标优化工艺评价体系的构建方法,以期对中药制剂工艺改进提供参考。
1 仪器与材料Waters e2695高效液相色谱仪,美国Waters公司;TU—1800S紫外分光光度计,北京普析通用仪器有限公司;HY—45气浴恒温生物摇床,江苏金坛市金城国盛实验仪器厂;BP211D型电子分析天平,德国Satrorius公司。
柴胡皂苷a(批号110777-200406)、大黄素(批号110756-200110)、阿魏酸(批号110773-201313)、橙皮苷(批号110721-201115)对照品均购自中国食品药品检定研究院。HPD100、AB-8、D101、X-5型大孔吸附树脂,沧州宝恩化工有限公司;乙腈,美国Tedia公司,色谱纯;重蒸去离子水,密理博纯水仪制备;其他试剂均为分析纯。
饮片柴胡、香附、大黄、青皮、川芎、莪术、土鳖虫、浙贝母、当归、白芍、王不留行由苏州雷允上药业有限公司提供,分别经南京中医药大学药学院刘圣金博士鉴定为伞形科柴胡属植物柴胡Bupleurum chinense DC. 干燥根、莎草科莎草属植物莎草Cyperus rotundus L. 的干燥根茎、蓼科大黄属植物药用大黄Rheum offcihale Baill. 的干燥根茎、芸香科植物橘Citrus reticulata Blanco及其栽培变种的幼果或未成熟果实的果皮、伞形科植物川芎Ligusticum chuanxiong Hort. 的干燥根茎、姜科植物广西莪术Curcuma kwangsiensis S. G. Lee et C. F. Liang的干燥根茎、鳖蠊科昆虫地鳖Eupolyphaga sinensis Walker的雌虫干燥体、百合科植物浙贝母Fritillaria thunbergii Miq. 的干燥鳞茎、伞形科植物当归Angelica sinensis (Oliv.) Diels. 的干燥根、毛茛科植物芍药Paeonia lactiflora Pall. 的干燥根、石竹科植物麦蓝菜Vaccaria segetalis (Neck.) Garcke的干燥成熟种子,均为《中国药典》2010年版收载品种。消癥丸提取液实验室自制[1]。
2 方法与结果 2.1 指标性成分检测方法 2.1.1 紫外分光光度法测定总皂苷[2](1)对照品溶液的制备:精密称取柴胡皂苷a对照品适量,加甲醇制成含柴胡皂苷a 0.441 mg/mL的对照品溶液。
(2)线性关系考察:分别吸取上述柴胡皂苷a对照品溶液25、50、100、200、250、400 μL水浴挥干甲醇,加入0.5 mL 0.1%对二甲氨基苯甲醛乙醇溶液,蒸干,加磷酸3 mL,70 ℃水浴反应30 min,加磷酸定容至5 mL。按上述方法制备加试剂的空白溶液,在200~1 100 nm波长扫描,对照品溶液在545 nm处有最大吸收。将上述溶液在545 nm处测定吸光度(A)值,以A值为纵坐标,质量浓度为横坐标,进行线性回归,得回归方程Y=0.018 7 X-0.026 1,r=0.997 7,表明柴胡皂苷a在2.205~35.28 μg/mL线性关系良好。
2.1.2 紫外分光光度法测定总蒽醌[3](1)对照品溶液的制备:精密称取大黄素对照品适量,加甲醇制成含大黄素0.382 mg/mL的对照品溶液。
(2)线性关系考察:分别吸取上述大黄素对照品溶液30、60、120、180、240、300 μL置蒸发皿中,挥干甲醇,加1%醋酸镁甲醇溶液洗涤残渣,并定容到5 mL。以1%醋酸镁甲醇溶液为空白,在波长200~1 100 nm进行扫描,对照品溶液在512 nm处有最大吸收。将上述溶液在512 nm处测定A值,以A值为纵坐标,质量浓度为横坐标,进行线性回归,得回归方程Y=0.043 2 X-0.016 1,r=0.998 3,表明大黄素在2.292~22.92 μg/mL线性关系良好。
2.1.3 HPLC法同时测定阿魏酸和橙皮苷(1)色谱条件:色谱柱为Waters Xbridge C18柱(250 mm×4.6 mm,5 μm);柱温35 ℃;流动相为乙腈-0.1%磷酸水溶液,梯度洗脱;体积流量0.8 mL/min;进样体积10 μL;阿魏酸检测波长为322 nm;橙皮苷检测波长为283 nm。
(2)标准曲线绘制:分别精密称取阿魏酸、橙皮苷对照品4.40、4.82 mg,各置10 mL量瓶中,甲醇定容至刻度,得到对照品储备液。分别精密吸取阿魏酸、橙皮苷储备液1、2.5 mL,置于同一10 mL量瓶中,甲醇定容至刻度,得到阿魏酸、橙皮苷混合对照品溶液,依次等比稀释,以质量浓度对峰面积进行线性回归,阿魏酸回归方程为Y=69 291 X-19 780,R2=0.999 9,线性范围1.375~44.00 μg/mL;橙皮苷回归方程Y=21 738 X-10 449,R2=0.999 9,线性范围3.766~120.5 μg/mL。色谱图见图 1。
2.2 消癥丸多指标活性部位和成分的Z值综合评价法[4]实验选取总皂苷、总蒽醌、阿魏酸、橙皮苷比上柱量、比吸附量、比解析量为指标,由于不同极性和含不同官能团的树脂对各类化合物的吸附能力不同,以其中单一指标难以确定最佳工艺参数,因此采用Z值综合评价法将多指标进行归一化处理,以Z值高者确定最优工艺参数,计算公式如下:


公式(1)中Xi为指标值,Xi为该指标的平均值,Si为该指标的标准差,通过Zi值使指标无量纲化。用公式(2)计算时,对“高优”的Z值予以“加上”,对“低优”的Z值予以“减去”,即得∑Zi越大越优的结果[5]。
 | 图 1 混合对照品 (A) 与80%乙醇洗脱物 (B) 的HPLC色谱图Fig. 1 HPLC of mixed reference substances (A) and 80% ethanol solution eluate (B) |
分别取经预处理[6]的AB-8、D101、HPD100、X-5树脂各5 g,各加入20 mL 0.5 g/mL药液,于摇床(20 ℃,70 r/min)中振摇24 h,装柱,沥干药液,用蒸馏水洗脱至Monish反应为阴性,然后用80%乙醇100 mL洗脱,体积流量为2 BV/h,收集乙醇洗脱液,分别检测原药液、残留液、蒸馏水洗脱液和乙醇洗脱液中总皂苷、总蒽醌、阿魏酸、橙皮苷的量,分别计算比上柱量[比上柱量=(处方药液原含量-残留液原含量) / 树脂质量]、比吸附量[比吸附量=(处方药液原含量-残留液原含量-水洗液原含量) / 树脂质量]、比洗脱量(比洗脱量=洗脱液含量 / 树脂质量),结果见表 1,AB-8树脂型号对所选指标有良好的吸附和解析性能,树脂型号确定为AB-8。
| 表 1 不同树脂型号对吸附和解析性能影响 Table 1 Influence of different macroporous adsorbing resins on adsorption and desorption properties |
以比上柱量、比吸附量为考察指标,对静态上样与动态上样2种上样方式进行比较,结果见表 2,静态上样方式优于动态上样方式,因此上样方式选择为静态上样。
| 表 2 不同上样方式对吸附性能的影响 Table 2 Influence of static and dynamic sampling on adsorption properties |
取AB-8大孔树脂5 g,分别加入不同质量浓度0.125、0.25、0.5、0.8、1.0 g/mL药液80、40、20、12.5、10 mL,于摇床(20 ℃,70 r/min)振摇24 h,装柱,沥干药液,用水洗脱至Monish反应为阴性,分别测定总皂苷、总蒽醌、阿魏酸、橙皮苷的比上柱量和比吸附量,结果见表 3,上样质量浓度选择为0.5 g/mL。
2.3.4 静态饱和吸附曲线的绘制取AB-8大孔树脂5 g,加入0.5 g/mL药液20 mL,于摇床(20 ℃,70 r/min)振摇,分别于0.5、1、2、3、4、8、12、18、24、30 h取样,分别测定总皂苷、总蒽醌、阿魏酸、橙皮苷的比吸附量,结果见图 2,吸附时间对总皂苷、总蒽醌比吸附量有显著影响,对阿魏酸、橙皮苷影响不大,综合考虑选择吸附时间为24 h。
| 表 3 不同上样质量浓度对吸附性能的影响 Table 3 Influence of different sample concentration on adsorption properties |
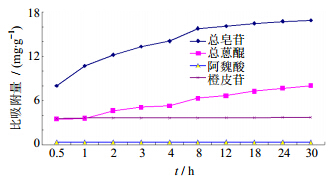 | 图 2 静态饱和吸附曲线Fig. 2 Static saturated adsorption curve |
取AB-8大孔树脂5 g,分别加入0.5 g/mL药液20 mL,于摇床(20 ℃,70 r/min)振摇24 h,分别装入径高比1∶6、1∶8、1∶10的树脂柱,沥干药液,水洗至Monish反应为阴性,分别测定总皂苷、总蒽醌、阿魏酸、橙皮苷的比上柱量和比吸附量,结果见表 4,径高比选择为1∶10。
2.3.6 水洗体积的考察取AB-8大孔树脂5 g,按上述优选的工艺参数上样,用200 mL水洗,每2 BV接1份,续取1 mL,进行Monish反应,结果当水洗脱体积为14 BV时,Monish反应为阴性,确定水洗体积为14 BV。
| 表 4 不同径高比对吸附性能的影响 Table 4 Influence of different resin column diameter-height ratios on adsorption properties |
取AB-8大孔树脂5 g,加入0.5 g/mL药液20 mL,于摇床(20 ℃,70 r/min)振摇24 h,装入树脂柱,用14 BV水洗脱至Monish反应为阴性。然后按照L9(34) 表所对应的条件进行乙醇洗脱,收集乙醇洗脱液,按照前述方法分别测定总皂苷、总蒽醌、阿魏酸、橙皮苷的量,计算比洗脱量,以Z值为指标对乙醇体积分数(A)、洗脱液用量(B)和洗脱液体积流量(C)进行优化,并进行方差分析,结果见表 5、6。乙醇体积分数具有显著性差异(P<0.05),因素影响大小为A>B>C,最佳工艺为80%乙醇,洗脱液用量10 BV,洗脱体积流量2 BV/h。
2.3.8 验证试验取AB-8大孔树脂25 g,加入100 mL 0.5 g/mL药液浸泡24 h,然后上柱,径高比1∶10,沥干药液,树脂柱先用14 BV水洗脱至Monish反应为阴性,再以80%乙醇洗脱,洗脱剂用量为10 BV,洗脱体积流量为2 BV/h,平行3份,结果见表 7。AB-8型大孔树脂纯化消癥丸提取液的工艺可行。
3 讨论实验以比上柱量、比吸附量、比洗脱量为考察指标,筛选出AB-8型大孔树脂,并优化工艺参数,确定最优工艺条件为采用静态吸附上样,提取液质量浓度0.5 g/mL,浸泡时间24 h,柱径高比1∶10,先用14 BV水洗去除杂质,再以80%乙醇洗脱,洗脱剂用量10 BV,洗脱体积流量2 BV/h。
消癥丸提取液经过大孔树脂纯化后,所得干浸膏量由原来的15.6%(浸膏/药材)降低为4.2%(浸膏/药材)。对树脂吸附处理前后的干浸膏粉末进行比较研究,未经树脂处理的干浸膏粉末吸湿性极强,在相对湿度75%,温度25 ℃条件下放置15 min左右即吸湿粘连;经树脂处理后的干浸膏粉末,在此条件下放置24 h仍呈粉末状,表明AB-8型大孔树脂能有效地除去其吸湿成分,降低浸膏粉的黏性。
| 表 5 L9(34) 正交试验设计与结果 Table 5 Design and results of L9(34) orthogonal test |
| 表 6 正交试验结果的方差分析 Table 6 Analysis of variance |
| 表 7 工艺验证试验结果 (n = 3) Table 7 Results of verification (n = 3) |
实验选择的检测指标总皂苷、总蒽醌、阿魏酸、橙皮苷分别为消癥丸复方中君药柴胡,臣药大黄、川芎、青皮的活性部位或成分,采用Z值综合评价法,将多指标进行归一化处理与层次分析法确定权重系数进行评价的结果一致[8]。
| [1] | 狄留庆, 许惠琴. 一种具有抗乳腺增生作用的中药复方提取物及其制备方法: 中国, CN 103356967 A [P]. 2013-10-23. |
| [2] | 谭玲玲, 蔡 霞, 胡正海. 不同产地北柴胡中柴胡皂苷的含量测定 [J]. 中草药, 2009, 40(12): 1993-1995. |
| [3] | 王淑美, 李淑芳, 梁生旺, 等. AB-8大孔吸附树脂纯化复方脑脉通有效部位的工艺研究 [J]. 中成药, 2009, 31(1): 47-50. |
| [4] | 靳 浩, 吴 诚, 梅兴国. 多指标综合评价法优选阿霉素微球的制备工艺及体内的初步考察 [J]. 中国药学杂志, 2006, 41(22): 1723-1725. |
| [5] | 赵应征, 鲁翠涛, 梅兴国. 常用多指标综合评价法在优选实验中的应用 [J]. 医学研究生学报, 2004, 17(4): 624-626. |
| [6] | 马丽娜, 张铁军, 田成旺, 等. 大孔树脂分离纯化川西獐牙菜中环烯醚萜苷类和酮类成分的工艺研究 [J]. 中草药, 2010, 41(2): 227-231. |
| [7] | 狄留庆. 通塞脉片有效部位及其微丸的制备工艺研究 [D]. 南京: 南京中医药大学, 2004. |
| [8] | 杨 铭, 周 昕, 谢瑞芳, 等. 用层次分析法结合CRITIC法研究复方自身颗粒提取工艺的多指标权重 [J]. 药学服务与研究, 2009, 9(1): 36-39. |
 2014, Vol. 53
2014, Vol. 53


