2. 中国医学科学院药物研究所 北京协和药厂, 北京 102600;
3. 南京中医药大学 江苏省中药炮制重点实验室, 江苏 南京 210046
2. Institute of Materia, Chinese Academy of Medical Sciences, Peking Medical Factory, Beijing 102600, China;
3. Jiangsu Key Laboratory of Chinese Materia Medica Processing, Nanjing University of Chinese Medicine, Nanjing 210046, China
续断Dipsaci Radix为川续断科多年生草本植物川续断Dipsacus asper Wall. ex Henry的根,因能“续折接骨”而得名。《滇南本草》记载:“补肝,强筋骨,定经络,止经中(筋骨)酸痛……”。临床上用于腰背酸痛、肢节痿痹、跌扑创伤、损筋折骨、胎动漏红、血崩、遗精、带下、痈疽疮肿。续断传统多采用“发汗”的产地加工方法[1],“发汗”除了干燥目的外,还伴随着性状的变化,即药材内部变绿,此多是由于化学成分的变化引起的。相关学者研究发现,续断经产地加工发汗后,其水溶性浸出物和药效成分总皂苷及川续断皂苷VI均降低,因而对药材有无必要“发汗”持怀疑态度[2, 3, 4, 5]。本课题组前期比较了不同产地的发汗前后的续断,结果发现,经发汗加工后,续断中水溶性浸出物、醇溶性浸出物、总皂苷、绿原酸的量均有所降低,而川续断皂苷VI的量有所升高[6, 7]。然而仅凭这几种成分的变化难以阐明续断发汗的真正机制,应从续断经发汗产地加工后可能引起系列成分变化的角度,进行整体药材质量评价。本实验采用HPLC-ESI-MS建立了续断发汗前后的分析方法,并通过与对照品和质谱信息对照,对部分成分进行了指认,为全面评价续断发汗前后的药材质量奠定了基础。
1 仪器与试药Agilent 1200高效液相色谱-6410三重四极杆质谱联用仪,美国Agilent仪器公司;AG285电子天平,0.01 mg,Mettler,Switzerland;KQ—500E型超声清洗器,昆山市超声仪器有限公司。
对照品:马钱苷酸(批号111865-201102,质量分数93.8%)、绿原酸(批号110753-201314,质量分数96.6%)、咖啡酸(批号110885-200102,质量分数100.0%)、马钱苷(批号111640-201005,质量分数99.2%)、川续断皂苷VI(批号111685-201003,质量分数93.5%),购自中国食品药品检定研究院;川续断皂苷乙(批号33289-85-9,质量分数98.0%),购自成都曼思特生物技术有限公司;α-常春藤皂苷(批号BW60211,质量分数98.0%)、常春藤皂苷元(批号BW6423,质量分数98.0%),购自北京北研馨绿生物技术有限公司。甲醇、甲酸为分析纯;乙腈为色谱纯;水为娃哈哈纯净水。
续断样品采自四川西昌,经浙江中医药大学来平凡教授鉴定为川续断科植物川续断Dipsacus asper Wall. ex Henry的干燥根;未发汗样品为续断经采集后于80 ℃条件下烘干而成,发汗样品为续断采新后经产地发汗加工后而成。
2 方法与结果 2.1 对照品溶液的制备精密称取对照品(马钱苷酸、绿原酸、咖啡酸、马钱苷、川续断皂苷乙、川续断皂苷VI、α-常春藤皂苷和常春藤皂苷元)各1.5 mg于10 mL量瓶中,用甲醇定容,制成质量浓度0.15 mg/mL的对照品混合溶液,0.45 μm微孔滤膜滤过,备用。
2.2 样品处理取过80目筛的样品粉末0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定质量,超声(功率100 W,频率40 kHz)处理30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取上清液过0.45 μm微孔滤膜,即得。
2.3 色谱条件Agilent 1200型高效液相色谱仪,色谱柱为Agilent Eclipse XDB-C18柱(250 mm×4.6 mm,5.0 μm);流动相为0.1%甲酸水溶液-乙腈,梯度洗脱:0~45 min,6%~20%乙腈;45~90 min,20%~35%乙腈;90~110 min,35%~70%乙腈;110~120 min,70%乙腈;柱后平衡时间为10 min;柱温为25 ℃;体积流量0.8 mL/min;检测波长212 nm;进样量为10 μL。
2.4 质谱条件Agilent 6410三重四极杆质谱仪,离子源:电喷雾源(ESI);扫描范围:m/z 100~2 000;干燥气:氮气,体积流量10 L/min;雾化气压力103.44 kPa;干燥气温度300 ℃;毛细管电压4.0 kV;离子检测模式:全扫描检测;离子极性:正、负离子;扫描时间0.5 s;碎裂电压135 V;增加电压值400 V。检测到续断主要的分子离子峰有 [M-H]-、[M+HCOO]-、[M+H]+、[M+Na]+。
2.5 HPLC-ESI-MS分析将续断未发汗和发汗样品按照“2.2”项的方法制备溶液,采用“2.3”项和“2.4”项的方法进样分析,所得到的HPLC-ESI-MS图谱见图 1,各得到42个峰。
2.6 成分分析通过质谱分析,得到了各个色谱峰在负离子模式下([M-H]-、[M+HCOO]-)和在正离子模式下([M+H]+、[M+Na]+)的质谱信息,进而来确定各个化合物的相对分子质量。通过与8个对照品的保留时间和质谱信息进行对照(图 1),再结合文献信息,最终推断出了31个色谱峰所对应的化合物,结果见表 1。
从续断发汗前后成分比较中初步得知,续断发汗后,有些成分的量降低(如马钱苷酸异构体、马钱苷酸、隐绿原酸、绿原酸、咖啡酸、马钱苷、异绿原酸B、续断苷A、续断苷B等);有些成分的量升高(如茶茱萸苷、川续断皂苷X、川续断皂苷VI、川续断皂苷VII、川续断皂苷乙、川续断皂苷VI同分异构体、川续断皂苷XIII、川续断皂苷IV同分异构体、川续断皂苷A等);其他成分的量几乎不变(如异绿原酸A、异绿原酸C、3-O-α-L-吡喃阿拉伯糖-常春藤皂苷元-28-O-β-D-吡喃葡萄糖苷、川续断皂苷V、川续断皂苷IX、川续断皂苷XI、灰毡毛忍冬次苷D、α-常春藤皂苷、3-O-α-L-吡喃阿拉伯糖-常春藤皂苷元、常春藤皂苷元等)。尚未发现新增或消失的成分。也许正是这些变化的成分在影响着续断发汗前后的质量差异。
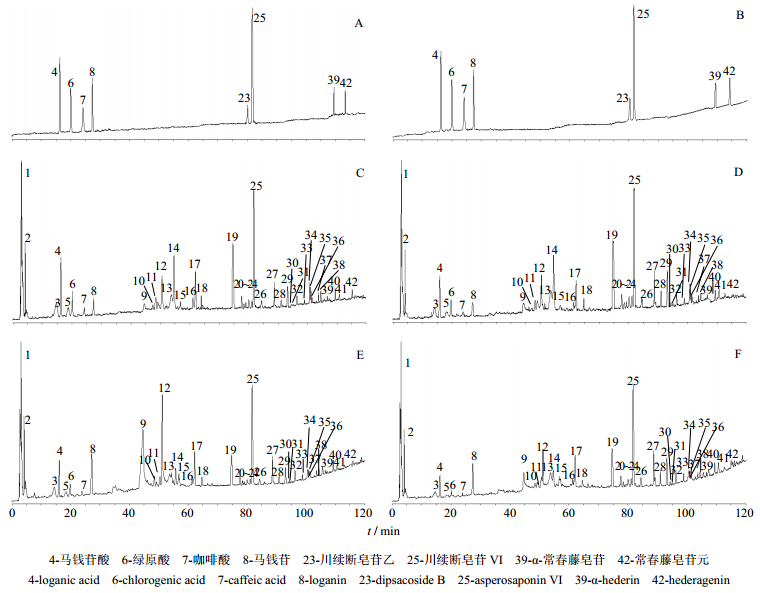 | 图 1 8个对照品的总离子流图 (A-负离子模式,B-正离子模式)、续断的负离子总离子流图 (C-未发汗样品,D-发汗样品) 和续断的正离子总离子流图 (E-未发汗样品,F-发汗样品) Fig. 1 TIC of eight reference compounds (A-negative ion mode,B-positive ion mode),negative ion TIC of Dipsaci Radix (C-crude sample,D-sweated sample),and positive ion TIC of Dipsaci Radix (E-crude sample,F-sweated sample) |
| 表 1 续断的HPLC-ESI-MS数据及化合物归属 Table 1 HPLC-ESI-MS data and compounds attribution of Dipsaci Radix |
本实验采用液质联用方法,结合全扫描的离子检测模式,建立了续断发汗与未发汗样品的成分分析图谱,各得到了42个色谱峰,推断出了其中的31个化合物,较文献报道的多[22],所得指纹图谱的成分信息量大,可用作续断“发汗”全面质量控制的评价依据。
本实验对影响分析方法建立的关键条件进行了考察。考察了流动相系统甲醇-水、乙腈-水、甲醇- 0.1%甲酸水溶液、乙腈-0.1%甲酸水溶液,最终确定了乙腈-0.1%甲酸水溶液系统;考察了碎裂电压100、110、120、130、135、140、150 eV,最终选择了135 eV;考察了干燥气的体积流量6、8、10 L/min,最终选择了10 L/min;考察了雾化气压力68.96、103.44、137.92 kPa等,最终选择了103.44 kPa;考察了离子化温度250、300、350 ℃,最终选择了350 ℃。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 杨中林, 刘双跃, 秦民坚. 不同加工方法对续断中Akebia Saponin D含量变化的影响 [J]. 中医药信息, 2000, 17(1): 16-17. |
| [3] | 佟志刚. 续断中总皂苷的含量测定技术 [J]. 健康必读 (下旬刊), 2011(3): 308. |
| [4] | 汪 霞. 发汗与不发汗续断的比较研究 [J]. 浙江中医杂志, 2011, 46(4): 292-293. |
| [5] | 王 初. 发汗与不发汗续断中水溶性浸出物和川续断皂苷VI的比较 [J]. 中草药, 2007, 38(6): 865-866. |
| [6] | 金 奇, 来平凡, 杜伟锋, 等. “发汗”对续断质量的影响 [J]. 中华中医药学刊, 2011, 29(12): 2636-2638. |
| [7] | 杜伟锋, 丛晓东, 蔡宝昌. HPLC-ESI/MS法测定续断“发汗”前后绿原酸和川续断皂苷VI的含量 [J]. 药物分析杂志, 2013, 33(1): 112-115. |
| [8] | Papalexandrou A, Magiatis P, Perdetzoglou D, et al. Iridoids from Scabiosa variifolia (Dipsacaceae) growingin Greece [J]. Biochem Syst Ecol, 2003, 31(1): 91-93. |
| [9] | Kowalczyk A, Krzyzanowska J. Preliminary antifungal activity of some Dipsacaceae family plants [J]. Herba Polonica, 1999, 45(2): 101-105. |
| [10] | Kim S Y, Kwon Y S, Kim C M. Chemical constituents from Dipscacus asper [J]. Saengyak Hakhoechi, 1999, 30(4): 420-425. |
| [11] | Hung T M, Na M K, Thuong P T, et al. Cytotoxic saponins from the roots of Dipsacus asper Wall [J]. Arch Pharm Res, 2005, 28(9): 1053-1056. |
| [12] | 田小雁. 四种中草药的活性成分研究 [D]. 北京: 中国协和医科大学, 2006. |
| [13] | 张永文, 薛 智. 川续断中皂苷IX和X的结构研究 [J]. 药学学报, 1992, 27(12): 912-917. |
| [14] | 张永文, 薛 智. 川续断中的新三萜皂苷 [J]. 药学学报, 1991, 26(12): 911-917. |
| [15] | Kouno I, Tsuboi A, Nanri M, et al. Acylated triterpene glycoside from roots of Dipsacus asper [J]. Phytochemistry, 1990, 29(1): 338-339. |
| [16] | Mukhamedziev M M, Alimbaeva P K. Triterpene glycosides of Dipsacus azureus [J]. Chem Nat Compd, 1969, 5(5): 451-452. |
| [17] | 张永文, 薛 智. 川续断中皂甙XI, XII, XⅢ的结构研究 [J]. 药学学报, 1993, 28(5): 358-163. |
| [18] | 张永文, 薛 智. 川续断的化学成分研究 [J]. 药学学报, 1991, 26(9): 676-681. |
| [19] | Young J K, Do J C, Son K H. Triterpene glycosides from the roots of Dipsacus asper [J]. J Nat Prod, 1993, 56(11): 1912-1916. |
| [20] | Young J K, Son K H, Do J C. Triterperioids from the roots of Dipsacus asper [J]. Arch Pharm Res, 1993, 16(1): 32-35. |
| [21] | 魏慧芬, 梁光义. 川续断化学成分 [J]. 中草药, 1987, 18(5): 6-9. |
| [22] | 刘云飞, 季 德, 张春凤, 等. HPLC-TOF/MS归属续断指纹图谱中的化学成分 [J]. 中国野生植物资源, 2012, 31(3): 22-25. |
 2014, Vol. 51
2014, Vol. 51

