阿尔茨海默病(Alzheimer’s disease,AD)是一种中枢神经系统的退行性疾病,其主要临床表现包括进行性记忆障碍、认知功能障碍、日常生活能力下降等[1]。国际AD联合会公布的最新数据显示,至2014年1月全球AD患者人数已达400万,到2030年患病人数预计将达到700万。AD是公认的世界性医学难题,发病机制复杂。目前,世界上较为接受的AD病理学说为“胆碱能缺失学说”,该学说认为老年性痴呆症患者大脑内神经递质——乙酰胆碱(acetylcholine,ACh)的缺失是导致AD疾病的关键原因。医学治疗上多采用乙酰胆碱酯酶抑制剂(acetylcholinesterase inhibitors,AChEI)抑制乙酰胆碱酯酶(AChE)活性,延缓ACh水解的速度,提高突触间隙ACh的水平,从而发挥其对AD的治疗作用[2, 3]。
天然产物是AChEI的重要来源。近年来,国内外研究者从天然产物中发现了大量具有抑制AChE活性的成分,其中很大一部分是生物碱类物质[4, 5]。对这些生物碱类AChEI,主要采用改进的Ellman法测定其抑制率。本文对植物来源且对AChE半数抑制浓度(IC50)小于50 μmol/L的生物碱的结构类型、作用机制及其构效关系进行归纳总结。
1 甾体类和三萜类生物碱甾体类生物碱是天然甾体的含氮衍生物,在生物碱中属于结构最复杂的一类。黄杨科(Buxaceae)植物是甾体类生物碱的主要来源。
Rahman等[6]从黄杨科柳叶野扇花Sarcococca saligna (D. Don) Mull. -Arg. 中分离得到18个甾体类生物碱并测定了其对胆碱酯酶的抑制活性,发现其中矮陀陀酰胺碱A(axillaridine A,1)、sarsalignen- one(2)、salignenamide E(3)、salignenamide F(4)、sarsalignone(5)和vaganine A(6)对AChE抑制作用较强,以毒扁豆碱(eserine,IC50=41 μmol/L)作对照,其抗AChE的IC50分别是5.21、5.83、6.21、6.35、7.02和8.59 μmol/L。这18个化合物对丁酰胆碱酯酶(butyrocholinesterase,BChE)也都有较强的抑制活性。对这些化合物进行构效关系分析,发现A环C-3位有无α、β不饱和氨基与其抗胆碱酯酶的活性密切相关,且A环和B环间如果有α、β不饱和羰基存在,对抑制胆碱酯酶活性有增强作用。对比salignenamide C(7)、2β-羟基表粉蕊黄杨胺D(2β-hydroxyepipachysamine D,8)、axillarine C(9)、axillarine F(10)和化合物2、5的结构,可见A环上的富电子作用会明显降低其抗胆碱酯酶活性。另外,C-20上二甲氨基也有可能与抗胆碱酯酶活性有关。2004年Rahman等[7]从柳叶野扇花中分离得到7个甾体类生物碱,发现其中仅有化合物2,3- dehydrosarsalignone(11)、16-dehydrosarcorine(12)和salignarine-C(13)有显著的AChE抑制活性,以加兰他敏(galanthamine,IC50=0.5 μmol/L)作对照,其IC50分别是7.0、12.5和19.7 μmol/L,其他化合物对AChE的抑制作用较弱,如sarcovagenine C(14,IC50=187.8 μmol/L)。而这7个甾体类生物碱对BChE都具有较强的抑制活性。Khalid等[8]证实从柳叶野扇花中提取到的大部分孕甾烷生物碱对AChE和BChE的抑制作用属于非竞争性抑制作用。2007年Devkota等[9]从羽脉野扇花S. hookeriana Baill. 中分离得到5个甾体类生物碱,这些化合物对AChE和BChE也都具有抑制活性。与加兰他敏相比,这5个生物碱对AChE的抑制活性低于对BChE的抑制活性。随着对羽脉野扇花的深入研究,在Devkota等[10]对来源于羽脉野扇花的10个5α-孕甾烷型生物碱的生物活性研究中,发现了2个对AChE有抑制作用的新型5α-孕甾烷生物碱。同时,对其中的6个5α-孕甾烷型生物碱进行了抗胆碱酯酶活性研究,发现epipachysamine- E-5-en-4-one(15)对AChE抑制活性较高,其IC50为9.9 μmol/L。
Zaheerul等[11]对32个来自野扇花属植物的甾体类生物碱进行三维定量构效关系(3D-QSAR)研究发现,在B环的C-5和C-6位存在双键能增强AChE抑制活性,如saracocine(16)对AChE的pIC50为4.70而sarcodine(17)对AChE的pIC50为4.30,这2个化合物的结构差异仅在于其B环的C-5和C-6位是否存在双键。此外,在C-4位的取代基和C-3位的侧链附近有2个重要区域,若该区域中存在高密度负电荷则有利于增强AChE抑制活性,而C-2位附近区域的高密度负电荷将降低其对AChE的抑制活性。例如,2β-羟基表粉蕊黄杨胺D(8)对AChE的pIC50为4.11,而因其结构中的C-2位上有羟基取代,使得其AChE抑制活性比表粉蕊黄杨胺D(epipachysamine D,pIC50=4.54,18)低,另一方面,axillaridine A(1)、sarsalignenone(2)和sarsalignone(5)因其C-4位的电负性基团使其具有较高的AChE抑制活性。在利用来自加利福尼亚电鳐的AChE和十甲季铵共结晶的分子对接实验研究中,发现来自柳叶野扇花的15个孕甾烷生物碱与AChE结合模式相同。甾体骨架中的A环结合于AChE芳烃狭谷区的最底端,可能是因为A环比D环的疏水性更强。在该类生物碱与AChE结合时,尽管芳烃狭谷的动力学有明显变化,但其结构没有出现大的重组[12]。
Yang等[13]从夹竹桃科植物止泻木Holarrhena antidysenterica Wall. ex A. DC. 的种子中分离得到5个不同的甾体类生物碱,它们在其孕甾烷骨架上都有融合的吡咯烷环,但对AChE表现出不同的抑制效果。Conessimin(19)对AChE的抑制活性最高,以石杉碱甲(huperzine A,IC50=0.06 μmol/L)作对照,其IC50为4 μmol/L。对该化合物进一步研究分析,发现其对AChE的抑制作用属于非竞争性可逆作用。另外,对这5个化合物进行构效关系分析,得知吡咯环上若消除N-甲基可明显促进其AChE抑制活性,而在C-3位上裂解掉1个或2个N-甲基将导致活性降低。
来源于百合科花贝母Fritillaria imperialis L. 鳞茎的5个甾体类生物碱有较低的AChE抑制活性,但对BChE有较强的选择性抑制作用。Lin等[14]对来源于贝母属的5种植物的18个生物碱进行研究分析,结果显示来自蒲圻贝母F. puqiensisG. D. Yu et G. Y. Chen的N-脱甲基蒲贝酮碱(N-demethyl-puqietinone,20)、来自湖北贝母F. hupehensis Hsiao et K. C. Hsia的湖贝甲素苷(hupeheninoside,21)、来源于紫花鄂北贝母F. ebeiensis G. D. Yu et G. Q. Ji var. purpurea G. D. Yu et P. Li的去氢鄂贝啶碱(ebeiedinone,22)、来源于伊贝母F. pallidifloraSchrenk ex Fisch. & C. A. Mey. 的伊贝苷A(yibeinoside A,23)和来源于梭砂贝母F. delavayi Franch. 的川贝酮(chuanbeinone,24)有较强的AChE抑制活性,以加兰他敏(galanthamine,IC50=0.5 μmol/L)作对照,其IC50分别是6.4、16.9、5.7、6.5和7.7 μmol/L。然而这5个化合物中仅有N-脱甲基蒲贝酮碱对AChE有更强的选择性抑制作用,其他4个都是对BChE的选择性抑制作用更强。对来源于贝母属植物的AChE抑制剂的结构分析,发现这些化合物通常都具有含5个或6个碳环或杂环的C-27胆甾烷碳骨架。对一系列此类生物碱的构效关系研究发现C-3位功能团的存在和C-6位酮基的作用可增强其效能。而C-20位的羟基取代和N位的甲基取代将降低其抗AChE活性。
来源于黄杨科植物乳突黄杨Buxus papillosa的7个三萜生物碱中只有buxakashmiramine(25)和环维黄杨星C(cycloprotobuxine C,黄杨碱,26)对AChE有较强的抑制作用,以毒扁豆碱(eserine,IC50=0.041 μmol/L)作对照,其IC50分别为25.4和38.8 μmol/L[15]。Ata等[16]从植物B. hyrcana L. 中分离得到19个化合物并测定了这些化合物对AChE和BChE的抑制活性,在这19个化合物中,仅有31-demethylcyclobuxoviridine(27)对BChE的选择性更强,其余18个化合物都对AChE具有相对更强的选择抑制作用,其中spirofornabuxine(28)对AChE的抑制活性最强,其IC50为6.3 μmol/L。从纳塔尔黄杨B. natalensis L. 中分离得到的12个化合物中,O2- natafuranamine(29)和O10-natafuranamine(30)的AChE抑制活性最强,其IC50分别为3.0和8.5 μmol/L。分析这2个化合物的结构可推测C-1位和C-10位间的醚键可能是使O2-natafuranamine比O10-natafuranamine抗AChE活性更强的原因[17]。Orhan等[18]报道从锦熟黄杨B. sempervirens L. 中分离到的 (+)-buxabenzamidienine(31)和(+)- buxamidine(32)对AChE具有相对更强的选择抑制作用,(+)-buxabenzamidienine对AChE和BChE的IC50分别为0.787和7.68 μmol/L,(+)-buxamidine对AChE和BChE的IC50分别为1.7和549.98 μmol/L。
对黄杨碱与AChE的对接实验研究显示:C-3和C-20位的氨基对该化合物抗AChE活性起着重要作用,并且该化合物的疏水性与其配基抑制能力相关[8, 18]。研究证明buxamine B(33)和buxamine C(34)仅在C-3和C-20上存在差异,而buxamine C(Ki=110 μmol/L)对AChE的抑制率是buxamine-B(Ki=5.5 μmol/L)的20倍。在分子对接实验中显示buxamine C比buxamine B更能深入AChE的狭谷区,其C-3位的基团与ACh的季铵基有更相似的结构,这也许可以为这两者抗AChE活性差异如此之大提供解释线索[12]。Choudhary等[19, 20]通过对9个不同的三萜类生物碱进行构效关系研究,发现C-3和C-20位的 (CH3)2N可能是决定该化合物抑制AChE活性的最重要因素。另外,在C-16和C-31位出现取代基会降低该化合物对AChE的抑制活性;另一方面,由于AChE的芳烃狭谷具有很大的灵活性,化合物的不饱和性似乎对其AChE抑制活性没有影响。具有AChE抑制活性的甾体类和三萜类生物碱化合物结构式见图 1。
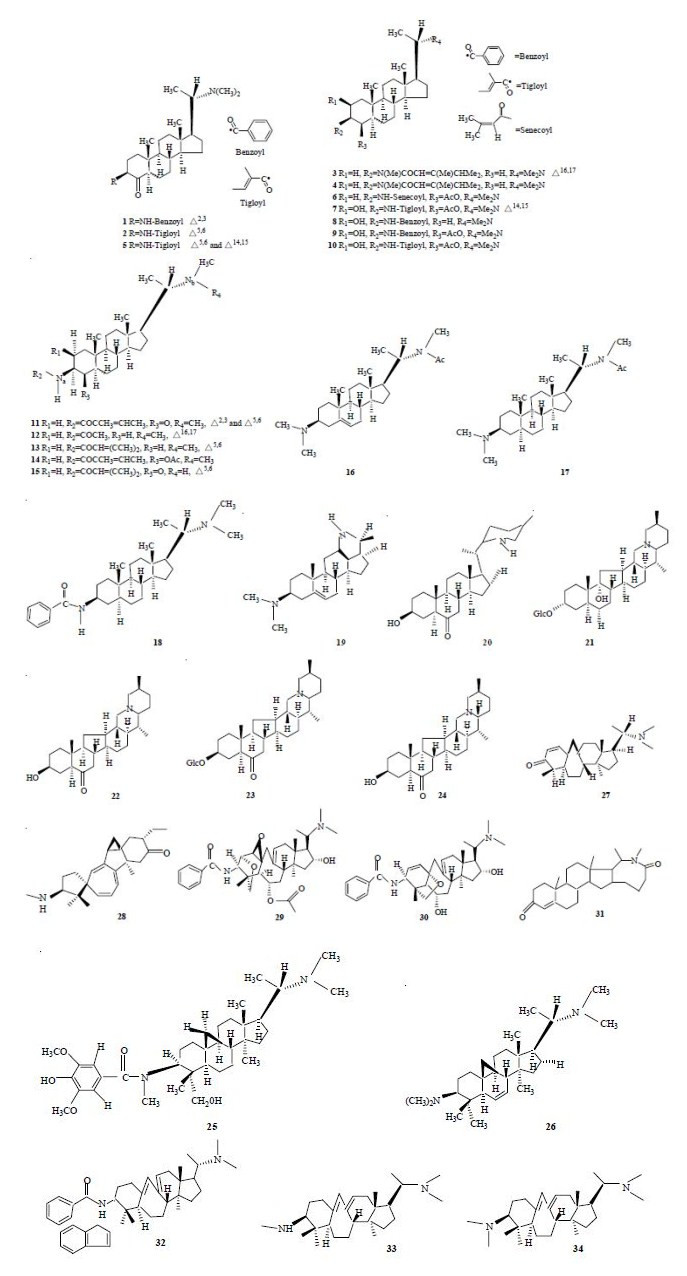 | 图 1 具有AChE抑制活性的甾体类和三萜类生物碱Fig. 1 Steroidal and triterpenoidal alkaloids with AChE inhibitory activity |
石松碱类生物碱是从蕨类植物石松及其近缘种中分得的一类天然生物碱。根据石松碱类生物碱的结构特点,可分成4大类:石松碱类、石松定碱类、伐斯替明碱类和其他类。目前,已发现有AChE抑制活性的石松碱类生物碱基本属于石松定碱类,数量较少[21]。
1986年,从蛇足石杉Huperzia serrata (Thunb. ex Murray) Trev. 中分离得到了石杉碱甲(huperzine A,35)[22]。药理实验表明该化合物是一个高效、可逆和低毒的高选择性的AChE抑制剂,因此该化合物成了药物学领域的研究热点之一[23]。大量研究表明,石杉碱甲的结构与其AChE的抑制活性密切相关,其结构中的吡诺酮环、三碳桥环、环外双键和氨基都是其抑制AChE的必要元素,并且其左旋的光学活性也不可或缺。
蛇足石杉中除石杉碱甲外,蛇足石杉碱(huperzinine,36)、石杉碱乙(huperzine B,37)、N-甲基石杉碱乙(N-methyl-huperzine B,38)、carinatumin A(IC50=4.6 μmol/L,39)和carinatumin B(IC50=7.0 μmol/L,40)也有较强的抑制AChE活性,这类化合物一般也是四环,形成2个喹诺啉环单元[21, 24]。另外,从蛇足石杉中分离到的2α,11α-二羟基伐斯替定(2α,11α-dihydroxyfawcettidine,41)和lycoposerramine H(42)对AChE也显示出抑制活性,其IC50分别是27.9和16.7 μmol/L[25, 26]。从石松属植物石子藤石松Lycopodium casuarinoides (Spring) Holub ex Dixit中分离得到3个新生物碱lycoparin A~C(43~45),其中仅有lycoparin C(IC50=25 μmol/L)显示有AChE抑制活性,而另2个化合物对AChE几乎没有抑制活性,可能与它们结构中有1个或2个N-甲基以及其C-15位的羧基有关[27]。
一些C27N3石松碱类生物碱除了来源于L. cryptomerinum Maxim. 的cryptadine B(46)抑制AChE的IC50为18.5 μmol/L外,其他有类似结构的化合物IC50都大于60 μmol/L[28]。石松碱类生物碱中抗AChE活性最高的化合物中还有一种是来源于鳞叶马尾杉L. sieboldii (Miq.) Ching的sieboldine A(IC50=2.0 μmol/L,47),这是一个伐斯替明碱的衍生物,其结构中有包含氮杂环壬烷、环己酮、环戊酮和四氢呋喃的四环系统[29]。
最近Konrath等[30]研究了来自巴西的石杉属和石松属植物,发现从中分离出的单个生物碱有些比其生物碱总提取物抗AChE活性低。如垂穗石松L. cernua L. 生物碱总提物抑制AChE的IC50是42.6 μmol/L,而其中主要成分垂穗石松碱(cernuine,48)和羟基垂穗石松碱(lycocernuine,49)的IC50分别为32.7 μmol/L和大于250 μmol/L。另外,东北石松L. clavatum L. 和L. thyoidies L. 植物中的主要生物碱成分乙酰二氢石松碱(acetyldihydrolycopodine,50)抗AChE的IC50是84.7 μmol/L,而石松碱(lycopodine,51)的AChE抑制能力很低,这表明该类化合物的乙酰化对其抗AChE能力有积极作用。具有AChE抑制活性的喹诺里西丁类生物碱化合物结构式见图 2。
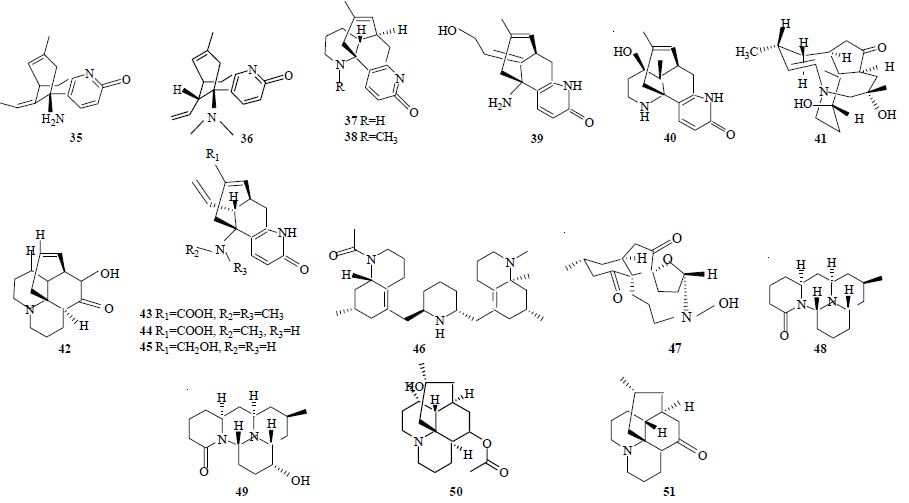 | 图 2 具有AChE抑制活性的喹诺里西丁类生物碱Fig. 2 Quinolizidine-typealkaloids with AChE inhibitory activity |
迄今为止已从石蒜科植物中发现石蒜碱等生物碱500余种,它们主要属于异喹啉类生物碱。这类生物碱结构多样,根据其骨架特点,可分成9种类型[31]:norbelladine型、石蒜碱(lycorine)型、高石蒜碱(homolycorine)型、文殊兰碱(crinine)型、网球花碱(haemanthamine)型、水仙环素(narciclasine)型、水仙花碱(tazettine)型、高山网球花碱(montanine)型和加兰他敏(galantamine)型。石蒜科生物碱中的许多化合物对中枢神经系统具有较强的生理活性。
从孤挺花属植物凤蝶朱顶红Hippeastrum papilio (Ravenna) Van Scheepen的鳞茎和叶中分离得到了加兰他敏(galanthamine,IC50=1.5 μmol/L,52)等7个生物碱[32],其中包括1个新发现的生物碱11β-羟基加兰他敏(11β-hydroxygalanthamine,53),其抑制AChE的IC50为14.5 μmol/L。研究表明,加兰他敏通过作用于AChE谷底部的活性位点,与其酰基口袋(Phe288、Phe290)及胆碱结合位点Trp84的吲哚环发生相互作用而产生对AChE的抑制作用[31]。在雪片莲属植物夏雪片莲Leucojum aestivum L. 中发现其他一些有效的AChE抑制剂[33],如N-烯丙基去甲加兰他敏(N-allylnorgalanthamine,IC50=0.18 μmol/L,54)和N-(甲基烯丙基) 去甲加兰他敏 [N-(14-methylallyl) norgalanthamine,IC50=0.16 μmol/L,55]。Lopez等[34]对23个石蒜科生物碱单体化合物以及水仙属中23种植物的提取物进行了AChE抑制活性研究,发现只有7个生物碱显示有较强活性,其中最强的是sanguinine(56),对比加兰他敏,其抗AChE的IC50为0.10 μmol/L,这种高抑制活性可能与该化合物结构中有可与AChE潜在相互作用的多羟基基团有关。最近,Iannello等[35]从全能花属植物Pancratium illyricum L. 的鳞茎和叶中提取到1个新的加兰他敏型生物碱11α-hydroxy-O-methylleucotamine(57),其抑制AChE的IC50为(3.5±1.1)μmol/L。氢化加兰他敏比加兰他敏活性更高,可见在加兰他敏结构上适当添加亲水基团有助于增强其与酶结合位点的有效连接。同样该化合物亲水基团的立体构象也对其抗AChE活性有影响,研究发现11β-羟基加兰他敏的抗AChE活性较其差向异构体11α-羟基加兰他敏(11α-hydroxy-galanthamine,IC50=1.61 μmol/L,58)低,可见C-11位的β构型不利于其与AChE的相互作用从而会降低其活性,而11α-hydroxy-O- methylleucotamine的抗AChE活性比11α-羟基加兰他敏也要低,可能是由于该化合物C-3位的较大取代基丁酰基团的作用结果[36, 37]。
除加兰他敏型生物碱外,石蒜科生物碱中有AChE抑制活性的化合物大都属于石蒜碱型生物碱[34, 38, 39],如波叶尼润碱(undulatine,IC50=37 μmol/L,59)、oxoassonine(IC50=47.2 μmol/L,60)、assoanine(IC50=3.87 μmol/L,61)和1-O-乙酰基石蒜碱(1-O- acetyllycorine,IC50=0.96 μmol/L,62)。assoanine有如此高的活性可能与其芳香C环的存在有关,而1-O-acetyllycorine的活性则与其在C-1和C-2位的乙酰氧基和羟基取代有关。研究发现,C环的芳香化有利于提高化合物的抗AChE活性,如assoanine的活性明显比石蒜碱(lycorine,IC50=213 μmol/L,63)高。在百合科玉簪Hosta plantaginea (Lam.) Aschers.中,Wang等[40]分离出17个石蒜科生物碱,并对部分化合物进行了抑制AChE活性检测,发现恩其明(ungeremine,64)、norsanguinine(65)和8-demethoxy-10-O-methylhostasine(66)有较强的活性,其抑制AChE的IC50分别为3.85、1.43和2.32 μmol/L。恩其明属于季铵石蒜碱型生物碱,对AChE有相当高的抑制活性,可归因于其结构中的芳香C环和季氮原子。此外,incartine(IC50=106.97 μmol/L,67)若其结构上增添甲基和环氧基团也有利于提高抗AChE活性,如同样来源于雪花莲属植物里泽雪滴花Galanthus rizehensis L. 的incartine N-oxide(68)抑制AChE的IC50为34.5 μmol/L[41]。具有AChE抑制活性的石蒜科生物碱结构式见图 3。
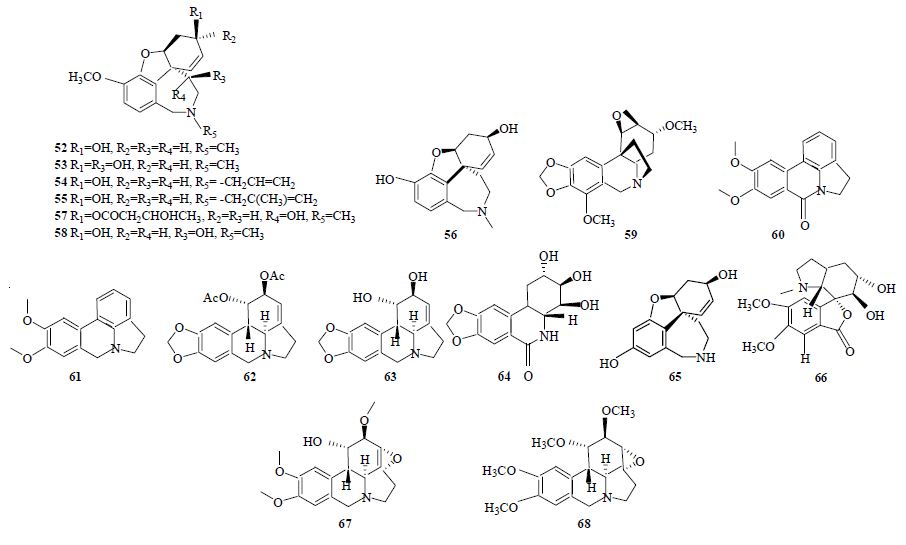 | 图 3 具有AChE抑制活性的石蒜科生物碱Fig. 3 Amaryllidaceae alkaloids with AChE inhibitory activity |
Zheng等[42]从蒺藜科骆驼蒿Peganum nigellastrum Bunge的种子中分离到2个新化合物nigellastrine I(69)和II(70)以及8个已知生物碱,通过TLC生物自显影检测法发现这些化合物都有AChE抑制活性。其中具有β-咔啉结构的去氢骆驼蓬碱(harmine,71)、骆驼蓬碱(harmaline,72)、去甲氧基骆驼蓬碱(harmol,73)和哈尔满(harman,74)抗AChE活性类似于加兰他敏,而喹啉类的鸭嘴花酮(vasicinone,75)、脱氧鸭嘴花酮(deoxyvasicinone,76)、脱氧鸭嘴花碱(deoxyvasicine,77)以及同时有喹啉环和咔啉结构的化合物nigellastrine I和II对AChE的抑制活性相对较弱。
Yang等[43]从莲科荷花Nelumbo nucifera Gaertn.中提取分离3个阿卟啡类生物碱,从结构上看这3个化合物是类似物,然而只有N-甲基巴婆碱(N-methyl-asimilobine,78)显示有AChE抑制活性,其抑制AChE的IC50为1.5 μmol/L,研究发现该化合物是一种非竞争性可逆抑制剂,其C-2位的羟基对抑制AChE起重要作用。塔斯品碱(taspine,79)是从木兰科植物二乔木兰Magnolia soulangiana Soul. -Bod. 中分离出来的,该生物碱对AChE的抑制活性很高而对BChE无抑制活性,体外检测显示其对人AChE的IC50为0.54 μmol/L,并发现这种抑制作用呈剂量依赖关系[44]。从琼楠属植物Beilschmiedia alloiophylla (Rusby) Kosterm.和B. kunstleri Gamble中提取分离到几个具有抗AChE(IC50 2.0~10.0 μmol/L)的生物碱,其中新发现的化合物2-羟基-9-甲氧基阿卟啡类(2-hydroxy- 9-methoxyaporphine,80)活性最强[45]。对民间用于治疗记忆障碍的罂粟科紫堇属植物的研究发现其中存在可抑制AChE活性的苄基异喹啉生物碱。Hung等[46]从齿瓣延胡索Corydalis turtschaninovii Bess. 块茎的乙醇提取物中分离出5个生物碱,分别为刺罂粟碱(stylopine,81)、表小檗碱(epiberberine,82)、伪脱氢延胡索碱(pseudodehydrocorydaline,83)、伪黄连碱(pseudocopsitine,84)和伪小檗碱(pseudoberberine,85),以他克林(tacrine,IC50=0.17 μmol/L)为对照,其抑制AChE的IC50依次为15.8、6.5、8.4、4.3和4.5 μmol/L,其中伪黄连碱(84)和伪小檗碱(85)还发现有抗失忆作用[47]。来源于C. cava (L.) Schweigg. & Körte的 (+)-canadaline(86)和 (+)-小檗碱 [(+)-canadine,87] 对AChE有一定抑制作用[48],其抗AChE的IC50分别为20.1和12.4 μmol/L。来源于紫堇属植物的苄基异喹啉类生物碱中含有芳香甲二氧基和季氮原子,具有较强的AChE抑制活性[46, 47, 48, 49]。
Jung等[50]对来源于黄连属植物黄连Coptis chinensis Franch. 根茎的6个原小檗碱进行了AChE抑制活性检测,发现以毒扁豆碱(eserine,IC50=0.02 μmol/L)作对照,小檗碱(berberine,88)、巴马汀(palmatine,89)、药根碱(jateorrhizine,90)、黄连碱(coptisine,91)和groenlandicine(92)抑制AChE的IC50在0.44~0.80 μmol/L。从防己科(Menispermaceae)千金藤属植物Stephania venosa Spreng. 中分离出3个季铵型原小檗碱类生物碱,分别是千金藤宁(stepharanine,93)、轮环藤酚碱(cyclanoline,94)和N-甲基光千金藤定碱(N-methyl stepholidine,95),其抑制AChE的IC50依次为14.10、9.23和31.30 μmol/L[51]。Cho等[52]从罂粟科白屈菜属植物Chelidonium majus L. var. grandiflorum DC.中分离到2个生物碱8-羟基二氢白屈菜红碱(8-hydroxydihydrochelerythrine,96)和8-羟基二氢血根碱(8-hydroxydihydrosanguinarine,97),其对AChE有更强的选择抑制作用,其抗AChE的IC50分别为0.61和1.37 μmol/L。
对小檗碱和巴马汀抑制AChE活性检测发现,小檗碱的活性更高。分子模拟研究表明,小檗碱与AChE中的8个疏水残基相互作用,也有可能与AChE的Tyr-121间以氢键连接[53]。白屈菜红碱(chelerythrine,98)对AChE也有较强的抑制作用,且对人AChE [IC50=(1.54±0.07)μmol/L] 抑制作用比电鳐AChE [IC50=(3.78±0.15)μmol/L] 更强。在白屈菜红碱与AChE对接的模拟实验中发现白屈菜红碱可以通过与AChE的Tyr-130建立氢键以及与Tyr-121、Tyr-334外围阳离子残基形成π-堆积作用结合到电鳐AChE活性位点。这种结合方式显示该化合物有可能具有靶向抑制AChE诱导Aβ原纤维聚集过程的功能。进一步实验证明,白屈菜红碱在浓度为5、10和100 μmol/L时能够抑制AChE诱导Aβ原纤维的形成,且该抑制作用呈现剂量依赖关系,在100 μmol/L时抑制率接近90%[54]。
Cardoso-Lopes等[54]从芸香科植物Esenbeckia leiocarpa Engl. 茎中分离到6个生物碱,并发现这些化合物对AChE都有抑制活性,体外实验显示其中leptomerine(99)的活性最高,以加兰他敏(IC50=1.7 μmol/L)作对照,其抗AChE的IC50为2.5 μmol/L。其次,香草木宁碱(kokusaginine,100)抗AChE的IC50为46 μmol/L。此外,从此植物中还分离到1个呋喃喹啉类生物碱茵芋碱(skimmianine,101),结果显示其AChE抑制能力较弱,其IC50为1.4 mmol/L。然而,Yang等[56]从芸香科植物两面针Zanthoxylum nitidum (Roxb.) DC. 中分离到的茵芋碱显示有很强的AChE抑制活性,其抗AChE的IC50为8.6 μmol/L。将茵芋碱与其结构类似的白藓碱(dictamnine,102)、γ-花椒碱(γ-fagarine,103)和7-羟基-8-甲氧基白藓碱(haplopine,104)进行对比,发现仅有茵芋碱有显著的AChE抑制活性,推测该化合物C-7位的甲氧基能明显提高其对AChE的抑制活性。具有AChE抑制活性的苄基四氢异喹啉类生物碱结构式见图 4。
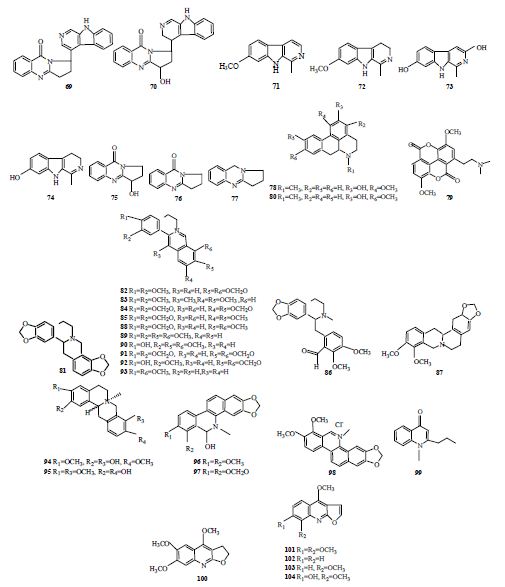 | 图 4 具有AChE抑制活性的苄基四氢异喹啉类生物碱 Fig. 4 Benzylphenethylamine alkaloids with AChE inhibitory activity |
毒扁豆碱(physostigmine,105)是已知最早的天然AChE抑制剂,它于1864年由Jobst和Hesse从非洲西部毒扁豆Physostigma venenosum Balf种子中分离得到,到1925年才被Stedman和Barger确定出其结构。该化合物属于一类C-3取代的四氢吡咯并吲哚环系的天然生物碱,其胺甲酰氧基部分是其抑制AChE的主要活性基团,该基团可与AChE的酯解部位结合,使酯解部位丝氨酸上的羟基胺甲酰化从而发挥作用[57]。因其临床应用于治疗AD作用时间短、毒副作用较大,目前很多研究集中在对该化合物的结构改造方面。
近年来,从植物中还分离到有AChE抑制活性的吲哚生物碱,其来源主要是夹竹桃科(Apocynaceae)植物。长春花属植物长春花Catharanthus roseus (L.) G. Don的根中分离到蛇根碱(serpentine,106),对其体外抗AChE活性检测发现相对毒扁豆碱(IC50=6.45 μmol/L)其IC50为0.775 μmol/L[58]。从海南狗牙花Ervatamia hainanensis Tsiang的茎中也分离到几个单萜吲哚生物碱,其中部分显示有AChE抑制活性,如狗牙花定(coronaridine,IC50=8.6 μmol/L,107)、老刺木碱(voacangine,IC50=4.4 μmol/L,108)和10-羟基狗牙花定(10-hydro-xycoronaridine,IC50=29 μmol/L,109)。对比这3个化合物的结构,可以看到狗牙花定与老刺木碱结构上的差异仅在芳香环,老刺木碱因其芳香环结合了甲氧基而显示出比狗牙花定更高的活性,而10-羟基狗牙花定由于其芳香环上存在羟基而导致其活性降低,可见该类化合物的结构中芳香环上的取代基直接影响其抑制AChE的活性[59]。另外从单瓣狗牙花Tabernaemontana divaricata (L.) Burk. cv. Gouyahua的根中发现4个双吲哚生物碱[60],其中19,20-dihydrotabernamine(110)和19,20-dihydroervahanine A(111)有很高的AChE抑制活性,其IC50分别为0.227和0.071 μmol/L,均比加兰他敏活性强。而另外2个化合物conodurine(112)和tabernaelegantine(113)则显示没有抑制活性。对比4个化合物的结构,可知在C-16位的甲酯基增强了19,20-dihydroervahanine A的抗AChE活性,C-11和C-12位的取代基也直接影响着抗AChE活性。Seidl等[61]从Himatanthus lancifolius (Müll. Arg.) Woodson中分离出1个抗AChE活性很强的吲哚生物碱乌勒因(uleine,114),其IC50为0.45 μmol/L。
茜草科(Rubiaceae)植物钩藤Uncaria rhynchophylla (Miq.) Jacks是常用于治疗癫痫的一种中药,其生物碱提取物有抗癫痫和神经保护作用。Yang等[62]从该植物中分离出7个生物碱,其中缝籽嗪甲醚(geissoschizine methyl ether,115)有较强的AChE抑制活性,其IC50为3.7 μmol/L。具有AChE抑制活性的毒扁豆碱和吲哚类生物碱结构式见图 5。
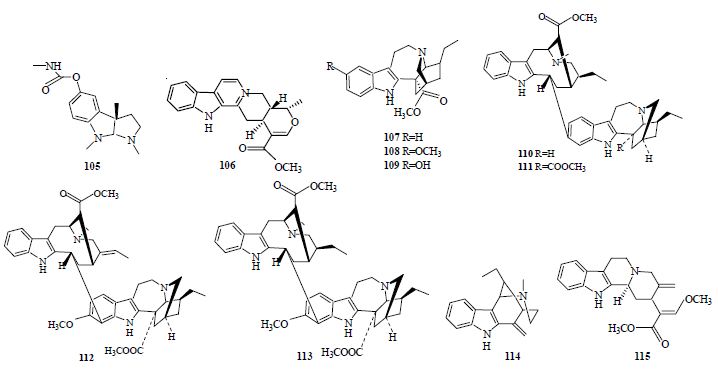 | 图 5 具有AChE抑制活性的毒扁豆碱和吲哚类生物碱Fig. 5 Physostigmine and indole alkaloids with AChE inhibitory activity |
Juliflorin(116)是一种来源于豆科柔荑花牧豆树Prosopis juliflora (Swartz) DC. 叶的哌啶类生物碱,其对AChE抑制作用呈非竞争性剂量依赖关系,对AChE的IC50为0.42 μmol/L。该化合物结构中的哌啶环A和B通过1个二氢吲嗪环结构以脂肪链连接。将其与电鳐AChE进行了对接实验研究,发现在对接中该化合物的C/D环深入芳烃狭谷而A环和B环留在顶端,这可能是由于二氢吲嗪环的疏水性所致。此生物碱能够以多结合位点跨越整个芳烃狭谷,其中已确定的分子间作用包括氢键、疏水作用、π-π相互作用和亲水-疏水相互作用[63]。
芥子碱(sinapine,117)是普遍存在于十字花科植物中的一种具有很多生物活性的酚类小分子生物碱。何玲等[64]对芥子碱进行了抑制大鼠血清和脑匀浆中AChE的作用研究,发现芥子碱具有显著的AChE抑制活性,其对大鼠脑匀浆AChE的抑制作用(IC50=3.66 μmol/L)强于对血清AChE的抑制活性(IC50=22.1 μmol/L),结果显示芥子碱有可能作为AChEI治疗AD,但进一步研究还未见报道。
Chonpathompikunlert等[65]发现来源于胡椒科植物胡椒Piper nigrum L. 果实中的胡椒碱(piperine,118)也能显著改善记忆,其可能是通过抑制脂质过氧化作用并降低脑内AChE水平来改善神经退行性病变。具有AChE抑制活性的其他类生物碱结构式见图 6。
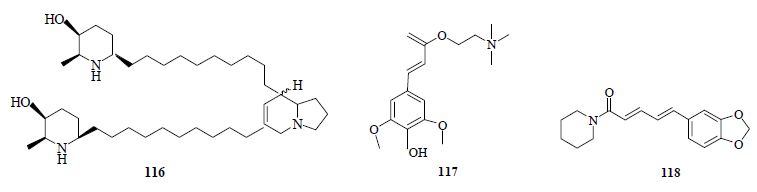 | 图 6 具有AChE抑制活性的其他类生物碱Fig. 6 Miscellaneous alkaloids with AChE inhibitory activity |
植物来源的天然产物中有AChE抑制活性的生物碱种类丰富,主要包括甾体类、三萜类、石松碱类、异喹啉类和吲哚类生物碱,其中对AChE有抑制作用且IC50低于10 μmol/L的化合物有70余个。对这些化合物有的同时测定了其抑制AChE和BChE的活性,甾体类生物碱中,除了N-脱甲基蒲贝酮碱对AChE有更强的选择抑制作用外,其他大部分都对BChE选择性抑制作用更强,而三萜类生物碱大都对AChE有更强的选择性抑制作用,如 (+)-buxabenzamidienine、(+)-buxamidine。石松生物碱类中有较高抗AChE活性的化合物,主要是石松定碱类。石蒜科植物中发现几个比加兰他敏抗AChE作用更强的生物碱,如sanguinine、1-O-乙酰基石蒜碱,但目前由于其在植物原料中的量极低而影响了其进一步的开发应用。异喹啉类生物碱中有较多高活性AChE抑制剂,如小檗碱、巴马汀、白屈菜红碱和黄连碱,只是目前研究表明这几个化合物的理化特性使得其口服生物利用度差。狗牙花属植物中分到的吲哚类生物碱也有很好的AChE抑制潜力。另外,基于分子建模研究,预测了这些化合物与酶活性位点上的氨基酸残基相互作用的方式,这为新的胆碱酯酶抑制剂的发展提供了思路。
具有抗胆碱酯酶活性的生物碱结构类型多种多样,使之成为寻找高效AD治疗药物的重要来源。目前对化合物抗AChE活性的研究大都是体外检测,药物代谢动力学、毒副作用以及体内抗AChE活性等研究都有待进一步加强。
| [1] | 聂纯. 治疗老年性痴呆的天然药物成分[J]. 中草药, 2000, 31(7): 10-12. |
| [2] | 杨建红, 陶媛媛, 张云梅, 等. 药用植物中乙酰胆碱酯酶抑制剂研究进展[J]. 云南化工, 2006, 33(6): 78-82. |
| [3] | Figueiró M, Pochmann D, Porciúncula L O, et al. Inhibition of Ptychopetalum olacoides on acetylcholinesterase isoforms in brain of mice[J]. Chin Herb Med, 2012, 4(3): 189-194. |
| [4] | 楼影涵, 查晓明, 张莉莉, 等. 来源于天然产物的乙酰胆碱酯酶抑制剂研究进展[J]. 药学进展, 2012, 36(9): 385-393. |
| [5] | 左茹, 曹雪滨, 张文生. 黄连素治疗阿尔茨海默病的研究进展[J]. 中草药, 2014, 45(8): 1184-1187. |
| [6] | Rahman A U, Ul-Haq Z, Khalid A, et al. Pregnane-Type steroidal alkaloids of Sarcococca saligna: a new class of cholinesterase inhibitors[J]. Helv Chim Acta, 2002, 85: 678-688. |
| [7] | Rahman A U, Feroz F, Naeem I, et al. New pregnane-type steroidal alkaloids from Sarcococca saligna and their cholinesterase inhibitory activity[J]. Steroids, 2004, 69(11/12): 735-741. |
| [8] | Khalid A, Zaheerul H, Anjum S, et al. Kinetics and structure-activity relationship studies on pregnane-type steroidal alkaloids that inhibit cholinesterases[J]. Bioorg Med Chem, 2004, 12(9): 1995-2003. |
| [9] | Devkota K P, Lenta B N, Choudhary M I, et al. Cholinesterase inhibiting and antiplasmodial steroidal alkaloids from Sarcococca hookeriana[J]. Chem Pharm Bull, 2007, 55(9): 1397-1401. |
| [10] | Devkota K P, Bruno N, Jean D, et al. Bioactive 5α-pregnane-type steroidal alkaloids from Sarcococca hookeriana[J]. J Nat Prod, 2008, 71(8): 1481-1484. |
| [11] | Zaheerul H, Wellenzohn B, Tonmunphean S, et al. 3D-QSAR studies on natural acetylcholinesterase inhibitors of Sarcococca saligna by comparative molecular field analysis (CoMFA)[J]. Bioorg Med Chem, 2003, 13(24): 4375-4380. |
| [12] | Zaheerul H, Wellenzohn B, Klaus R, et al. Molecular docking studies of natural cholinesterase-inhibiting steroidal alkaloids from Sarcococca saligna[J]. J Med Chem, 2003, 46(23): 5087-5090. |
| [13] | Yang Z, Duan D Z, Xue W W, et al. Steroidal alkaloids from Holarrhena antidysenterica as acetylcholinesterase inhibitors and the investigation for structure-activity relationships[J]. Life Sci, 2012, 90(23/24): 929-933. |
| [14] | Lin B Q, Ji H, Li P, et al. Inhibitors of acetylcholine esterase in vitro-Screening of steroidal alkaloids from Fritillaria species[J]. Planta Med, 2006, 72(9): 814-818. |
| [15] | Rahman A U. Acetyl and butyrylcholinesterase-inhibiting triterpenoid alkaloids from Buxus papillosa[J]. Phytochemistry, 2001, 58(6): 963-968. |
| [16] | Ata A, Iverson C D, Kalhari K S, et al. Triterpenoidal alkaloids from Buxus hyrcana and their enzyme inhibitory, anti-fungal and anti-leishmanial activities[J]. Phytochemistry, 2010, 71(14/15): 1780-1786. |
| [17] | Matochko W L, James A, Lam C W, et al. Triterpenoidal alkaloids from Buxus natalensis and their acetylcholinesterase inhibitory activity[J]. J Nat Prod, 2010, 73(11): 1858-1862. |
| [18] | Orhan I E, Khan T H, Erdem M A, et al. Selective cholinesterase inhibitors from Buxus sempervirens L. and their molecular docking studies[J]. Curr Computer-Aided Drug Design, 2011, 7(4): 276-286. |
| [19] | Choudhary M I, Shahnaz S, Parveen S, et al. New triterpenoid alkaloid cholinesterase inhibitors from Buxus hyrcana[J]. J Nat Prod, 2003, 66(6): 739-742. |
| [20] | Choudhary M I, Shahnaz S, Parveen S, et al. New cholinesterase-inhibiting triterpenoid alkaloids from Buxus hyrcana[J]. Chem Biodiv, 2006, 3(9): 1039-1052. |
| [21] | 谭昌恒, 朱大元. 石松生物碱研究进展[J]. 中国天然药物, 2003, 1(1): 1-7. |
| [22] | 易家宝, 颜杰, 李旭明. 石杉碱甲结构改造的研究进展[J]. 天然产物研究与开发, 2009, 21(6): 1080-1083. |
| [23] | 袁经权, 周小雷, 王硕, 等. 蛇足石杉化学成分和药理作用研究进展[J]. 中草药, 2012, 43(2): 399-407. |
| [24] | Choo C Y, Hirasawa Y, Karimata C, et al. Carinatumins A-C, new alkaloids from Lycopodium carinatum inhibiting acetylcholinesterase[J]. Bioorg Med Chem, 2007, 15(4): 1703-1707. |
| [25] | Katakawa K, Nozoe A, Kogure N, et al. Fawcettimine-related alkaloids from Lycopodium serratum[J]. J Nat Prod, 2007, 70(6): 1024-1028. |
| [26] | Takayama H, Katakawa K, Kitajima M, et al. Ten new Lycopodium alkaloids having the lycopodane skeleton isolated from Lycopodium serratum Thunb[J]. Chem Pharm Bull, 2003, 51(10): 1163-1169. |
| [27] | Hirasawa Y, Kato E, Kobayashi J, et al. Lycoparins A-C, new alkaloids from Licopodium casuarinoides inhibiting acetylcholinesterase[J]. Bioorg Med Chem, 2008, 16(11): 6167-6171. |
| [28] | Koyama K, Hirasawa Y, Kobayashi J, et al. Cryptadines A and B, novel C27N3-type pentacyclic alkaloids from Lycopodium cryptomerinum[J]. Bioorg Med Chem, 2007, 15(24): 7803-7808. |
| [29] | Hirasawa Y, Morita H, Shiro M, et al. Sieboldine A, a novel tetracyclic alkaloid from Lycopodium sieboldii, inhibiting acetyl-cholinesterase[J]. Organic Lett, 2003, 5(21): 391-3993. |
| [30] | Konrath E L, Passos C S, Klein-Júnior L C, et al. Alkaloids as a source of potential anticholinesterase inhibitors for the treatment of Alzheimer's disease[J]. J Pharm Pharmacol, 2013, 65(12): 1701-1725. |
| [31] | 宋德芳, 石子琪, 辛贵忠, 等. 石蒜科生物碱的药理作用研究进展[J]. 中国新药杂志, 2012, 22(13): 1519-1524. |
| [32] | de Andrade J P, Berkov S, Viladomat F, et al. Alkaloids from Hippeastrum papillo[J]. Molecules, 2011, 16(8): 7097-7104. |
| [33] | Berkov S, Codina C, Viladomat, F, et al. N-Alkylated galanthamine derivatives: Potent acetylcholinesterase inhibitors from Leucojum aestivum[J]. Bioorg Med Chem Lett, 2008, 18(7): 2263-2266. |
| [34] | Lopez S, Bastida J, Viladomat F, et al. Acetylcholinesterase inhibitory activity of some Amarylli-daceae alkaloids and Narcissus extracts[J]. Life Sci, 2002, 71(21): 2521-2529. |
| [35] | Iannello C, Pigni N B, Antognoni F, et al. A potent acetylcholinesterase inhibitor from Pancratium illyricum L.[J]. Fitoterapia, 2014, 92: 163-167. |
| [36] | Reyes-Chilpa R, Berkov S, Jankowski C K, et al. Acetylcholinesterase-inhibiting alkaloids from Zephyranthes concolor[J]. Molecules, 2011, 16(11): 9520-9533. |
| [37] | Bartolucci C, Perola E, Pilger C, et al. Three-dimensional structure of a complex of galan-thamine (Nivalin) with acetylcho-linesterase from Torpedo californica: implications for the design of new anti-Alzheimer drugs[J]. Proteins, 2001, 42(2): 182-191. |
| [38] | Rijn R M, Rhee I K, Verpoorte R. Isolation of acetylcholinesterase inhibitory alkaloids from Nerine bowdenii[J]. Nat Prod Res, 2010, 24(3): 222-225. |
| [39] | Elgorashi E E, Stafford G I, van Staden J. Acetylcholinesterase enzyme inhibitory effects of Amaryllidaceae alkaloids[J]. Planta Med, 2004, 70(3): 260-262. |
| [40] | Wang Y H, Zhang Z K, Yang F M, et al. Benzylphenethylamine alkaloids from Hosta plantaginea with inhibitory activity against tobacco mosaic virus and acetylcholinesterase[J]. J Nat Prod, 2007, 70(9): 1458-1461. |
| [41] | Sarikaya B B, Kaya G I, Onur M A, et al. Alkaloids from Galanthus rizehensis[J]. Phytochem Lett, 2012, 5(2): 367-370. |
| [42] | Zheng X Y, Zhang Z J, Chou G X, et al. Acetylcholinesterase inhibitive activity-guided isolation of two new alkaloids from seeds of Peganum nigellastrum Bunge by an in vitro TLC-bioautographic assay[J]. Archiv Pharmacol Res, 2009, 32(9): 1245-1251. |
| [43] | Yang Z, Zhang X, Du J, et al. An aporphine alkaloid from Nelumbo nucifera as an acetylcholinesterase inhibitor and the primary investigation for structure-activity correlations[J]. Nat Prod Res, 2012, 26(5): 387-392. |
| [44] | Rollinger J M, Schuster D, Baier E, et al. Taspine: bioactivity-guided isolation and molecular ligand-target insight of a potent acetylcholinesterase inhibitor from Magnolia x soulangiana[J]. J Nat Prod, 2006, 69(9): 1341-1346. |
| [45] | Mollataghi A, Coudiere E, Hadi A H, et al. Anti- acetylcholinesterase, anti-glucosidase, anti-leishmanial and anti-fungal activities of chemical constituents of Beilschmiedia species[J]. Fitoterapia, 2012, 83(2): 298-302. |
| [46] | Hung T M, Na M, Dat N T, et al. Cholinesterase inhibitory and anti-amnesic activity of alkaloids from Corydalis turtschaninovii[J]. J Ethnopharmacol, 2008, 119(1): 74-80. |
| [47] | Hung T M, Ngoc T M, Youn U J, et al. Anti-amnesic activity of pseudocoptisine from Corydalis Tuber.[J]. Biol Pharm Bull, 2008, 31(1): 159-162. |
| [48] | Chlebek J, Macáková K, Cahlíkovi L, et al. Acetylcholinesterase and butyrylcholinesterase inhibitory compounds from Corydalis cava (Fumariaceae)[J]. Nat Prod Commun, 2011, 6(5): 607-610. |
| [49] | Houghton P J, Ren Y, Howes M J, et al. Acetylcholinesterase inhibitors from plants and fungi[J]. Nat Prod Rep, 2006, 23: 181-199. |
| [50] | Jung H A, Min B S, Yokozawa T, et al. Anti-alzheimer and antioxidant activities of Coptidis Rhizoma alkaloids[J]. Biol Pharm Bull, 2009, 32(8): 1433-1438. |
| [51] | Ingkaninan K, Phengpa P, Yuenyongsawad S, et al. Acetylcholinesterase inhibitors from Stephania venosa Tuber.[J]. J Pharm Pharmacol, 2006, 58(5): 695-700. |
| [52] | Cho K M, Yoo I D, Kim W G. 8-Hydroxydihy- drochelerythrine and 8-hydroxydihydrosanguinarine with a potent acetylcholinesterase inhibitory activity from Chelidonium majus[J]. Biol Pharm Bull, 2006, 29(11): 2317-2320. |
| [53] | Ji H F, Shen L. Molecular basis of inhibitory activities of berberine against pathogenic enzymes in Alzheimer's disease[J]. Sci World J, 2012, 2012: 823201. |
| [54] | Brunhofer G, Fallarero A, Karlsson D, et al. Exploration of natural compounds as sources of new bifunctional scaffolds targeting cholinesterases and beta amyloid aggregation: the case of chelerythrine[J]. Bioorg Med Chem, 2012, 20(22): 6669-6679. |
| [55] | Cardoso-Lopes E M, Maier J A, da Silva M R, et al. Alkaloids from stems of Esenbeckia leiocarpa Engl. (Rutaceae) as potential treatment for Alzheimer disease[J]. Molecules, 2010, 15(12): 9205-9213. |
| [56] | Yang Z, Zhang D, Ren J, et al. Skimmianine, a furoquinoline alkaloid from Zanthoxylum nitidum as a potential acetylcholinesterase inhibitor[J]. Med Chem Res, 2012, 21: 722-725. |
| [57] | 王明亮, 傅辛福, 戴永健, 等. 毒扁豆碱类似物抑制胆碱酯酶构效关系的研究[J]. 中国药物化学杂志, 1997, 7(1): 59-62. |
| [58] | Pereira D M, Ferreres F, Oliveira J M, et al. Pharmacological effects of Catharanthus roseus root alkaloids in acetylcholinesterase inhibition and cholinergic neurotransmission[J]. Phytomedicine, 2010, 17(8/9): 646-652. |
| [59] | Zhan Z J, Yu Q, Wang Z L, et al. Indole alkaloids from Ervatamia hainanensis with potent acetylcholinesterase inhibition activities[J]. Bioorg Med Chem Lett, 2010, 20(21): 6185-6187. |
| [60] | Ingkaninan K, Changwijit K, Suwanborirux K. Vobasinyliboga bisindole alkaloids, potent acetylcholinesterase inhibitors from Tabernaemontana divaricata root[J]. J Pharm Pharmacol, 2006, 58(6): 847-852. |
| [61] | Seidl C, Correia B L, Stinghen A E, et al. Acetylcholinesterase inhibitory activity of uleine from Himatanthus lancifolius[J]. Zeitschrift Naturforschung C: J Biosci, 2010, 65(7/8): 440-444. |
| [62] | Yang Z, Duan D Z, Du J, et al. Geissoschizine methyl ether, a corynanthean-type indole alkaloid from Uncaria rhynchophylla as a potential acetylcholinesterase inhibitor[J]. Nat Prod Res, 2012, 26(1): 22-28. |
| [63] | Choudhary M I, Nawaz S A, Zaheerul H, et al. Juliflorine: a potent natural peripheral anionic-site-binding inhibitor of acetylcho-linesterase with calcium-channel blocking potential, a leading candidate for Alzheimer's disease therapy[J]. Biochem Biophys Res Commun, 2005, 332(4): 1171-1177. |
| [64] | 何玲, 李海涛, 郭胜伟, 等. 芥子碱对大鼠脑匀浆和血清中乙酰胆碱酯酶的抑制作用[J]. 中国中药杂志, 2008, 33(7): 813-815. |
| [65] | Chonpathompikunlert P, Wattanathorn J, Muchimapura S. Piperine, the main alkaloid of Thai black pepper, protects against neurodegeneration and cognitive impairment in animal model of cognitive deficit like condition of Alzheimer's disease[J]. Food Chem Toxicol, 2010, 48(3): 798-802. |
 2014, Vol. 45
2014, Vol. 45


