海藻与甘草配伍属中药“十八反”配伍禁忌范畴。作为中药配伍禁忌的代名词,“十八反”从金元时期沿用至今已有近千年的历史。传统中医认为反药同时应用会产生剧烈的毒副作用,因此限制了反药组合的临床应用,然而从诸多文献及临床实践看,持不同意见者亦不乏其人,海藻和甘草配伍屡见不鲜。纵观古代医籍,同用海藻、甘草的方剂达30余首之多,如孙思邈《备急千金要方》之“大补气方”,李东垣《兰室秘藏》之“散肿溃坚汤”,王肯堂《证治准绳》之“防风羌活汤”,陈实功《外科正宗》之“海藻玉壶汤”、“通气散坚丸”,就连政府组织编写的医籍中也有此类方剂,如《太平圣惠方》之“内消昆布散”,《圣济总录》之“茯苓汤”,《医宗金鉴》之“消核散”等。从现代临床应用角度看,亦有海藻、甘草配伍治疗内分泌科(甲状腺)、妇科、男科、皮肤科等多种疾病[1]。
以往对于反药组合的研究,多是考察了海藻和甘草在生理状态下,单独应用2味中药所产生的毒性[2]。然而,临床上“相反”药物配伍使用多于特定的病理条件下,且是在复方中应用的。因此,本课题组以明代《外科正宗》中经典方剂海藻玉壶汤为切入点,大鼠甲状腺肿大病理模型为载体,基于“973”项目组均匀设计要求,从方药结合的角度,探讨方中海藻与甘草反药药对不同配比对甲状腺肿大大鼠模型的生物学效应的影响。通过放射免疫方法测定血清中甲状腺激素水平、分子生物学手段考察海藻甘草不同比例配伍治疗甲状腺肿大的作用机制。本实验主要针对海藻玉壶汤的消瘿散结作用以及甲状腺肿大病理模型的特点,从甲状腺模型激素水平和分子生物学水平考察其药效并对其机制进行初步探讨。
1 材料 1.1 药品与试剂生甘草产自宁夏灵武,批号为100710;炙甘草产地、批号同生甘草,按照2010版《中国药典》炮制标准,由北京中医药大学中药学院炮制教研室杨蕾副教授指导完成,其中蜂蜜选用北京百花蜂蜜,批号为20100802,北京百花蜂蜜有限公司;海藻产自山东烟台,批号为皖Y20050202;法半夏产自贵州长顺,批号为100701;贝母产自浙江潘安,100701;连翘产自山西,批号为1104047;川芎产自四川,批号为1101017;独活产自四川,批号为1012001;昆布产自沿海,批号为1104062;醋青皮产自四川,批号为1102015;陈皮产自四川,批号为1104063;当归产自甘肃,批号为1012052;海带产自山东青岛;以上药物均购自北京双桥燕京中药饮片厂,经北京中医药大学基础医学院李伟实验员鉴定均为合格的中药饮片。由于法半夏、贝母、连翘、川芎、独活、昆布、醋青皮、陈皮、当归、海带这几味中药饮片在《中国药典》2010年版中的服用剂量范围不尽相同,因此本实验选取其剂量范围中共同的剂量9 g为入药剂量(成人70 kg/d),按动物体表系数算法得大鼠给药的等效剂量为0.9 g/(kg∙d)。海藻与甘草的剂量按实验设计设置不同的配比。各药材按比例组方,加水煎煮2次,配制成海藻玉壶汤,浓缩至所需浓度。
丙硫氧嘧啶片,广东华南药业集团有限公司,批号1007041,使用时配制为1 mg/mL溶液;阳性药为优甲乐,由默克雪兰诺有限公司提供,批号133117,使用时配制为2 μg/mL药液。
三碘甲腺原氨酸(T3),批号20111125;四碘甲腺原胺酸(T4),批号20111128;促甲状腺激素(TSH),批号20111124;血清游离三碘甲腺原氨酸(FT3),批号20111123;血清游离四碘甲腺原氨酸(FT4),批号20111127;促甲状腺激素释放激素(TRH),批号20111221;甲状腺素结合球蛋白(TBG),批号20111228;甲状旁腺素(PTH),批号20111225;以上试剂盒均由北京利德曼生化股份有限公司提供。
Trizol RNA提取试剂(Invitrogen公司),M-MLV逆转录酶、dNTP(10 mmol/L)、Tag酶(Promega公司),无RNA酶水(DEPC)原液、RNA酶抑制剂(Amresco公司),Loading 缓冲液(CWBIO公司),琼脂糖(Biowest agrose产品),Oligo(dT)(Amersham公司),超纯水(WelGENE公司),以上试剂由北京康为世纪生物科技有限公司提供。异丙醇(分析纯)、无水乙醇(分析纯)、氯仿(分析纯)、氯化钠溶液均由北京化学试剂公司提供。
1.2 动物清洁级Wistar大鼠120只,雌雄各半,体质量160~180 g,由北京维通利华实验动物技术有限公司提供,许可证号SCXK(京)2006-0009。
1.3 仪器R—911全自动放免计数仪(中国科技大学实业总公司),System electrophoresis Mupid(2plus)电泳槽(日本TAKARA公司),紫外分光光度计(美国Spectronic Unicam公司),漩涡混合器Voltex—Genie2(美国SI公司),高速冷冻离心机(德国Sigma公司),凝胶成像系统(美国Alpha Inn tech公司)。
2 方法 2.1 模型制备选取Wistar大鼠,体质量180~200 g,120只,雌雄各半,除对照组外,其余各组ig丙硫氧嘧啶10 mg/kg,每天1次,连续14 d。预试验结果表明造模大鼠甲状腺较对照组明显增大。在给药期间,为了稳定模型,每隔2 d 各造模动物组ig丙硫氧嘧啶10 mg/kg。
2.2 海藻、甘草配比剂量的选择根据急性毒性实验结果[3],生甘草小鼠LD50(19)为82.98 g/kg,海藻的LD50为35.67 g/kg。《中国药典》2010年版生甘草临床用量为1.5~10 g,海藻剂量为6~15 g,确定给药的剂量范围:高限为1/2 LD50,低限为药典剂量的低限。按动物体表系数算法得大鼠给药的等效剂量,海藻剂量0.54~12.49 g/kg,生甘草剂量0.135~29.040 g/kg。按照本课题组SOP均匀设计法,将海藻和生甘草视为2个因素,每个因素分为7水平,考察因素及水平和具体分组剂量见表 1。
| 表 1 U7(72) 不同配比及剂量分组 Table 1 U7(72) ratio of different dose groups. |
将大鼠按体质量随机分为对照组、模型组、阳性药组(优甲乐)、海藻、甘草不同配比的海藻玉壶汤1~7组,共计10组,每组12只。其中对照组与模型组ig给予生理盐水,其余各给药组ig给予相应药液,给药体积1 mL/100 g,各组于造模后连续给药28 d。每周称体质量1次,自由进食饮水。
2.4 分组样本采集与处理给药末次给药后1 h,10%水合氯醛麻醉,大鼠腹主动脉取血,雄性大鼠约8 mL,雌性大鼠约6 mL,4 ℃,3 000 r/min,离心15 min,留取上清,分装,−70 ℃冰箱保存,待检相关指标;腹主动脉取血后,迅速剥离气管,快速取双侧甲状腺,选取右侧甲状腺置于冻存管中,液氮冻存。
2.5 指标检测 2.5.1 血液指标检测取冻存血清,按T3、T4、TSH、FT3、FT4、TRH、TBG、PTH试剂盒说明书方法,检测各项指标。
2.5.2 RT-PCR法检测甲状腺组织甲状腺球蛋白(Tg)、甲状腺过氧化物酶(TPO)mRNA表达取甲状腺组织,样本总RNA的提取按说明书进行操作,采用紫外分光光度法对提取的RNA进行定量。每个样本中取总RNA 1 μL,按照逆转录试剂盒说明书进行操作将RNA逆转录成cDNA。按试剂盒说明,在超净台中,取3 μg总RNA样品为模板,Oligo(DT)2 μL作为引物,使用1 μL M-MLV逆转录酶,RNA酶抑制剂1 μL,dNTP 2 μL,5×逆转录酶缓冲液4 μL,配制反应体系为20 μL。PCR反应体系:10×缓冲液2 μL,Taq酶0.5 μL,dntp 1 μL,TPO(Tg)上、下游引物各0.5 μL,GAPDH上、下游引物各0.5 μL,cDNA样本2.0 μL,总反应体系为20 μL。PCR的循环条件:94 ℃预变性3 min,94 ℃、30 s,53 ℃、30 s,72 ℃、1 min,72 ℃中延伸8 min。TPO、Tg及GAPDH上下游引物序列及退火温度见表 2。
| 表 2 TPO、Tg及GAPDH上下游引物序列、片段长度及退火温度 Table 2 Primer sequences, segment sizes, andannealing temperature of TPO, Tg, and GAPDH. |
取PCR反应液5 μL进行琼脂糖凝胶电泳,进行0.8%琼脂糖凝胶电泳,取各个RNA样品5 μL,加入6×Lording 缓冲液1 μL,混匀,将所有液体加入凝胶加样孔中。以100 bp DNA Ladder marker作为参照,80 V电压下电泳25 min。应用BIO IMAGING SYSTEM(Gene Snap)照像,Gene Tools收集数据,以GAPDH作为内标,以目的基因/GAPDH的值为目的基因相对表达值。
2.6 统计分析采用SPSS 13软件包进行分析,数据均用x±s表示,组间比较采用单因素ANOVA(方差分析)进行显著性检验。
3 结果 3.1 对甲状腺肿大模型大鼠甲状腺激素水平的影响就甲状腺质量而言,模型组甲状腺系数较对照组显著增加(P<0.05),阳性药组及配比2、4、5、7组大鼠的甲状腺系数较模型组显著降低(P<0.05),表明配比2、4、5、7组与阳性药组具有明显恢复甲状腺肿大的作用。
与对照组相比,模型组大鼠血清激素水平T3、T4未出现降低反而有一定的升高,究其原因可能与模型复制方法有关。总体观察激素水平相关指标,海藻玉壶汤配比1、4组具有回调这种反跳引起的T3、T4水平增高的作用,并对大鼠血清中TSH水平的升高有一定的抑制作用,在某种程度上对丙硫氧嘧啶引起的血清中甲状腺激素水平失调具有一定的恢复作用。具体结果见表 3、4。
| 表 3 甘草海藻不同配比海藻玉壶汤对甲状腺肿大模型大鼠血清中T3、T4、FT3、FT4水平的影响 Table 3 Effectsof HYD with different compatibility of Sargassum and Glycyrrhizae Radix on levels of T3, T4, FT3, and FT4 in serum of goiter rats. |
| 表 4 甘草海藻不同配比海藻玉壶汤对甲状腺肿大模型大鼠血清中TSH、TRH、TBG、PTH水平的影响 Table 4 Effectsof HYD with different compatibility of Sargassum and Glycyrrhizae Radix on levels of TSH, TRH, TBG, and PTH in serum of goiter rats. |
实验结果表明,配比1、5组TPO mRNA的表达较对照组显著上升,具有统计学意义(P<0.05),其他各个给药组都有升高的趋势,但无显著性差异;与模型组比较,配比5组TPO mRNA的表达显著升高(P<0.05)。配比1、5、6组的Tg mRNA水平较对照组显著升高(P<0.05),其余给药各组都有升高的趋势,但无显著性差异;与模型组比较,除阳性药组Tg mRNA水平较模型组有降低趋势外,其余各组较模型组Tg mRNA的表达无显著性差异,结果见表 5。电泳结果见图 1、2。
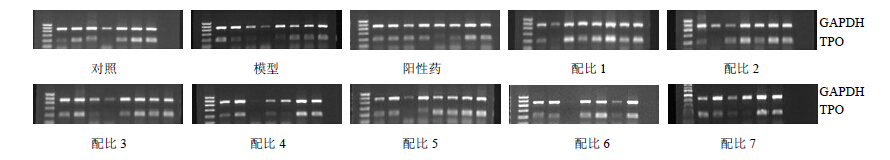 | 图 1 各组大鼠甲状腺组织 TPO mRNA 表达电泳结果Fig. 1 Electrophoresis results of TPO mRNA expression of thyroid tissue of rats in each group |
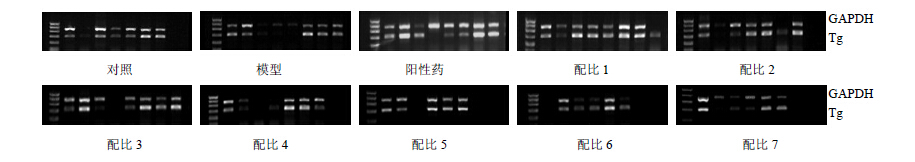 | 图 2 各组大鼠甲状腺组织 Tg mRNA 表达电泳结果Fig. 2 Electrophoresis results of Tg mRNA expression of thyroid tissue of rats in each group |
| 表 5 甘草与海藻不同配比海藻玉壶汤对甲状腺肿大模型大鼠甲状腺组织TPO和Tg mRNA表达的影响 Table 5 Effectsof HYD with different compatibility of Sargassum and Glycyrrhizae Radix on subtype mRNA expression of TPO and Tg. |
丙硫氧嘧啶导致的甲状腺功能减退,其主要表现为甲状腺激素合成、分泌或生物效应不足等方面。碘是机体必要的微量元素,是甲状腺合成甲状腺素的基本物质基础[4]。当机体对碘的合成功能减退时,机体即会出现以碘摄入不足为表现的甲状腺激素合成不足的病理表现。
甲状腺功能减退动物模型复制是以T3、T4显著降低,TSH显著升高为成功标志[5]。而本实验中出现的现象为TSH显著升高,但T3水平亦显著升高,究其原因可能与造模方式有关。本实验采取造模2周后,在给药28 d期间,每隔2 d ig给予丙硫氧嘧啶稳定模型,可能是由于没有连续给药的原因,或给药间隔时间稍长等原因使T3、T4代偿性增高,需在后续实验中改进造模方法后再对实验结果加以验证。
亚临床甲状腺功能减退症简称亚临床甲减,又称轻度甲状腺功能衰竭(mildthyridfailure,MTF),其表现是以TSH水平升高和血清T4水平正常为特征的甲状腺疾病。垂体分泌TSH受2方面的影响,其一为下丘脑分泌的促甲状腺激素释放激素(TRH)的促进性影响,其二受到T3、T4反馈性的抑制性影响,二者互相拮抗,它们组成下丘脑-腺垂体-甲状腺轴。正常情况下,机体下丘脑分泌的TRH量与腺垂体甲状腺轴的反馈调节密切相关。TRH分泌增多,则血中T3、T4水平较高,当血中T3、T4超过一定水平后就会反馈性地抑制腺垂体分泌TSH,从而降低垂体对TRH的敏感性,保持血中T3、T4水平相对恒定。
本实验中模型组及给药组大鼠血清中TRH的量均较对照组升高,其进而促进垂体分泌相应的TSH,从数值上看TRH的升高与TSH的升高幅度基本平行,但TSH的升高未受到T3的反馈性抑制,其原因可能与反馈机制尚未启动,大鼠血清中TSH水平下降较慢,从而使T3处于较高的水平。此外还有文献表明,碘缺乏时,甲状腺内甲状腺激素合成前体一碘酪氨酸(MIT)、二碘酪氨酸(DIT)合成明显减少,同时甲状腺I型脱碘酶(Dl)mRNA表达有所增高,活性增强,其作用为促进T4转变为T3,因此甲状腺组织内T3、T4水平均明显下降。在机体碘供应不足的条件下优先合成T3以满足大多数组织代谢的需要,避免周围组织甲减的发生。此为一种经济有效的代偿机制。在碘缺乏早期,T3及FT3会呈代偿性增高,但长期处于碘缺乏状态则使机体失去代偿能力,机体会呈现出明显甲减症状[6]。推测在实验期间,由于间断性ig丙硫氧嘧啶,造成碘缺乏症早期症状,进而出现T3与TSH同时升高的现象。后续实验过程中将考虑在给药期间连续补充丙硫氧嘧啶以稳定模型的方法进行实验。
甲状腺滤泡细胞的功能在于合成对人体代谢极为重要的甲状腺激素。该过程需要碘、Tg、TPO、H2O2等4种重要成分并依赖TSH-cAMP系统的调节。由此可见,Tg和TPO是甲状腺激素合成过程中2个至关重要的因素。TPO在碘氧化、铬氨酸碘化以及碘化铬氨酸偶联至甲状腺球蛋白上等甲状腺激素合成过程中起重要的催化作用。对于丙硫氧嘧啶引起甲状腺激素水平的下降,国内外学者通常认为与其抑制TPO的活性有关[7, 8],也有学者认为其过程还涉及到丙硫氧嘧啶对Tg合成的抑制,与丙硫氧嘧啶造成甲状腺滤泡细胞粗面内质网损伤有关[9, 10]。丙硫氧嘧啶引起的甲减导致TSH反馈性升高,又可通过信号转导途径促进TPO、Tg等基因的转录而具有代偿意义[11]。
本研究结果表明,模型组及给药各组的TPO mRNA均高于对照组,且配比1、5组显著高于对照组(P<0.05)。由此可见,丙硫氧嘧啶对TPO的抑制不是发生在转录阶段。相反,TPO在转录水平的表达增高,对于丙硫氧嘧啶导致的甲减具有一定的代偿意义。如果这一代偿机制足够充分的话,血清甲状腺激素水平将会趋于正常[12]。结合血清甲状腺激素结果可以看到,血清中T3、T4的量较对照组升高,但血清中TSH的量并未有所降低,依然位于高位。上述研究提示,本实验中丙硫氧嘧啶所致的TPO转录增强,可能与TSH的反馈性升高有关,TPO转录增强所起到的代偿作用并不充分。海藻玉壶汤配比1、5组使这种代偿作用增强,提示激素合成功能增强,这是甲状腺对缺碘的代偿性适应,这种代偿作用与海藻玉壶汤中海藻和甘草的比例暂无明显的线性关系。有文献表明,TSH的升高,可以刺激Tg的转录,从本实验结果来看,与文献报道基本一致,Tg的转录水平未受到丙硫氧嘧啶的抑制,配比1、5、6组具有促进Tg转录的作用,在某种程度上具有恢复甲状腺激素达到正常水平的作用。
综上所述,通过丙硫氧嘧啶致甲状腺肿大动物模型研究,除了通常认为的抑制TPO的活性,还可能涉及Tg在转录和翻译水平的抑制。TSH水平增高对TPO基因的转录刺激作用不能起到充分的代偿作用,海藻玉壶汤的配比1、5组具有促进这种代偿增强的作用,在某种程度上对甲状腺激素水平的恢复起到积极的作用,但还需结合甲状腺激素合成相关基因,如钠碘转运体(NIS)、Dl表达的变化进行了深入分析。此外,实验结果并未显示出由于海藻、甘草配伍比例的改变使相关基因TPO、Tg mRNA表达发生改变的线性关系。有文献表明,非富碘中药复方对于大鼠甲状腺功能与形态的改变亦有一定疗效,这就说明富碘中药复方不单纯靠含碘的成分发挥作用,在复方中,各药物之间亦有相互作用,既有协同作用,也有拮抗作用[13]。因此,在今后的实验研究中,可以考虑去除相应的富碘中药,进行海藻玉壶汤的拆方研究,以期为阐明海藻玉壶汤对甲减大鼠甲状腺功能恢复的调控机制提供实验依据。
| [1] | 李怡文, 钟赣生, 王茜, 等. 含反药配伍的海藻玉壶汤临床应用分析[J]. 南京中医药大学学报, 2011, 27(4): 317-321. |
| [2] | 丁选胜, 李欧, 阚毓铭. 海藻、甘草及其不同比例配伍后的水提取物的肝毒性研究-对离体大鼠肝灌流液中AST、ALT的影响[J]. 南京中医药大学学报, 2003, 19(1): 28-31. |
| [3] | 李怡文, 钟赣生, 柳海艳, 等. 海藻、甘草配伍组合及其复方海藻玉壶汤的急性毒性实验比较研究[J]. 科技导报, 2012(34): 18-23. |
| [4] | 郭若霖, 左爱军, 赵学勤, 等. 缺碘对发育期大鼠甲状腺激素水平的影响[J]. 中国地方病学杂志, 2003, 22(3): 280-281. |
| [5] | Baksi S N. Effect of propylthiouracil-induced hypothyroidism on serum levels of luteinizing hormone and follicle-stimulating hormone in the rat[J]. J Endocriol, 1973, 59: 655-656. |
| [6] | 陈祖培, 阎玉芹, 项建梅, 等. 碘缺乏和碘过量大鼠动物模型的复制及其碘代谢的对比观察[J]. 中国地方病学杂志, 2005, 24(3): 242-244. |
| [7] | Degroot L J, Niepomniszcze H. Biosynthesis of thyroid hormone: basic and clinical aspects[J]. Metabolism, 1977, 26(6): 665-718. |
| [8] | Vickers A E, Heale J, Sinclair J R, et al. Thyroid organotypic rat and human cultures used to investigate drug effects on thyroid function, hormone synthesis and release pathways[J]. Toxicol Appl Pharmacol, 2012, 260(1): 81-88. |
| [9] | 孙丁, 王津涛, 潘红梅, 等. 甲状腺素干扰物对甲状腺滤泡细胞分泌甲状腺球蛋白的影响[J]. 环境与健康杂志, 2003, 20(4): 210-212. |
| [10] | 商维维, 罗建, 程薇波, 等. PTU对大鼠甲状腺TPO、Tg mRNA表达的影响[J]. 四川大学学报: 医学版, 2010 , 41(3): 428-431. |
| [11] | Braverman L E, Ut iger R D. Werner and Ingbar's the thyroid. A Fundamental and Clinical Text[M]. The 8th ed. Philadelphia: Lippincott Williams and Wilkins, 2000. |
| [12] | McClain R M. Mechanistic consideration for the relevance of animal data on thyroid neoplasia to human risk assessment[J]. Mutat Res, 1995, 333(1): 131-148. |
| [13] | 时杨, 高天舒, 杨柳. 富碘中药复方对甲亢大鼠甲状腺功能和形态的影响[J]. 辽宁中医药大学学报, 2009, 11(9): 186-188. |
 2014, Vol. 45
2014, Vol. 45


