西松烷型二萜(cembranoid type diterpenes)是由4个异戊二烯单元首尾相连形成的大环二萜,是一类母体骨架具有十四元环和3个对称分布的甲基与1个异丙基的天然产物[1]。西松烷型二萜最先于1951年发现自松属植物和烟草中,随后从海洋生物中发现了大量该类化合物。该类化合物结构中大都有氧(羟基、羰基、酰氧基、环氧、过氧桥)取代,分离得到的大多数化合物都具有较好的细胞毒和抗肿瘤活性[2]。
目前分离得到的西松烷二萜在结构上可分为异丙基型,五元、六元、七元、八元内酯环型,开环型,降碳型等类型。本文综述了2007年以来发现的193个新的西松烷类化合物,为进一步研究开发该类化合物提供依据。
1 异丙基型西松烷型二萜异丙基型西松烷型二萜是最典型的西松烷型化合物,主要特点是在分子结构中有异丙基或者异丙烯基取代。从京大戟Euphorbia pekinensis Rupr. 中首次发现1个新的西松烷型二萜成分 (−)-(1S)-15- hydroxy-18-carboxycembrene(1),体外细胞毒实验表明,该化合物对乳腺癌、前列腺癌等5种肿瘤细胞均具有一定的抑制作用[3]。从海洋肉叶型软珊瑚Lobophytum sarcophytoides Moser中跟踪分离得到1个新的异丙(烯)基型西松烷型二萜 (1E, 3E, 7R, 8R, 11E)-1-(2-methoxy-propan-2-yl)-4, 8, 12-trimethyl- oxabicyclo [12.1.0]-pentadeca-1, 3, 11-triene(2),遗憾的是,这个化合物并没有显示出细胞毒以及缺氧诱导因子(HIF-2α)抑制活性< sup>[4]。从中国软珊瑚Sinularia rigida Dana中得到了19个19位氧取代的西松烷型二萜sinulariol A~S(3~21),这些化合物的抗菌以及细胞毒实验显示均没有显著的活性,但是抗污实验表明,化合物12能够显著地抑制纵条纹藤壶Balanus Amphitrite Darwin的幼虫聚集,化合物19对草苔虫Bugula neritina Linnaeus的黏附具有中等的抑制作用,这些结果说明分离得到的化合物可能参与抗污过程[5]。Decaryiol B~D(22~24)从印度豆荚软珊瑚Lobophytum sp. 中分离得到,这3个化
合物的结构特点是C-15位与C-4位形成了1个六元氧环[6]。从地钱Chandonanthus hirtellus Mitt.中分离得到2个新的西松烷型二萜8, 10-di-epi- chandonanthone(25)、β-1, 15-dihydro-8, 10-di-epi- chandonanthone(26),通过X-ray单晶衍射确定了它们的绝对构型[7]。Flexilarin B~C(27~28)是从台湾软珊瑚Sinularia flexibillis Quoy & Gaimard中分离得到的[8]。从冠指软珊瑚Sinularia pavida Tixier-Durivault中分离得到5个新的西松烷型二萜pavidolide A~E(29~33),其中化合物30具有一个罕见的6, 5, 7-三碳环母核,而化合物31的5位碳原子和9位碳原子成环,这也是不常见的。在活性试验测试中,化合物31和32显示出中等的抗污活性,化合物30和31具有抑制人白血病细胞HL-60的活性[9]。Sarcophytonoli de N~Q(34~37)、(1E, 6E, 9E, 11E)-5-hydroxy-12-isopropyl-5, 9-dimethylcyclo- tetradeca-1, 6, 9, 11-tetraenecarboxylic acid(38)、methyl 2-[(R, 3E, 7E, 11E)-4, 8, 12-trimethylcyclo- tetradeca-3, 7, 11-trien-1-yl] acrylate(39)、(R, 1Z, 3Z, 7E, 11E)-5-acetoxy-4-isopropyl-7, 11-dimethylcyclo- tetradeca-1, 3, 7, 11-tetraen-1-yl] methylacetate(40)、11, 12-epoxy-sarcophytoxide(41)、diepoxycembrene A(42)分别是从中国南海花环肉质软珊瑚Sarcophyton trocheliophorum Marenzeller、Croton longissimus Airy Shaw的叶、冲绳厚叶软珊瑚Lobophytum crissum von Marenzeller、中国南海豆荚软珊瑚属Lobophytum sp.、海南短指软珊瑚Sinularia sp. 中得到的。其中化合物34对人蛋白酪氨酸磷酸酶酶1B(PTP1B)具有显著的抑制活性,IC50为5.95 μmo/L[10, 11, 12, 13, 14]。< /span>3, 4-Epoxy-nephthenol acetate(43)、lobophytone T(44)、triangulene A~B(45、46)、lobocrassin C~F(47~50)分别是从印尼柔荑软珊瑚(Nephthea sp.)、中国简叶型软珊瑚Lobophytum pauciflorum Ehrenberg、台湾软珊瑚Sinularia triangular Tixier-Durivault、冲绳厚叶软珊瑚中分离得到的。其中化合物44能够显著抑制金黄色葡萄球菌、肺炎链球菌、酵母菌的生长,化合物50是首次从豆荚软珊瑚属中发现的C-4和C-14位以醚键相连的吡喃环西松烷型二萜[15, 16, 17, 18, 19]。
Sinuflexibilin A、C(51、52),flexibilin A、B(53、54),sarcophyolide B~D(55~57),arbolide A、B(58、59),6-acetoxy-7, 8-epoxynephthenol acetate(60)分别从海南短指软珊瑚Sinularia sp.、台湾软珊瑚、皮革珊瑚Sarcophyton elegans Moser、Sinularia arborea Verseveldt和婆罗洲软珊瑚Nephthea sp. 中分离得到,在体外抗炎实验中,化合物54显示出了中等抑制作用。通过Mosher方法和X-ray单晶衍射确定了化合物55和56的绝对构型;在体外抗肿瘤实验中,化合物56能够显著抑制A2780细胞增殖,其IC50为2.92 μmol/L[20, 21, 22, 23, 24]。Sicrassarine A、B(61、62),sinulaflexiolide E~I(63~67),flexusine A、B(68、69),epimukulol(70),chandonanone A~F(71~76),leptodienone A、B(77、78)分别从Sinularia crassa Tixier-Durivault、台湾软珊瑚、Sarcophyton flexuosum Tixier-Durivault、齿边广萼苔Chandonanthus hirtellus Mitt.、细广萼苔Chandonanthus birmensis Steph、Leptogorgia laxa Hickson中分离得到,在体外的细胞毒实验中,化合物63、64能够选择性抑制BGC-823细胞增殖,IC50分别为8.5和0.12 μmol/L,化合物77能够抑制MDA-MB-231和HT-29细胞的生长,其GI50为16.2和14.9 μmol/L,而化合物78除了能够显著抑制这2种细胞外,还能够抑制A-549细胞的生长(GI50分别为6.3、5.6和10.9 μmol/L)。另外,还通过X-ray单晶衍射测定了化合物71和72的绝对构型[25, 26, 27, 28, 29]。化合物13-hydroxy-sinularial A(79)、16-hydroxy- sinulariol C(80)、diepoxysacophytonene(81)、sarconphytonol(82)、sinuladiterpene I(83)、(3E, 7E, 11E, 15E)-1-hydroxycembra-3, 7, 11, 15-tetraene(84)、(1R, 12R, 3E, 7E, 10E, 11E)-12-hydroxyl- cembra-3, 7, 10, 15-tetraene(85)、(3E, 11E)-cembra-3, 8(19), 11, 15-tetraene-7α-ol(86)、13, 18, 20-epi- isochandonanthone(87)、(8E)-4α-acetoxy-12α, 13α- epoxy-cembra-1 (15), 8-diene(88)分别从豆荚软珊瑚属、肉芝软珊瑚Sarcophyton latum Dana、台湾软珊瑚、简易指型软珊瑚Sinularia facile Tixier- Durivault、软珊瑚Litophyton arboretum Forskal以及塔希提岛齿边广萼苔Chandonanthus hirtellus Mitt. 中分离得到。在这些化合物中,化合物87具有弱的HL-60细胞毒活性,IC50为18.1 μg/mL[30, 31, 32, 33, 34, 35]。异丙基型西松烷型二萜结构见图 1。
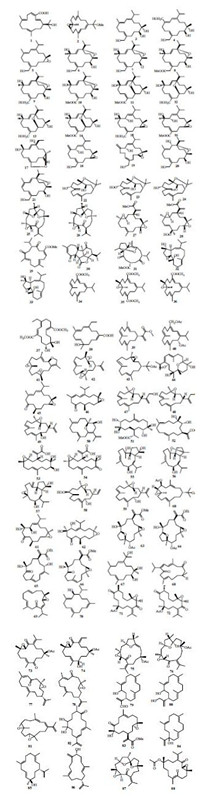 | 图 1 异丙基型西松烷型二萜结构Fig. 1 Structures of isopropyl type cembranoid diterpenes |
五元内酯环型西松烷型二萜是西松烷型二萜中数量较多的一类成分,该类成分大多具有细胞毒性和抗肿瘤活性,分子中的五元内酯环是其重要的活性中心[2]。五元内酯环型西松烷型二萜结构见图 2。
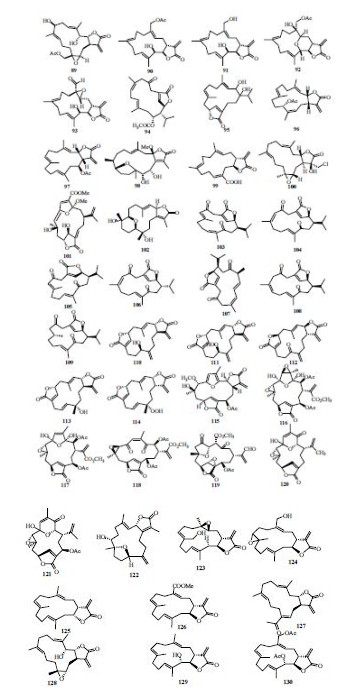 | 图 2 五元内酯环型西松烷型二萜结构Fig. 2 Structures of five membered lactone ring cembranoid type diterpenes |
从软珊瑚Lobophytum durum Tixier-Durivault中分离得到5个五元内酯环型西松烷型二萜化合物89~93(durumolide A~E),其中采用Mosher法确定了91的绝对构型,在抗菌实验中,化合物89~91、93显示出了强的抑制肠炎沙门氏菌的活性,其抑制率甚至超过了阳性药氨苄西林,在体外抗炎实验中,化合物89和91在浓度为10 μmol/L时能够明显减少诱导型NO合酶(iNOS)蛋白和环氧合酶- 2(COX-2)蛋白表达,而化合物90和93只能够抑制iNOS蛋白的表达[36]。Sarcophytonolide R(94)、(6E, 10E, 13R)-4, 5-dihydroxy-4-isopropyl-7, 11-dimethyl- 14-oxabicyclo [11. 2. 1] hexadeca-1 (16), 6, 10-trien- 15-one(95)、3aS, 5Z, 7S, 10E, 14E, 15aS)-6, 10, 14-trimethyl-3-methylene-2-oxo-2, 3, 3a, 4, 7, 8, 9, 12, 13, 15a-decahydrocyclotetradeca [b] furan-7-yl acetate(96)、(3aR, 4S, 6E, 10E, 14E, 15aS)-6, 10, 14-trimethyl-3-methylene-2-oxo-2, 3, 3a, 4, 5, 8, 9, 12, 13, 15a-decahydrocyclotetradeca [b] furan-4-yl acetate(97)、briaviodiol A(98)、crassumolide E(99)分别来源 于花环肉质软珊瑚Sarcophyton trochelio- phorum Marenzeller、Croton longissimus Airy Shaw、厚叶软珊瑚、Briareum violacea Roule、豆荚软珊瑚Lobophytum sp.。其中,通过Mosher法和CD确定了化合物96和97的绝对构型,在体外抗炎实验中,这两个化合物能够显著抑制NO的生成,它们的IC50值都不超过10 μmol/L。此外,化合物99具有抑制乙酰胆碱酯酶的活性[10, 11, 12, 37, 38]。
Lobocrassin A(100)、sinuflexibilin E(101)、sarcophyolide E(102)分别从厚叶软珊瑚、短指软珊瑚Sinularia sp.、皮革珊瑚Sarcophyton elegans Moser中分离得到,并且通过CD确定了化合物102的绝对构型[18, 20, 22]。从Sarcophyton stolidotum Verseveldt中分离得到7个该类化合物sarcostolide A~G(103~109),在体外的细胞毒实验中,化合物106~108具有非常弱的HeLa和WiDr细胞毒活性,化合物107具有中等强度的Daoy细胞毒活性,其ED50为5.5 μg/mL[39]。从鱼针草Anisomeles indica (L.) Kuntze中分离得到5个五元内酯环型西松烷
型大环二萜4(18)-methylene-5β-hydroxyovatodiolide、4(18)-methylene-5β-hydroperoxyovatodiolide、4(18)- methylene-5-oxovatodiolide、4α-hydroxy-5-en-ovato- diolide、4-hydroperoxy-5-enovatodiolide(110~114),并采用Mosher法确定了110的绝对构型[40]。Bipinnatin K~Q(115~121)是从Pseudopterogorgia kallos Bielschowsky中分离得到的,在这些化合物中,只有化合物119具有抑制CCRF-CEM、MOLT-4、RPMI-8226和SR细胞的活性[41]。Trocheliol(122)、19-hydroxysarcocrassolide(123)、18-deacetyldeepoxy lobolide(124)、lobophytolide A~F(125~130)分别从圆盘肉芝软珊瑚Sarcophyton trocheliophorum Marenzeller、豆荚软珊瑚Lobophytum sp. 中分离得到[30, 42, 43]。
3 六元内酯环型西松烷型二萜六元内酯环西松烷型二萜的数量较少,2007年以来,仅发现6个该类化合物。这6个化合物分别为来自于台湾软珊瑚的flexilarin A(131)、11- acetylsinuflexolide(132)、11-acetyldihydrosinu- flexolide(133)、flexibilin D(136),厚叶软珊瑚的lobocrassin B(134),Sinularia sp. 的sinuflexibilin D(135)[8, 18, 20, 44, 45]。在这6个化合物中,采用X-ray单晶衍射确定了化合物131的相对构型,化合物134对K562、CCRF-CEM、Molt4以及HepG2细胞具有一定的抑制活性。在体外抗炎实验中,化合物136能够有效降低iNOS和COX-2的表达水平,但是没有显示出细胞毒活性,这说明该化合物可能成为一个有效的抗炎剂。六元内酯环西松烷型二萜结构见图 3。
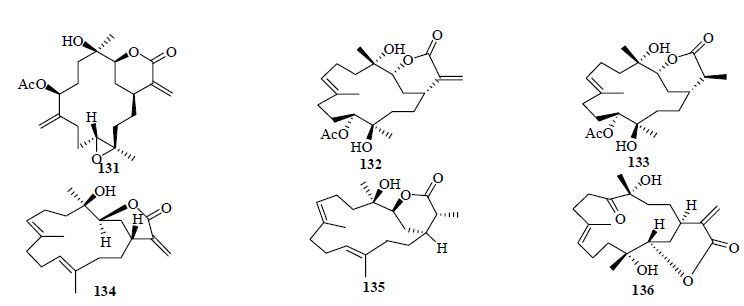 | 图 3 六元内酯环型西松烷型二萜结构Fig. 3 Structures of six membered lactone ring cembranoid type diterpenes |
从肉芝软珊瑚Sarcophyton sp.、花环肉质软珊瑚Sarcophyton trocheliophorum Marenzeller中分离得到了七元内酯环型西松烷型二萜 (4Z, 8S, 9R, 12E, 14E)-9-hydroxy-1-(prop-1-en-2-yl)-8, 12- dimethyl-oxabicyclo [9. 3. 2]-hexadeca-4, 12, 14-trien-18-one(137)、sartrolide A~G(138~144)[4, 46]。Flexilarin D~J(145~151)是从台湾软珊瑚中得到的,在细胞毒实验中,化合物145显示出了强的抗Hep2细胞活性,ED50为0.07 μg/mL,与阳性对照药丝裂霉素相当,同时该化合物还对HeLa、Daoy和MCF-7具有中等强度的抑制活性[8]。从Sinularia sp.和台湾软珊瑚中获得了sinuflexibilin B(152),flexibilin C(153),sinulaflexiolide B~D(154~156)、J~K(157~158)[20, 21, 26]。Querciformolide A~D(159~162)是从Sinularia querciformis Pratt中分离得到的[47]。这些化合物中,159是发现的第1个C-4,8位醚键相连的具有四氢呋喃结构的ε-内酯西松烷类化合物,化合物161~162也是罕见的以C-4,7位醚键相连的具有四氢呋喃结构的西松烷类化合物,通过Mosher法确定了159和160的绝对构型。Sinulaparvalide A、B(163、164),sinuladiterpene G、H(165、166),sinuladiterpene A~F(167~172)分别从海南软珊瑚Sinularia parva Tixier-Durivault、台湾软珊瑚中得到[32, 48, 49]。通过X-ray单晶衍射确定了化合物163、164的相对构型,体外细胞毒实验显示168能够抑制WiDr细胞的生长,ED50为8.37 μg/mL。七元内酯环型西松烷型二萜结构见图 4。
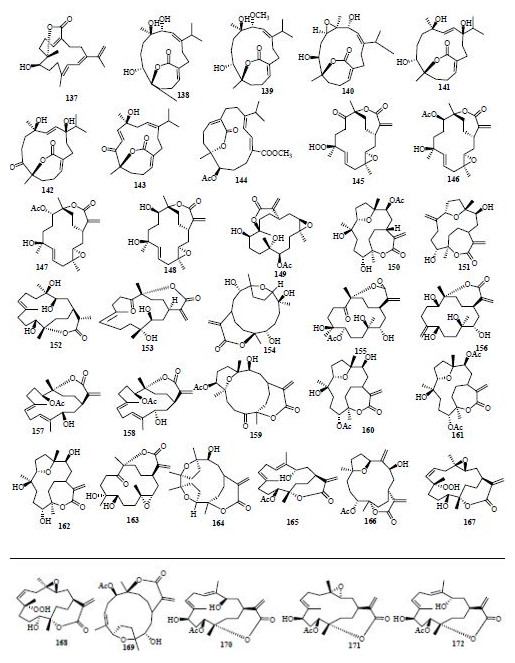 | 图 4 七元内酯环型西松烷型二萜结构Fig. 4 Structures of seven membered lactone ring cembranoid type diterpenes |
二聚西松烷型二萜数量较少,2007年至今总共得到14个,它们分别为来自于简叶形软珊瑚Lobophytum pauciflorum Ehrenberg的lobophytone O~S(173~177),台湾软珊瑚的sinulaflexiolide A(178),Sarcophyton glaucum Quoy & Gaimard的bisglaucumlide E~K(179~185),花环肉质软珊瑚Sarcophyton trocheliophorum Marenzeller的bissartrolide A(186)[16, 26, 46, 50]。化合物175能够显著的抑制老鼠腹膜巨噬细胞中LPS诱导的NO的生成,IC50为2.8 μmol/L。另外,在抗菌实验显示它还具有抗葡萄球菌、肺炎链球菌、酵母菌的活性。化合物179~183、185具有弱的抑制HL-60的活性。二聚西松烷型二萜结构见图 5。
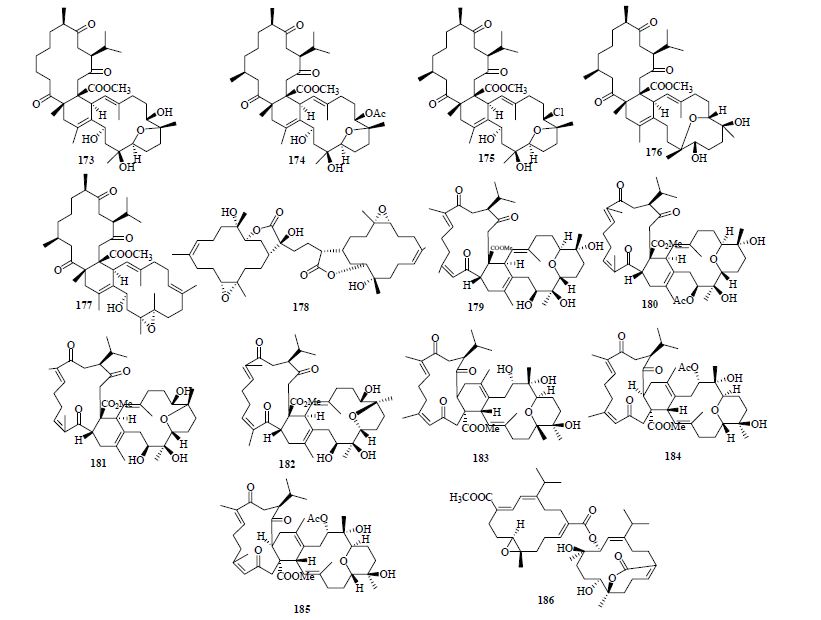 | 图 5 二聚西松烷型二萜结构Fig. 5 Structures of dimer cembranoid type diterpenes |
还有一些其他类型的西松烷型二萜被发现,从中亚紫菀木Asterothamnus centrali-asiaticus Novopokr中得到的西松烷苷nephthenol 15-O-β-D-quinovoside(187),到目前为止,这个化合物是首次从植物中发现的西松烷苷类化合物[51]。1-epi-Sinulanorcembranolide A(188)是从Sinularia gaweli Verseveldt中分离得到的降碳西松烷型二萜。该化合物是目前为止发现的第2个以C5/C13和C7/C12相连的降西松烷二萜[45]。7E-Polymaxenolide(189)、7E-5-epipolymaxenolide(190)、polymaxenolide A~C(191~193)是从Sinularia maxima Verseveldt×S. polydactyla Ehrenberg中得到的,并且通过计算ECD和X-ray单晶衍射确定了它们的绝对构型[52]。结构见图 6。
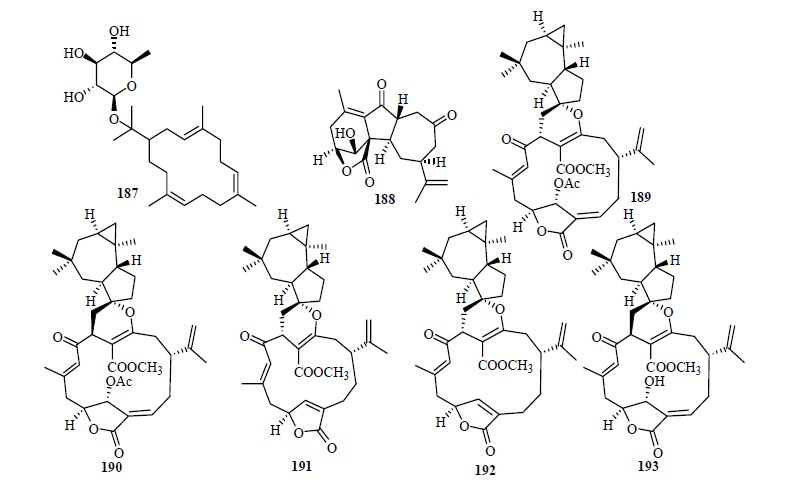 | 图 6 其他类型西松烷型二萜结构Fig. 6 Structures of other cembranoid type diterpenes |
自2007年以来共得到193个新的西松烷型二萜类化合物,其中包括异丙基型类88个,五元内酯环类42个,六元内酯环类6个,七元内酯环类36个,二聚以及其他类型21个。这些化合物主要来源于海洋生物中,且多数具有细胞毒、抗炎、抗菌等活性。由于这类成分的结构新颖,引起了合成化学家们极大的兴趣,目前,已经有众多的关于此类化合物全合成以及结构修饰的报道,有多篇关于这方面的综述,1994年李裕林等[53]综述了西松烷型二萜天然产物的全合成,2003年石燕等[54]综述了西松烷型二萜内酯的全合成[53, 54]。这类化合物结构复杂多变,生物活性不尽相同,相信对这类化合物的研究,特别是从陆生植物中发现此类化合物,仍将成为以后研究的热点。
| [1] | 孙汉董, 黎胜红. 二萜化学 [M]. 北京: 化学工业出版社, 2011. |
| [2] | 李国强, 张艳玲, 林文翰. 西松烷二萜类海洋活性成分研究进展 [J]. 中国海洋大学学报, 2006, 36(3): 370-376. |
| [3] | Hou P, Zeng Y, Ma B, et al. A new cytotoxic cembrane diterpene from the roots of Euphorbia pekinensis Rupr [J]. Fitoterapia, 2013, 90: 10-13. |
| [4] | Grkovic T, Whitson E L, Rabe D C, et al. Identification and evaluation of soft coral diterpenes as inhibitors of HIF-2α induced gene expression [J]. Bioorg Med Chem Lett, 2011, 21: 2113-2115. |
| [5] | Lai D, Li Y, Xu M, et al. Sinulariols A-S, 19-oxygenated cembranoids from the Chinese soft coral Sinularia rigida [J]. Tetrahedron, 2011, 67: 6018-6029. |
| [6] | Fattorusso E, Romano A, Taglialatela-Scafati O, et al. Oxygenated cembranoids of the decaryiol type from the Indonesian soft coral Lobophytum sp. [J]. Tetrahedron, 2009, 65: 2898-2904. |
| [7] | Wang Y, Harrison L J, Tan B C. Terpenoid from the liverwort Chandonanthus hirtellus [J]. Tetrahedron, 2009, 65: 4035-4043. |
| [8] | Lin Y S, Chen C H, Liaw C C, et al. Cembrane diterpenoids from the Taiwanese soft coral Sinularia flexibillis [J]. Tetrahedron, 2009, 65: 9157-9164. |
| [9] | Shen S, Zhu H, Chen D, et al. Pavidolides A-E, new cembranoids from the soft coral Sinularia pavida [J]. Tetrahedron Lett, 2012, 53: 5759-5762. |
| [10] | Liang L F, Gao L X, Li J, et al. Cembrane diterpenoids from the soft coral Sarcophyton trocheliophorum Marenzeller as a new class of PTP1B inhibitors [J]. Bioorg Med Chem, 2013, 21: 5076-5080. |
| [11] | Kawakami S, Matsunami K, Otsuka H, et al. Two new cembranoids from the leaves of Croton longissimus Airy Shaw [J]. J Nat Med, 2013, 67: 410-414. |
| [12] | Wanzola M, Furuta T, Kohno Y, et al. Four new cembrane diterpenes isolated from an Okinawan soft coral Lobophytum crassum with inhibitory effects on nitric oxide production [J]. Chem Pharm Bull, 2010, 58(9): 1203-1209. |
| [13] | Chen S H, Huang H, Guo Y W. A new diterpenoid from the south China sea soft coral Lobophytum sp. [J]. J Asian Nat Prod Res, 2008, 10(10): 965-969. |
| [14] | Qin S, Huang H, Guo Y W. A new diterpenoid from the Hainan soft coral Sinularia sp. [J]. J Asian Nat Prod Res, 2008, 10(11): 1075-1079. |
| [15] | Januar H I, Chasanah E, Motti C A, et al. Cytotoxic cembranes from Indonesian specimens of the soft coral Nephthea sp. [J]. Mar Drugs, 2010, 8: 2142-2152. |
| [16] | Yan P, Deng Z, Ofwegen L V, et al. Lobophytones O-T, new biscembranoids and cembranoid from soft coral Lobophytum pauciflorum [J]. Mar Drugs, 2010, 8: 2837-2848. |
| [17] | Su J H, Wen Z H. Bioactive cembrane-bases diterpenoids from the soft coral Sinularia triangular [J]. Mar Drugs, 2011, 9: 944-951. |
| [18] | Kao C Y, Su J H, Lu M C, et al. Lobocrassins A-E: new cembrane-type diterpenoids from the soft coral Lobophytum crassum [J]. Mar Drugs, 2011, 9: 1319-1331. |
| [19] | Lee C H, Kao C Y, Kao S Y, et al. Terpenoids from the octocorals Menella sp. (Plexauridae) and Lobophytum crassum (Alcyonacea) [J]. Mar Drugs, 2012, 10: 427-438. |
| [20] | Yang B, Zhou X, Huang H, et al. New cembrane diterprnoids from a Hainan soft coral Sinularia sp. [J]. Mar Drugs, 2012, 10: 2023-2032. |
| [21] | Hu L C, Su J H, Chiang M Y N, et al. Flexibilins A—C, new cembrane-type diterprnoids from the Formosan soft coral Sinularia flexibillis [J]. Mar Drugs, 2013, 11: 1999-2012. |
| [22] | Xi Z, Bie W, Chen W, et al. Sarcophyolides B—E, new cembranoids from the soft coral Sarcophyton elegans [J]. Mar Drugs, 2013, 11: 3186-3196. |
| [23] | Chen K H, Dai C F, Lu M C, et al. Secondary metabolites from the soft coral Sinularia arborea [J]. Mar Drugs, 2013, 11: 3372-3380. |
| [24] | Ishii T, Zhaoqi Z, Vairappan C S. A new cembrane diterpene from the Bornean soft coral Nephthea sp. [J]. Molecules, 2010, 15: 3857-3862. |
| [25] | Lin Y S, Lee N L, Lu M C, et al. Two new cembrane-based diterpenoids from the Marine soft coral Sinularia crassa [J]. Molecules, 2012, 17: 5422-5429. |
| [26] | Wen T, Ding Y, Deng Z, et al. Sinulaflexiolides A—K, cembrane-type diterpenoids from the Chinese soft coral Sinularia flexibillis [J]. J Nat Prod, 2008, 71: 1133-1140. |
| [27] | Bensemhoun J, Rudi A, Bombarda I, et al. Flexusines A and B and Epimukulol from the soft coral Sarcophyton flexuosum [J]. J Nat Prod, 2008, 71: 1262-1264. |
| [28] | Li R J, Lin Z M, Kang Y Q, et al. Cembrane-type diterpenoids from the Chinese liverworts Chandonanthus hirtellus and C. birmensis [J]. J Nat Prod, 2014, 77: 339-345. |
| [29] | Ortega M J, Zubfa E, Sanchez M C, et al. Cembrane diterpenes from the Gorgonian Leptogorgia laxa [J]. J Nat Prod, 2008, 71: 1637-1639. |
| [30] | Chen S H, Huang H, Guo Y W. Four new cembrane diterpenes from the Hainan soft coral Lobophytum sp. [J]. Chin J Chem, 2008, 26(12): 2223-2227. |
| [31] | Yan X H, Feng L Y, Guo Y W. Further new cembrane diterpenes from the Hainan soft coral Sarcophyton latum [J]. Chin J Chem, 2008, 26(1): 150-152. |
| [32] | Lo K L, Khalil A T, Chen M H, et al. New cembrane diterpenes from Taiwanese soft coral Sinularia flexibilis [J]. Helv Chim Acta, 2010, 93: 1329-1335. |
| [33] | Chen B W, Su J H, Dai C F, et al. Two new cembranes from a Formosan soft coral Sinularia facile [J]. Bull Chem Soc Jpn, 2011, 84(12): 1371-1373. |
| [34] | Shaker K H, Muller M, Ghani M A, et al. Terpenes from the soft corals Litophyton arboretum and Sarcophyton ehrenbergi [J]. Chem Biodivers, 2010, 7: 2007-2015. |
| [35] | Komala I, Ito T, Nagashima F, et al. Zierane sesquiterpene lactone, cembrane and fusicoccane diterpenoid, from the Tahitian liverwort Chandonanthus hirtellus [J]. Phytochemistry, 2010, 71: 1387-1394. |
| [36] | Cheng S Y, Wen Z H, Chiou S F, et al. Durumolides A—E, anti-inflammatory and antibacterial cembranolides from the soft coral Lobophytum durum [J]. Tetrahedron, 2008, 64: 9698-9704. |
| [37] | Chang Y C, Huang I C, Chiang M Y N, et al. Briaviodiol A, a new cembranoid from a soft coral Briareum violacea [J]. Chem Pharm Bull, 2010, 58(12): 1666-1668. |
| [38] | Bonnard I, Jhaumeer-Laullo S B, Bontemps N, et al. New lobane and cembrane diterpenes from two Comorian soft coral [J]. Mar Drugs, 2010, 8: 359-372. |
| [39] | Cheng Y B, Shen Y C, Kuo Y H, et al. Cembrane diterpenoids from the Taiwanese soft coral Sarcophyton stolidotum [J]. J Nat Prod, 2008, 71: 1141-1145. |
| [40] | Chen Y L, Lan Y H, Hsieh P W, et al. Bioactive cembrane diterpenoids of Anisomeles indica [J]. J Nat Prod, 2008, 71: 1207-1212. |
| [41] | Marrero J, Benitez J, Rodriguez A D, et al. Bipinnatins K-Q, Minor cembrane-type diterpenes from the west Indian gorgonian Pseudopterogorgia kallos: isolation, structure assignment, and evaluation of biological activities [J]. J Nat Prod, 2008, 71: 381-389. |
| [42] | Su J H, Lu Y, Lin W Y, et al. A cembranoid, trocheliophorol, from the cultured soft coral Sarcophyton trocheliophorum [J]. Chem Lett, 2010, 39: 172-173. |
| [43] | Chen S H, Guo Y W, Huang H, et al. Six new cembranolides from the Hainan soft coral Lobophytum sp. [J]. Helv Chim Acta, 2008, 91: 873-880. |
| [44] | Su C C, Wong B S, Chin C, et al. Oxygenated cembranoids from the soft coral Sinularia flexibilis [J]. Int J Mol Sci, 2013, 14: 4317-4325. |
| [45] | Hu L C, Yen W H, Su J H, et al. Cembrane derivatives from the soft corals, Sinularia gaweli and Sinularia flexibillis [J]. Mar Drugs, 2013, 11: 2154-2167. |
| [46] | Liang L F, Lan L F, Taglialatela-Scafati O, et al. Sartrolides A—G and bissartrolide, new cembranolides from the South China Sea soft coral Sarcophyton trocheliophorum Marenzeller [J]. Tetrahedron, 2013, 69: 7381-7386. |
| [47] | Lu Y, Huang C Y, Lin Y F, et al. Anti-inflammatory cembranoids from the soft corals Sinularia querciformis and Sinularia granosa [J]. J Nat Prod, 2008, 71: 1754-1759. |
| [48] | Li Y, Gao A H, Huang H, et al. Diterpenoids from the Hainan soft coral Sinularia parva [J]. Helv Chim Acta, 2009, 92: 1341-1348. |
| [49] | Lo K L, Khalil A T, Kuo Y H, et al. Sinuladiterpenes A-F, new cembrane diterpenes from Sinularia flexibillis [J]. Chem Biodivers, 2009, 6: 2227-2235. |
| [50] | Iwagawa T, Hashimoto K, Yokogawa Y, et al. Cytotoxic biscembranes from the soft coral Sarcophyton glaucum [J]. J Nat Prod, 2009, 72: 946-949. |
| [51] | Todorova M, Trendafilova A, Javsmaa N, et al. A new cembrane glycoside in Asterothamnus centrali-asiaticus from Gobi desert [J]. J Asian Nat Prod Res, 2013, 15(9): 1060-1063. |
| [52] | Kamel H N, Ding Y, Li X C, et al. Beyond polymaxenolide: cembrane-africanane terpenoids from the hybrid soft coral Sinularia maxima × S. polydactyla [J]. J Nat Prod, 2009, 72: 900-905. |
| [53] | 李裕林, 李 瀛, 李卫东. 西松烷型二萜天然产物全合成最新进展 [J]. 化学通报, 1994(3): 1-9. |
| [54] | 石 燕, 司成林. 西松烷型二萜内酯的全合成进展 [J]. 有机化学, 2003, 23(5): 413-424. |
 2014, Vol. 45
2014, Vol. 45



