2. 贵州省药用植物繁育与种植重点实验室, 贵州 贵阳 550025
2. Guizhou Engineering Laboratory of Propagation and Cultivation on Traditional Chinese Medicinal Materials, Guiyang 550025, China
天麻Gastrodia elata Bl. 为兰科(Orchidaceae)天麻属Gastrosia R. Br. 植物的干燥块茎,具息风止痉、平抑肝阳、祛风通络的作用。用于治疗小儿惊风,癫痫抽搐、破伤风、头痛眩晕、手足不遂、肢体麻木、风湿痹痛[1]。作为入药的天麻,主要有红杆天麻G. elata Bl. f. elata S. Chow、绿天麻G. elata Bl. f. viridis Malkino、乌杆天麻G. elata Bl. f. g1auca S. Chow和黄天麻G. elata Bl. f. flavida S. Chow等4种变型[2]。目前对于各变型是否能够稳定遗传尚有争议,曾有少量报道关于野生天麻人工种植后下一代变型发生改变的现象[3],但据对大方和德江常年种植天麻的农户了解到栽种了十几年天麻还没有出现类似的情况。天麻中检测到的主要活性成分有天麻苷、香草醇、天麻苷元及其衍生物等[4],其中天麻素量最高,故被用于作为评估天麻质量优劣的指标。各变型的化学成分基本相同但质量分数却有所差异[5],其中乌杆天麻和绿天麻的天麻素量最高,其次是红杆天麻,黄天麻不稳定[6]。不同变型在产量和质量上也有差异,天麻的4种变型中,乌杆天麻和绿天麻为椭圆形,黄天麻和红杆天麻为长椭圆形或三角形。红杆天麻和乌、绿天麻相比种麻有较强的分生能力,每穴产量高,但外形和折干率较差[7]。然而天麻种子不能靠外形来正确判断是属于哪种变型的天麻,在载种时不能保证种子的质量,种源比较混乱,导致产量和质量不稳定。作为药用的天麻,药材质量稳定是关键,劣质天麻或达不到《中国药典》标准的天麻不但没有药用价值,也会存在医疗隐患;同时过大剂量食用天麻也会出现药用反应[9],因此用药时也需要限定相应的剂量标准,而单一种源的天麻是药用规范的保证。因此,天麻优良种源的筛选工作是很有必要的。传统的育种主要依赖于植株的表现型选择,但环境条件、基因间互作、基因型与环境互作等多种因素会影响表型选择效率。以DNA多态性为基础的分子标记,目前已在作物遗传图谱构建[9, 10]、重要农艺性状基因的标记定位[10, 11, 12]、种质资源的遗传多样性分析[13, 14]与品种指纹图谱及纯度鉴定[15, 16]等方面得到广泛的应用,尤其是分子标记辅助选择育种备受遗传育种工作者的重视[17, 18, 19]。
SRAP分子标记技术[20]主要针对基因组中的开放阅读框(ORFs)进行多态性扩增,相对于其他分子标记具有重复性高、扩增出的片段可用于基因的定位与克隆等优点。本研究旨在采用SRAP分子标记技术,对收集自四川、贵州、云南等不同生态条件下的天麻种质资源进行遗传多样性分析与评价,探讨不同种内变型的各天麻种质资源的遗传分化程度,并对不同栽培环境对天麻遗传分化是否造成影响进行了分析,从而为天麻优良种源的筛选提供理论依据。
1 材料与方法 1.1 供试材料PCR反应试剂(10×缓冲液,dNTPs,Mg2+,Taq酶)购自Takara生物公司,引物由上海生工生物工程有限公司合成,DNA Marker(DL2000)购自Takara生物公司。40%丙烯酰胺溶液购自上海生工,琼脂糖凝胶(HyAgarose),天麻DNA提取试剂盒(新型植物基因组DNA提取试剂盒DP230)购自TIANGEN公司。
C1000TM PCR仪(BIO-RAD公司),Eppendorf移液器,DYCZ—22A水平电泳槽(北京六一有限公司),DYCZ—24A垂直电泳槽(北京六一有限公司),离心机(Thermo公司),-80 ℃超低温冰箱Thermo公司),制冰机(SANYO公司),酶标仪(Thermo公司),凝胶成像仪(BIO-RAD公司)。天麻种质来源及详细信息见表 1,经贵州大学农学院罗夫来教授鉴定。
| 表 1 天麻样本信息 Table 1 Samples of information G. elata |
取幼年期天麻或成年期天麻抽薹后茎尖幼嫩部位50~100 mg,加液氮充分研磨成粉状,使用TIANGEN DNAsecure Plant Kit试剂盒提取。用0.8%琼脂糖凝胶对提取的总DNA进行电泳,检测其浓度,用紫外分光光度计检测其纯度。
1.2.2 SRAP分子标记引物组合筛选自由组合11个上游引物和12个下游引物(表 2),得到132对引物,筛选SRAP分子标记原始引物,初始反应扩增体系10 μL:1.5 mmol/L Mg2+、0.5 U Taq DNA聚合酶、0.05 mmol/L dNTPs、0.25 μmol/L引物、30 ng DNA模板。反应程序参考Li等[20]的反应程序。扩增后经1.2%的琼脂糖凝胶电泳筛选出条带丰富且清晰的条带。将用于PCR扩增的天麻DNA模板的浓度稀释至10 ng/μL,用于SRAP实验。
| 表 2 SRAP-PCR所用引物 Table 2 Primers for SRAP-PCR |
为了确定PCR反应体系(10 μL)中模板DNA、引物、Mg2+、dNTPs、TaqDNA聚合酶5个因素的适宜水平,采用正交设计L16(45) 进行5因素4水平试验,3次重复,各因素水平见表 3。
| 表 3 SRAP反应体系优化各因素水平 Table 3 Factors and levels of SRAP-PCR reaction system |
用5%非变性聚丙烯酰胺凝胶对扩增产物进行电泳检测,电压(V)=150 V,功率(W)=4 W,缓冲液为0.5×TBE,电泳时间2 h。银染步骤:固定(10%乙醇+5%冰醋酸溶液)10 min→水洗2 min,洗3次→银染染色(100 mL 0.2% AgNO3+50 μL 37%甲醛)20~30 min→水洗20 s,洗2次→显色(100 mL 1.5% NaOH+500 μL甲醛)2~4 min→水洗终止显色→凝胶成像系统照相保存。
1.3 数据处理根据筛选的引物对所有样本进行扩增。SRAP标记每条带记录为1个位点,以有带记为“1”,无带记为“0”,形成0/1矩阵。数据统计利用NTSYS-pc2.1软件计算Nei’s的遗传距离(D)、遗传一致度,并进行非加权算术平均聚类(UPGMA)分析。结合DCFA和Arlequin ver3.1软件进行AMOVA分析,计算居群内、居群间的遗传分化所占的比例。结合DCFA和popgene32软件计算多态位点百分率(PPB)、Shannon’s信息指数(I)、Nei’s基因多样性(He)、总的遗传多样性(Ht)、居群内的平均遗传多样性(Hs)、居群间的平均遗传多样性(Dst)、遗传分化系数(Gst/Ht)和基因流(Nm)。
2 结果与分析 2.1 天麻基因组DNA提取结果采用TIANGEN 新型植物基因组DNA提取试剂盒(DP230)提取天麻基因组DNA,A260/A280值为1.7~2.2,适宜进行下游的SRAP标记实验。电泳结果见图 1。
 | M-Marker 标序号同表 1,下同 M-Marker figures corresponding to Table 1,same as below 图 1 天麻基因组DNA琼脂糖凝胶电泳Fig. 1 Agarose gel electrophoresis of G. elata genome DNA |
对11条上游引物和12条下游引物进行自由组合,得到132对引物,选择扩增条带数不少于5条且条带清晰的引物组合,最终得到42对供试引物组合(表 4)。
| 表 4 SRAP-PCR引物组合 Table 4 Primers for SRAP-PCR |
优化后的PCR反应体系(10 μL体系):10×缓冲液 1 μL,dNTPs 0.4 μL,MgCl2 0.8 μL,DNA模板1 μL,引物(10 μmol/L)各0.25 μL,Taq酶(5 U/μL)0.1 μL,ddH2O 6.2 μL。该体系扩增条带数最多,最清晰,且没有引物二聚体(图 2)。
 | 1~16分别是16组正交水平,每组用3对引物分别3个重复 M-Marker 1—16-orthogonal levels in 16 groups,each group of three repetition and three primers respectively M-Marker 图 2 PCR体系优化琼脂糖凝胶电泳图Fig. 2 Agarose gel electrophoresis of PCR system optimization |
从42对引物中筛选得到条带清晰、多态性丰富的电泳胶图共33张。图 3中显示出2对引物的电泳凝胶图情况。
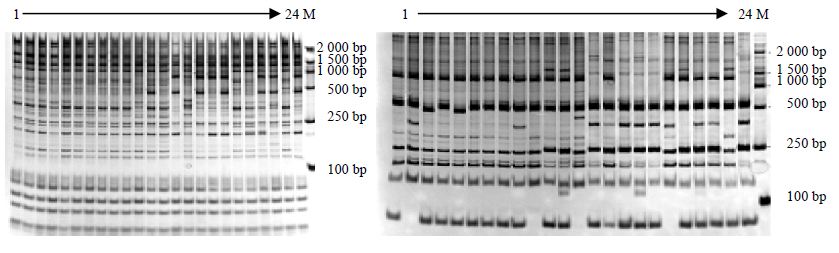 | 图 3 引物组合F10R11和F6R12的PAGE凝胶电泳图Fig. 3 PAGE gel electrophoresis figure for primers combination of F6R12 and F10R11 |
将原始“0/1矩阵”由DCFA软件生成“欧式距离平方系数”,采用Arlequin ver3.1软件对天麻样本分别从不同变型和不同栽培条件两方面进行AMOVA分析,所得结果显示,天麻不同变型内的变异率(66.51%)大于变型间变异率(33.49%),固定系数FST=0.33(P<0.05),说明天麻各变型间有很大的遗传分化(FST>0.25),其中红杆天麻对产生遗传分化的贡献最大(FST=0.418 37),分化程度最高,其次是杂交天麻、乌杆天麻和绿天麻的分化程度相似。
不同栽培条件下,虽然变型内的变异较大,占总变异的93.97%,特别是人工栽培的天麻对变异的贡献最大(FST=0.103 90),但变异不显著,因此从本实验材料中分析发现,到目前为止,不同栽培条件下尚未影响天麻在遗传上的变异。
2.5.2 天麻变型间的遗传分化将原始“0/1矩阵”由DCFA软件处理成符合POPGENE软件分析的数据类型,采用 Nei’s无偏遗传距离估算群体间的遗传分化,计算群体间平均遗传距离和群体间遗传一致度,在3个天麻变型和杂交天麻中,乌和绿天麻的遗传一致度最高(0.967 5),遗传距离最小(0.033 1);红杆天麻和乌杆天麻、红杆天麻和绿杆天麻之间的遗传一致度相似,分别为0.800 2和0.825 9。说明乌杆天麻和绿天麻之间的基因交流高于和红杆天麻之间的基因交流。其次红乌杂交和红杆天麻间遗传距离为0.080 8;杂交天麻和乌杆天麻、绿杆天麻间的遗传距离相近,分别为0.156 3和0.144 2。见表 5。
| 表 5 天麻3种变型及杂交天麻的Nei’s 遗传一致度及遗传距离 Table 5 Nei’s genetic identity and genetic distance among four populations of G. elata |
用DCFA和POPGENE软件分析,筛选出的42对SRAP引物对3个天麻变型和红乌杂交麻群体共24个种质资源进行PCR,共扩增出637条清晰度高、重复性好的条带,其中多态性条带466条,多态位点百分率为73.16%。各变型的多态位点百分比依次为红杆天麻(17.74%)<红乌杂交麻(33.44%)<绿天麻(48.68%)<乌杆天麻(64.05%)。4个天麻变型的He、I、Ae是衡量群体间遗传多样性的重要参数,在这4个群体中,乌杆天麻变型的遗传多样性最高,而乌杆天麻变型的遗传多样性最低。利用Gst对各群体进行遗传结构分析,Gst结果为0.351 3,表明在总的遗传变异中,35.13%的变异存在于居群间,64.87%的变异存在居群内,和MOAVE分析结果一致。不同天麻变型间的基因流为0.923 4。具体结果见表 6。
| 表 6 天麻3种变型及杂交天麻的遗传多样性 Table 6 Genetic diversity of four populations of G. elata |
运用NTSYS-pc2.1软件对凝胶电泳图中的条带数据进行聚类分析,得到UPGMA天麻聚类图(图 4)。
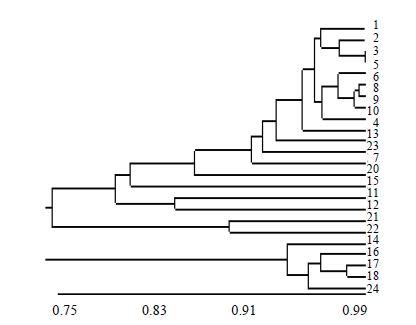 | 相似系数 图中数字同表 1 Figures corresponding to Table 1 图 4 24份天麻材料UPGMA图Fig. 4 UPGMA dendrogram of 24 samples of G. elata |
当相似性系数达到77%时,可以将24份天麻种质资源分为3类,第一类包括来自安徽霍山、四川平武、青川、荥经1,贵州德江、大方1,湖北宜昌1、陕西略阳,山东海阳和湖南溆浦的红杆天麻;四川平武和湖南溆浦的红乌杂交天麻;贵州大方2的绿杆天麻;四川荥经2和平武,湖南溆浦和绥宁的乌杆天麻。第二类包括来自湖北宜昌的两份红乌杂交天麻种质。第三类包括四川马边、峨嵋山、青川的乌杆天麻,云南昭通的乌杆天麻和绿天麻。24份天麻样品间遗传相似程度在0.908 0~0.404 0,3号四川青川和5号贵州德江的红杆天麻遗传相似度最高,为0.908 0。6号贵州大方红杆和14号四川马边乌杆遗传相似度最小,为0.404 0。SRAP分析得到的24个样本除红杆天麻全聚为一类外,其他2种变型以及红乌杂交天麻在3类中均有分布。表明红杆天麻相对于其他2种变型在遗传上较为稳定。
利用TFPGA软件中的mentel分析,对24个样品的遗传距离和采得地之间的直线距离进行了相关性分析,发现r值为-0.005 2,p值为0.556 0,所得结果遗传距离和地理距离没有明显的相关性,由于样本数量过小,并不能反映出总体中的相关性程度,这和目前天麻的种植资源比较混杂,群体数量有限有关(图 5)。
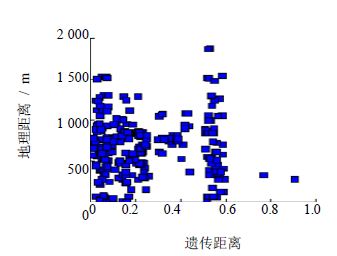 | 图 5 天麻遗传距离与地理距离Mentel检验图Fig. 5 Mentel’s test between genetic and geographic distances |
随着分子标记应用于中药资源鉴定越来越普遍[21, 22, 23],有关天麻多态性研究的相关报道也日益增多。目前,对天麻的分子标记方法主要有AFLP[24, 25]、ISSR[26]、ITS序列分析[27]等,其中王德信等[27]利用ITS方法鉴定了黄、绿、乌三种变型天麻的亲缘关系,研究结果认为乌杆天麻相对于黄、绿天麻而言是更古老的类型,绿天麻是较为进化的类型,黄、绿天麻是由乌杆天麻进化而来。关萍等[24]分别利用ISSR和AFLP分子标记方法对天麻的多态性进行了分析,其中在陈祖云等[26]研究中提出野生和栽培天麻出现较大遗传差异,红杆天麻和黄天麻的变异程度小于乌杆天麻和绿天麻。现有报道对天麻各种变型出现的原因观点不统一,关萍等[24]认为出现的原因只是环境修饰的结果,与遗传没有较大关系,其依据是天麻各变型之间的遗传距离并不远,同一区域的遗传距离差异反而更明显。也有研究者提出天麻的变型和遗传有关系[28],并且是在长期进化过程中发生突变产生[29]。本实验的研究结果更偏向后者的观点,即天麻的变型是遗传和外界环境相互作用的结果。在对24份天麻样品的聚类分析中,遗传相似系数在77%时,来自于5个省的17份样品被聚到同一类,而这5个省的气候、海拔等环境因素均不相同,虽然包含绿、红、乌不同变型,但并不能由此说明,变型的出现只和环境有关系,而和遗传无关。
另外,供试的2份绿杆天麻材料,它们的相似数系数只有42.18%,同一变型的遗传距离差距如此远,值得深入研究。天麻变型之间的颜色可能受单基因控制,遗传相似度低的天麻都有在这些基因位点发生突变的可能,所以也能表现出同种表现型之间的遗传距离出现较大差异。
3.2 不同栽培环境对天麻遗传多样性的影响天麻质量除了和种质资源有关系外,还与菌材种类、萌发菌种类、蜜环菌质量、光照、温度以及水分有关[30],因此环境因子对天麻的生长也起到约束作用。在本实验中,对分别来自野生、人工栽培和林下仿野生栽培3种不同栽培条件下的24份种质资源分成3个群体,探讨不同栽培条件对天麻的遗传多样性是否产生影响,对3个生长环境下的群体进行AMOVA分析,发现群内的变异占总变异的93.97%,大于群间变异。其中人工栽培条件对天麻产生变异的贡献最大(FST=0.103 90),但变异不显著,因此就目前分析的天麻材料而言,不同的栽培条件还没有导致天麻发生遗传上的变异,但不难发现长期进行人工选育会导致遗传分化增大的趋势,因此在育种工作者培育杂交天麻种子的同时,也需要注重丰富亲本资源种质的遗传资源多样性。
3.3 天麻的遗传结构和多样性通过构建UPGMA聚类图,天麻的24个样品没有完全按天麻变型聚为一类,其中红杆天麻的所有样品均在0.9的相似度以内,分化程度较高。其他3个群体分析中,变型间有的遗传相似度很高,变型内有的相似度很低。为了进一步分析不同外界条件和不同变型对天麻遗传多样性的影响规律,通过POPGENE和Arlequin软件对样品的遗传结构进行分析,AMOVA分析后发现,变型间的遗传分化很大,变型内变异大于变型间的变异。其中各变型间的特殊固定系数(special FST index)体现出各变型的分化程度,大小依次为红杆天麻>杂交麻>绿、乌杆天麻。另外,各变型的多态性百分数也得到相同的结果,即红杆天麻的遗传多样性最小,与其他变型间没有太多的基因交流,遗传物质较固定。产生这种差异的原因可能在于,红杆天麻长期的人工驯化或者不同地方红杆天麻相互引种使不同种质频繁杂交导致各地方的红杆天麻种质资源逐渐失去遗传多样性,引起红杆天麻在遗传进化中出现瓶颈效应。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 周 铉. 当今药市上的各种天麻 [M]. 北京: 中国科学院药用植物研究所, 2013. |
| [3] | 徐锦堂. 中国天麻栽培学 [M]. 北京: 北京医科大学中国协和医科大学联合出版社, 1993. |
| [4] | 房 超, 李跃建. 应用SRAP分子标记构建茄子遗传图谱初探 [J]. 西南农业学报, 2010, 28(5): 1591-1594. |
| [5] | 杨世林, 兰 进, 徐锦堂. 天麻的研究进展 [J]. 中草药, 2000, 31(1): 66-69. |
| [6] | 刘小琴, 汪鋆植, 袁 琴. 天麻不同品种及不同组织中天麻素的含量比较 [J]. 时珍国医国药, 2009, 20(4): 908-909. |
| [7] | 刘明学, 李琼芳, 李 梁. 平武天麻GAP基地三种天麻变异类型质量评价 [J]. 现代中药研究与实践, 2009, 23(5): 3-5. |
| [8] | 李德勋, 陈 桂, 等. 天麻不同变异类型药材中天麻素含量比较 [J]. 现代中药研究与实践, 2007, 22(3): 23-24. |
| [9] | Chen W, Zhang Y. Detection of QTL for six yield-related traits in oilseed rape (Brassica napus) using DH and immortalized F2 populations [J]. Theor Appl Genet, 2007, 115: 849-858. |
| [10] | Lu Y Q, Wu W R. Identification of salt-responsive genes in English cordgrass (Spartina anglica) roots using SRAP technique [J]. J Zhejiang Univ, 2006, 32(5): 511-514. |
| [11] | 栾 丽. 同源四倍体水稻三系亲本的遗传差异、细胞遗传学比较研究及低直链淀粉含量突变体Wx基因序列分析 [D]. 成都: 中科院研究生院, 2007. |
| [12] | 邓传良, 曹 莹. 菠菜性别相关SRAP分子标记的筛选及分析 [J]. 基因组学与应用生物学, 2013, 32(4): 516-521. |
| [13] | 胡 秀, 刘 念. 中国姜花属基于SRAP分子标记的聚类分析 [J]. 植物分类学报, 2008, 46(6): 899-905. |
| [14] | 刘雅辉, 刘大群. 23个小麦抗叶锈近等基因系SRAP多态性 [J]. 中国农业科学, 2008, 41(5): 1333-1340. |
| [15] | 王世峰, 王 军. 斜带髭鲷野生与养殖群体遗传结构的ISSR分析 [J]. 海洋学报, 2007, 29(4): 105-110. |
| [16] | 段艳凤, 金黎平. 中国88个马铃薯审定品种SSR指纹图谱构建与遗传多样性分析 [J]. 作物学报, 2009, 35(8): 1451-1457. |
| [17] | Aneja B, Neelam R, Chawla V, et al. Sequence-related amplified polymorphism (SRAP) molecular marker system and its applications in crop improvement [J]. Mol Breed, 2012, 30: 1635-1648. |
| [18] | 陈名红, 李 玉. 分子标记技术在药用植物研究中的应用前景 [J]. 贵州农业科学, 2011, 39(2): 19-22. |
| [19] | Mutlu N, Abak K. Development of SRAP, SRAP-RGA, RAPD and SCAR markers linked with a Fusarium wilt resistance gene in eggplant [J]. Theor Appl Genet, 2008, 117: 1303-1312. |
| [20] | Li G, Quiros C F. Sequence-related amplified polymor-phism (SRAP), a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica [J]. Theor Appl Genetics, 2001, 103: 455-461. |
| [21] | Ku C, Chung W C. The Complete Plastid genome sequence of madagascar Periwinkle catharanthus roseus (L.) G. Don: plastid genome evolution, molecular marker identification, and phylogenetic implications in asterids [J]. PLoS One, 2013, 8(6): e6858. |
| [22] | 尹海波, 王吉华, 涂秀文, 等. 不同产地老鹳草遗传多样性ISSR分析 [J]. 中草药, 2013, 44(22): 3206-3211. |
| [23] | 阳 翠, 刘 萍, 刘姣蓉, 等. 苦豆子ISSR标记的遗传多样性分析 [J]. 中草药, 2013, 44(10): 1323-1327. |
| [24] | 关 萍, 石建明. 不同分布区天麻的AFLP分析 [J]. 植物遗传资源学报, 2013, 14(1): 66-73. |
| [25] | 谢 渊, 张小蕾. AFLP技术在天麻遗传变异研究中的初步应用 [J]. 植物生理学通讯, 2007, 43(1): 141-144. |
| [26] | 陈祖云, 王晓丽. 贵州天麻遗传多态性的ISSR初步分析 [J]. 中华中医药杂志, 2007, 22(7): 436-439. |
| [27] | 王德信. 天麻ITS序列分析及变异类型鉴定 [J]. 生物技术, 2010, 20(6): 33-35. |
| [28] | 李作洲, 暴朝霞, 黄宏文. 药用植物天麻 (Gastrodia elata Bl.) 的等位酶遗传变异及其变型间的遗传关系 [J]. 植物科学学报, 2011, 29(1): 64-73. |
| [29] | 王德信. 天麻ITS-1测序及单核苷酸多态性变异位点分析 [J]. 生物技术, 2012, 22(5): 48-51. |
| [30] | 徐锦堂. 家栽天麻与野生天麻质量比较 [J]. 中国药学杂志, 2000, 35(8): 511-513. |
 2014, Vol. 45
2014, Vol. 45


