2. 中国药科大学 天然药物化学教研室, 江苏 南京 211198
2. Deparment of Natural Medicinal Chemistry, China Pharmaceutical University, Nanjing 211198, China
由于中药所含成分复杂,为研究某一成分在该中药中的作用和地位,通常是先分离中药的化学成分,再进行药理学活性研究。这种方法虽然能够直接反映该成分的药理活性,但不能确切反映该成分在该中药中的作用地位及与其他成分间的相互作用[1]。为此,相关学者通过特异性剔除中药某一成分,而保留其他所有成分不变,研究剔除前后活性的变化,来反向研究该成分在中药中的地位和作用[2, 3, 4, 5, 6, 7, 8]。植物风轮菜Clinopodium chinense (Benth.) O. Kuntze的全草,在福建民间用于治疗糖尿病。实验室前期研究证实风轮菜活性部位(CCE)能够改善链脲佐菌素(STZ)致糖尿病小鼠糖脂代谢,改善高糖所致内皮细胞损伤[9, 10]。已有文献报道芹菜素(apigenin,AP)具有降血糖[11]和保护血管内皮[12]作用。本实验室采用Sephadex LH-20凝胶柱色谱法从CCE中剔除AP,制备剔除AP的CCE(CCEAP-)。通过研究CCE、CCEAP-和AP对高糖诱导的内皮细胞损伤的影响及其机制,探讨AP在风轮菜改善高糖诱导内皮细胞损伤作用中的地位。
1 材料 1.1 细胞株与药材人脐静脉内皮细胞(EA.hy926)由中国药科大学中药药理教研室刘保林教授馈赠。风轮菜全草采集于福建莆田市莆田县,经中国药科大学生药研究室濮社班副教授鉴定为唇形科风轮菜属植物风轮菜Clinopodium chinense (Benth.) O. Kuntze。AP对照品(质量分数98%)由中国药科大学天然药物化学教研室提供。
1.2 试剂甲醇(色谱纯),江苏汉邦科技有限公司;DMEM低糖培养基,Gibco公司;胎牛血清,杭州四季青公司;胰蛋白酶和噻唑蓝(MTT),Sigma公司;二甲基亚砜(DMSO),上海凌峰化学试剂有限公司;2′,7′-二氯荧光素双乙酸盐(DCFH DA)试剂盒,碧云天生物技术研究所;细胞凋亡荧光Hoechst 3258检测试剂盒、Annexin V-FITC 细胞凋亡检测试剂盒及caspase-3分光光度法检测试剂盒,南京凯基生物技术有限公司。十二烷基磺酸钠(SDS)和三羟甲基氨基甲烷(Tris-base)以及过硫酸铵,Amresco公司;蛋白质相对分子质量标准样品(Blue Plue II Protein Marker,10 000~170 000),Fermentas公司;PVDF膜,Millipore公司。单克隆的兔抗-3-磷酸甘油醛脱氢酶(GAPDH)、Bax特异性一抗,Cell Signaling Technology公司。
1.3 仪器TP—114电子天平,丹佛仪器(北京)有限公司;SHIMADZU LC—2010A HT高效液相色谱仪,岛津有限公司;Multiskan Spectrum1500—320酶标仪、702型超低温冰箱及3111型细胞培养箱,Thermo Electron Corporation;JB—CJ—1FDS超净工作台,苏州佳宝净化工程设备有限公司;XSZ—D2倒置显微镜,重庆光学仪器厂;1—15K低温离心机,Sigma Corporation;流式细胞仪,BD FACSCalibur;IX51 S8F—3荧光显微镜(Olympus);Mini Protein 3 Cell垂直电泳槽及Trans-Blot SD Cell电转仪,Bio-Rad。
2 方法 2.1 CCE和CCEAP-的制备 2.1.1 CCE的制备[9]风轮菜用80%乙醇回流提取3次,合并提取液,减压浓缩,将浓缩液依次用3倍量的石油醚、醋酸乙酯分别萃取4次,将醋酸乙酯萃取物用大孔树脂进行柱色谱,以水洗脱杂质后,用乙醇-水进行梯度洗脱(乙醇体积分数20%~80%),合并乙醇洗脱液,减压浓缩干燥,得到CE(得率1.56%)。经HPLC定量测定[13],CCE中含AP 11.01%。
2.1.2 CCEAP-的制备称取CCE 100 mg,甲醇溶解,抽滤,滤液进行Sephadex LH-20凝胶柱色谱,分别用甲醇及丙酮-水(1∶1)溶剂洗脱,20 mL为1份,以AP对照品作为对照,用硅胶TLC法追踪,剔除含有AP的洗脱液后,将其他所有洗脱液合并、减压浓缩、干燥,即得CCEAP-。
2.1.3 HPLC法分析CCE和CCEAP-Inertsil ODS-SP色谱柱(150 mm×4.6 mm,5 μm);流动相为甲醇(A)-水(B),梯度洗脱:0~10 min,30% A,10~30 min,50% A,30~45 min,70% A,45~50 min,50% A,50~55 min,30% A;体积流量1 mL/min;柱温30 ℃;检测波长335 nm。
2.1.4 供试品溶液的制备取样品(CCE、CCEAP-、AP)适量,用50%甲醇溶解制成1 mg/mL的CCE和CCEAP-样品液、250 μg/mL的AP溶液,以0.45 μm微孔滤膜滤过,即得供试品溶液。
2.2 细胞培养EA.hy926细胞在10%胎牛血清的DMEM低糖培养基中于37 ℃、5% CO2培养箱中静置培养。每天换培养液1次,接种后2~4 d,细胞呈单层密集生长,待细胞生长至融合期时用0.25%胰蛋白酶消化传代,按1∶3传代培养。
2.3 CCE、CCEAP-和AP对高糖损伤内皮细胞活力的影响取生长良好的EA.hy926细胞消化成单细胞悬液接种于96孔细胞培养板(每孔1×104),培养24 h后更换培养基。将细胞分为5组:对照组(5.5 mmol/L 葡萄糖)、模型组(33 mmol/L 葡萄糖)、药物组(33 mmol/L 葡萄糖+30 mg/L CCE/30 mg/L CCEAP-/3 mg/L AP)。各组分别培养72 h后,加入含0.5% MTT的培养基20 μL,继续培养4 h,弃培养液,加入150 μL DMSO原液,振荡10 min,待结晶完全溶解后,用酶联免疫仪于490 nm波长处测定吸光度(A490)值,以存活率表示细胞活力。
存活率=药物组A490 / 对照组A490
2.4 CCE、CCEAP-和AP对高糖诱导内皮细胞胞内活性氧(ROS)生成的影响取生长良好的EA.hy926细胞消化成单细胞悬液接种于6孔细胞培养板(每孔1×105),培养24 h后更换培养基。将细胞同“2.3”项分组给药,分别按各组培养条件培养48 h后,用无血清培养基洗涤2次。将DCFH-DA用无血清培养基按1∶1 000稀释(终浓度10 μmol/L),每组加稀释液1 mL,37 ℃孵育染色20 min。染色后PBS洗涤3次,用0.25%胰酶消化细胞,含血清培养基终止。将细胞用500 μL PBS重悬,用流式细胞仪检测细胞内ROS水平。用WinMDI 2.9图像分析软件分析平均荧光强度以表示细胞内ROS的量。
2.5 CCE、CCEAP-和AP对高糖诱导内皮细胞凋亡形态的改善作用取生长良好的EA.hy926细胞消化成单细胞悬液接种于48孔细胞培养板(每孔2×104),培养24 h后更换培养基。细胞分组、给药同“2.3”项,分别按各组培养条件培养48 h后,弃培养液,无血清培养基洗涤细胞2次,用4%多聚甲醛固定10 min,缓冲液 A洗2遍,加入Hoechst 33258染色液,避光反应15 min,PBS洗涤2次,荧光显微镜(激发波长365 nm)下观察(×200)细胞核形态。凋亡细胞荧光强度较强,细胞核变小、浓缩。
2.6 CCE、CCEAP-和AP对高糖诱导内皮细胞凋亡率的影响取生长良好的EA.hy926细胞消化成单细胞悬液接种于6孔细胞培养板(每孔1×105),培养24 h后更换培养基。细胞分组、给药同“2.3”项,分别按各组培养条件培养48 h后,弃培养上清,每组细胞按Annexin V-FITC/PI染色试剂盒说明书进行染色处理,最后通过流式细胞仪检测各组细胞凋亡率。用WinMDI2.9图像分析软件分析平均荧光强度以表示细胞凋亡率。
2.7 CCE、CCEAP-和AP对高糖诱导内皮细胞caspase-3活性的影响取生长良好的EA.hy926细胞消化成单细胞悬液接种于6孔细胞培养板(每孔1×105),培养24 h后更换培养基。细胞分组、给药同“2.3”项,分别按各组培养条件培养48 h后,按caspase-3活性检测试剂盒说明进行细胞收集、裂解,最后进行反应,检测caspase-3的活性。
2.8 CCE、CCEAP-和AP对高糖诱导内皮细胞中Bax表达的影响取生长良好的EA.hy926消化成单细胞悬液接种于6孔细胞培养板(每孔1×105),培养24 h后更换培养基。细胞分组同“2.3”项,分别按各组培养条件培养48 h后,用冰PBS洗涤3次以去除培养基,收集细胞后每个样本加入100 μL蛋白裂解液,冰浴裂解30 min,12 000 r/min离心5 min,收集蛋白上清液。采用二喹啉甲酸法测定蛋白浓度。蛋白质样品与1/4倍量5×SDS上样缓冲液混合均匀,煮沸变性5 min,12% SDS-PAGE 95 V恒压电泳分离2 h,10 V恒压30 min湿转至硝酸纤维素膜上。5%脱脂奶粉制成的封闭液中,室温摇床上封闭2 h,加抗Bax(GAPDH)单抗(1∶1 000),4 ℃过夜孵育。TBST洗膜3次,每次10 min,然后TBST稀释的二抗(1∶5 000)室温孵育2 h,TBST洗膜3次,每次10 min,与化学发光剂ECL反应,X线胶片曝光显影,通过Image J软件处理条带光密度,并进行数据处理。
2.9 统计学处理所有实验数据均以x±s表示,组间比较采用t检验。
3 结果 3.1 CCE和CCEAP-的HPLC分析如图 1所示,HPLC检测CCE与CCEAP-的图谱可知,本实验采用的Sephadex LH-20凝胶柱色谱法基本能从CCE中完全剔除AP。
 | 图 1 AP对照品 (A)、CCE (B) 和CCEAP- (C) 的HPLC色谱图Fig. 1 HPLC of AP reference(A),CCE (B),and CCEAP- (C) |
与对照组比较,高糖模型组EA.hy926细胞存活率显著降低(P<0.01)。与模型组相比,30 mg/L CCE组及3 mg/L AP组细胞存活率显著升高(P<0.01),CCEAP- 30 mg/L组细胞存活率也显著高于模型组(P<0.05),但明显低于CCE组(P<0.05)。另外,CCEAP-组与AP组比较,CCE组与AP组比较,均无显著差异(P>0.05)。表明CCE、CCEAP-和AP均能明显改善高糖对内皮细胞的损伤作用,提高内皮细胞的存活率。但CCEAP-作用弱于CCE。可见,AP是CCE改善高糖对内皮细胞损伤的一个重要成分。结果见图 2。
 | 与模型组比较:*P<0.05 **P<0.01;与CCE 组比较:#P<0.05 *P < 0.05 **P < 0.01 vs model group; #P < 0.05 vs CCE group 图 2 CCE、CCEAP-和AP对高糖诱导损伤的EA.hy926细胞活力的影响(x±s,n=3)Fig. 2 Effect of CCE,CCEAP-,and AP on viability of EA.hy926 cells induced by high glucose(x±s,n=3) |
如图 3所示,与对照组比较,高糖模型组内皮细胞ROS荧光强度明显升高(P<0.01)。与模型组相比,CCE组和AP组胞内ROS荧光强度显著降低(P<0.01),CCEAP-组荧光强度较模型组有所降低,但无显著差异。表明AP是CCE中抑制高糖所致的内皮细胞内ROS生成的一个重要成分。
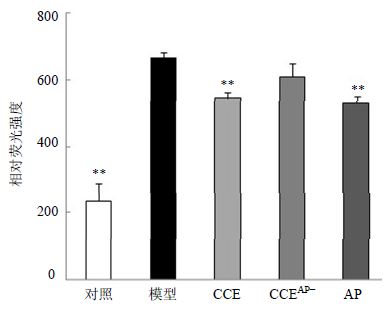 | 与模型组比较:**P<0.01 **P < 0.01 vs model group 图 3 CCE、CCEAP-和AP对高糖诱导EA.hy926细胞胞内ROS生成的影响(x±s,n=3)Fig. 3 Effect of CCE,CCEAP-,and AP on ROS level in EA.hy926 cells induced by high glucose(x±s,n=3) |
如图 4所示,荧光显微镜下观察,高糖模型组显示明显增多的细胞凋亡特征:染色质浓缩,核染呈亮蓝色荧光。而对照组细胞的胞核形态较为一致,均发出均匀淡蓝色荧光,染色较弱。CCE组和AP组细胞凋亡形态均明显改善,而CCEAP-组作用不明显。与对照组相比,高糖模型组的细胞凋亡率显著升高(P<0.01)。与模型组相比,CCE组和AP组细胞凋亡率明显降低(P<0.05),CCEAP-组细胞凋亡率无显著变化。CCEAP-组与CCE组比较,CCEAP-组与和AP组比较,均有显著差异(P<0.05)。表明AP是CCE中抑制高糖所致的内皮细胞凋亡的一个重要成分,与其他成分之间存在协同作用。
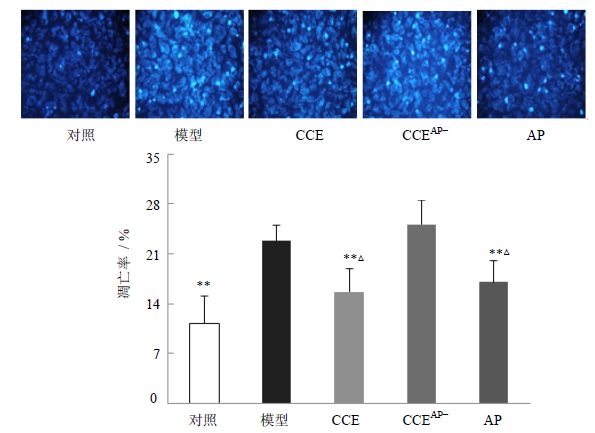 | 与模型组比较:**P<0.01;与CCEAP−组比较:△P<0.05 **P < 0.01 vs model group; △P < 0.05 vs CCEAP− group 图 4 CCE、CCEAP-和AP对高糖诱导EA.hy926凋亡形态及凋亡率的影响(x±s,n=3)Fig. 4 Effect of CCE,CCEAP-,and AP on morphology and ratio of apoptosis in EA.hy926 cells induced by high glucose(x±s,n=3) |
如图 5所示,与对照组相比,高糖模型组细胞caspase-3活性显著升高(P<0.01),是对照组的3.4倍。与模型组相比,CCE、CCEAP-及AP组caspase-3活性显著降低(P<0.01)。CCEAP-组与CCE组、CCEAP-组和AP组、CCE组与AP组相比较均有显著差异(P<0.01)。表明AP是CCE中抑制高糖所致的内皮细胞中caspase-3活性的一个重要成分。
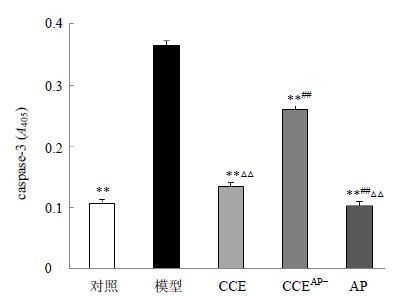 | 与模型组比较:**P<0.01;与CCE组比较:##P<0.01;与CCEAP-组比较:△△P<0.01 **P < 0.01 vs model group; ##P < 0.01 vs CCE group; △△P < 0.01 vs CCE AP- group 图 5 CCE、CCEAP-和AP对高糖诱导EA.hy926中caspase-3活性的影响(x±s,n=3)Fig. 5 Effect of CCE,CCEAP-,and AP on activity of caspase-3 in EA.hy926 cells induced by high glucose(x±s,n=3) |
如图 6所示,与对照组相比,高糖模型组细胞促凋亡蛋白Bax的表达量显著升高(P<0.01),与模型组相比,CCE组及AP组显著降低Bax的表达(P<0.01),抑制率分别为42.1%、28.2%;CCEAP-组无显著差异,抑制率为3.6%。CCEAP-组与CCE组、CCEAP-组和AP组相比,对Bax的表达均有显著差异(P<0.01),CCE组与AP组相比,差异显著(P<0.05)。表明AP是CCE中抑制高糖所致的内皮细胞中Bax高表达的一个重要成分,与其他成分之间存在协同作用。
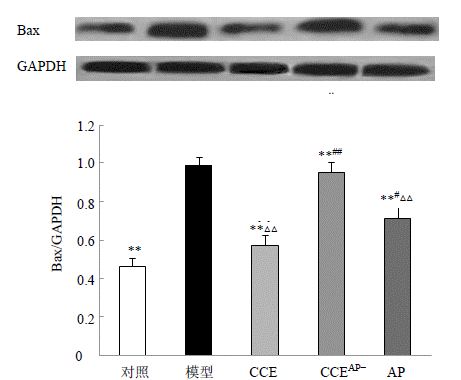 | 与模型组比较:**P<0.01;与CCE组比较:#P<0.05 ##P<0.01;与CCEAP-组比较:△△P<0.01 **P < 0.01 vs model group; #P < 0.05 ##P < 0.01 vs CCE group; △△P < 0.01 vs CCE AP- group 图 6 CCE、CCEAP-和AP对高糖诱导EA.hy926中Bax表达的影响(x±s,n=3)Fig. 6 Effect of CCE,CCEAP-,and AP on expression of Bax in EA.hy926 cells induced by high glucose(x±s,n=3) |
由于中药成分的复杂性,中药研究尤其是所含成分在中药中的作用地位及各成分之间相互作用的研究,目前尚缺乏理想的研究方法。已有文献报道采用免疫亲和色谱柱[14]、薄层色谱法、化学分离后根据出膏率重新组合等方法进行目标成分的剔除,研究剔除前后活性的变化,明确该成分在该中药中的作用地位,从而阐明中药作用的物质基础。本实验采用Sephadex LH-20凝胶柱色谱法从CCE中特异剔除AP,制备了CCEAP-。
血管内皮细胞通过产生多种活性物质对细胞内理化信号产生应答,产生多重生物学功能,从而保持血管正常张力,维持内皮细胞正常功能[15]。已有研究证明血管内皮功能障碍是糖尿病血管并发症发生的重要因素,被认为是动脉粥样硬化发生发展的始动因素[16]。高血糖可通过多种途径诱导血管内皮细胞凋亡,进而导致血管内皮细胞功能障碍[17]。
高糖通过诱导氧化应激反应所致的血管内皮细胞凋亡是高血糖引起糖尿病患者血管内皮损伤和功能障碍过程中的一个重要的早期事件[18, 19, 20]。细胞凋亡又称程序性死亡,是通过激活特定的信号通路严格控制的过程。其形态学变化特点是细胞皱缩、DNA降解、染色质凝聚、凋亡小体形成[21]。Caspase家族属于天冬氨酸特异的半胱氨酸蛋白酶,与细胞凋亡调控密切相关。其中,caspase-3作为凋亡执行蛋白,其直接参与了细胞的凋亡过程。Bcl-2蛋白家族通过调控线粒体膜孔道决定细胞对凋亡刺激的相对敏感性[22]。
本实验通过MTT法、Hoechst染色法、流式细胞术、分光光度法及蛋白免疫印迹法检测,发现CCE及AP能够显著提高高糖损伤的血管内皮细胞活力,提高细胞存活率,降低胞内ROS水平,减弱caspase-3活性,及抑制Bax的表达,从而抑制凋亡的发生。而剔除AP的CCE虽然也能改善内皮细胞损伤,但效果弱于AP及CCE。可见,AP是风轮菜改善高糖所致内皮细胞损伤的重要成分之一,其改善高糖诱导内皮细胞凋亡作用与抗氧化应激有关。
总之,本实验通过特异剔除CCE中的AP,验证了AP在CCE改善高糖所致内皮细胞损伤中的作用地位,这为阐明风轮菜改善高糖所致的血管内皮损伤的物质基础提供了实验依据。
| [1] | 徐 强. 中药成分在方剂中的作用及其研究思路 [J]. 中国天然药物, 2006, 4(5): 327-331. |
| [2] | 肖小河, 鄢 丹, 袁海龙, 等. 基于成分敲除/敲入的中药药效组分辨识与质量控制模式的商建 [J]. 中草药, 2009, 40(9): 1345-1348. |
| [3] | Yan D, Li J X, Xiong Y, et al. Promotion of quality standard of herbal medicine by constituent removing and adding [J]. Sci Rep, 2014, doi: org/10.1038/srep03668. |
| [4] | 张甜甜. 基于成分敲除/敲入的中药金银花药效组分辨识与质量评价研究 [D]. 成都: 成都中医药大学, 2011. |
| [5] | Kong W J, Wang J B, Zang Q C, et al. Fingerprint-efficacy study of artificial Calculus bovis in quality control of Chinese materia medica [J]. Food Chem, 2011, 127(3): 1342-1347. |
| [6] | Sun Y, Dong Y, Jiang H J, et al. Dissection of the role of paeoniflorin in the traditional Chinese medicinal formula Si-Ni-San against contact dermatitis in mice [J]. Life Sci, 2009, 84: 337-344. |
| [7] | Zhang L, Sun Y, Chen T, et al. Selective depletion of glycyrrhizin from Si-Ni-San, a traditional Chinese prescription, blocks its effect on contact sensitivity in mice and recovers adhesion and metalloproteinases production of T lymphocytes [J]. Int Immunopharmacol, 2005, 5: 1193-1204. |
| [8] | 徐 强, 孙 洋, 陈 婷, 等. 以四逆散为例谈中药成分在复方中的作用地位 [J]. 中药药理与临床, 2007, 23(5): 45. |
| [9] | Li J, Wu F H, Chen K, et al. Extract of Clinopodium chinense inhibits high glucose-induced apoptosis in human umbilical vein endothelial cells [J]. J Cardiovasc Pharmacol, 2013, 61: 265-271. |
| [10] | 吴斐华, 梁敬钰, 刘 洋, 等. 一种防治糖尿病的风轮菜有效部位的制备方法与药物用途: ZL201010267636.4 [P].2010-08-31. |
| [11] | Panda S, Kar A. Apigenin (4, 5, 7-trihydroxyflavone) regulates hyperglycaemia, thyroid dysfunction and lipid peroxidationin alloxan-induced diabetic mice [J]. J Pharm Pharmacol, 2007, 59(11): 1543-1548. |
| [12] | 李永齐, 季 晖, 马 飞, 等. 芹菜素延缓人脐静脉内皮细胞衰老的体外实验研究 [J]. 药学进展, 2009, 33(10): 463-466. |
| [13] | 郭 英. HPLC法测定大叶水芹菜中芹菜素含量 [J]. 微量元素与健康研究, 2010, 27(3): 37-38. |
| [14] | 陈 亮, 陈 婷, 徐 强. 免疫亲和色谱特异性剔除中药方剂四逆散中的柚皮苷 [J]. 色谱, 2006, 24(3): 243-246. |
| [15] | Hennig B, Toborek M. Nutrition and endothelial cell function: implications in atherosclerosis [J]. Nutr Res, 2001, 21: 279-293. |
| [16] | Chai D J, Wang B Y, Shen L H, et al. RXR agonists inhibit high glucose-induced oxidative stress by repressing PKC activity in human endothelial cells [J]. Free Radic Biol Med, 2008, 44: 1334-1347. |
| [17] | Allen D A, Yaqoob M M, Harwood S M. Mechanisms of high glucose-induced apoptosis and its relationship to diabetic complications [J]. J Nutr Biochem, 2005, 16: 705-713. |
| [18] | Franco R, Sánchez-Olea R, Reyes-Reyes Elsa M, et al. Environmental toxicity, oxidative stress and apoptosis: Ménage à Trois [J]. Mutat Res, 2009, 674: 3-22. |
| [19] | Mah E, Bruno R S. Postprandial hyperglycemia on vascular endothelial function: mechanisms and consequences [J]. Nutr Res, 2012, 32: 727-740. |
| [20] | Doina P. Endothelial cell dysfunction in hyperglycemia: Phenotypic change, intracellular signaling modification, ultrastructural alteration, and potential clinical outcomes [J]. Int J Diabetes Mellitus, 2010, 2: 189-195. |
| [21] | Pulido M D, Parrish A R. Metal-induced apoptosis: mechanisms [J]. Mutat Res, 2003, 533: 227-241. |
| [22] | Khalil H, Bertrand M J M, Vandenabeele P, et al. Caspase-3 and RasGAP: a stress-sensing survival/demise switch [J]. Trends Cell Biol, 2014, 24(2): 83-89. |
 2014, Vol. 45
2014, Vol. 45


