2. 华东理工大学药学院, 上海 200237
2. School of Pharmacy, East China University of Science and Technology, Shanghai 200237, China
人参皂苷Rh1(Rh1)为四环三萜类化合物,为我国传统名贵中药材三七中分离纯化得到的一种痕量皂苷。Rh1具有抑制癌细胞增殖、修复损伤血红细胞以及消炎镇痛等生理活性[1, 2, 3, 4]。但是,在经po给药后,Rh1的生物利用度仅为1.01%,且血液消除速率较快[5],这些不利因素影响了其在体吸收效率,限制了Rh1作为活性药用成分的进一步开发和利用。另一方面,目前尚未有文献对Rh1的经皮促渗作用进行研究。因此,积极探索Rh1新的给药途径,研究Rh1经皮吸收代谢特征,具有显著的研究意义。课题组在前期工作中已对Rh1的理化特征和经皮吸收行为进行了初步研究。结果表明,虽然Rh1在模型皮肤中表现出一定程度的跨膜转运能力,但是其较大的相对分子质量和较高的熔点,限制了药物经皮扩散的速度和效率。因此,为促进药物的经皮吸收特性,有必要针对Rh1进行促渗剂的研究和考察。
离子液体作为一种可设计的绿色溶剂,具有较宽的液体稳定范围、较强的溶解能力、较低的蒸汽压、较适合的黏度等特性,被广泛应用于有机合成、萃取分离、电化学、纳米材料、清洁燃料等领域[6]。近年来,离子液体在制药领域的应用得到了初步的研究。国外有研究表明,以离子液体微乳为载药基质,对难溶药物进行体外经皮渗透实验,可以增加难溶药物的经皮渗透能力,并且表现出较低的细胞毒性,生物安全性较好[7, 8, 9, 10, 11]。这些实验结果表明,在经皮给药系统中,离子液体能够作为一种新颖的经皮吸收促渗剂使用。但目前为止,国内外尚未有文献报道对离子液体的经皮促渗作用及促渗机制展开研究。
本实验以咪唑类离子液体([BMIM][Cl])为促渗剂,以常用促渗剂油酸、薄荷脑、肉豆蔻酸异丙酯做对比,考察了 [BMIM][Cl] 对Rh1的体外经皮促渗作用。在此基础上,对离子液体的促渗机制进行了初步研究,为离子液体在外用制剂中的开发利用提供一定的理论依据。
1 仪器与材料CP114电子分析天平,上海奥豪斯仪器有限公司;DF—101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司; LC—20AB型高效液相色谱仪,SPD—20A UV/Vis检测器,日本岛津公司;YB—P6智能透皮试验仪,天津天光光学仪器有限公司;TDZS—WS台式低速离心机,湖南湘仪实验室仪器开发有限公司;BRUKER—VECTOR22型傅里叶变换红外光谱(FTIR)仪,瑞士Bruker公司;SWF—111B恒温培养振荡器,上海智城分析仪器制造有限公司。
Rh1对照品,质量分数>98%,阿拉丁试剂有限公司,批号MUST-13052206;Rh1原料药,昆明理工大学生药学研究组提供,质量分数>95%;1-丁基-3-甲基咪唑氯化盐(1-butyl-3-methylimidazolium chloride salt,[BMIM][Cl]),购于中科院兰州物化所,质量分数>98%;油酸(oil acid,OA)、肉豆蔻酸异丙酯(isopropyl myristate,IPM)、薄荷脑(menthol,MT)、氯化钠(NaCl)、磷酸二氢钾(KH2PO4)、磷酸氢二钠(Na2HPO4)、氯化钾(KCl),购于上海邦成化工有限公司;乙腈为色谱纯,其余试剂为化学纯;水为二次蒸馏水。
昆明种小鼠,8~10周龄,20~25 g,雌雄各半,许可证号SCXK(滇)2011-2014,由昆明医科大学动物实验中心提供;猪,体质量(10±2)kg,雄性,购于当地屠宰场。
2 方法与结果 2.1 Rh1体外分析色谱条件 2.1.1 色谱条件色谱柱为Thermo Scientific BDS HYPERSIL C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水,梯度洗脱:0~20 min,25%~40%乙腈;柱温25 ℃;检测波长203 nm;进样量10 μL。色谱图见图 1。
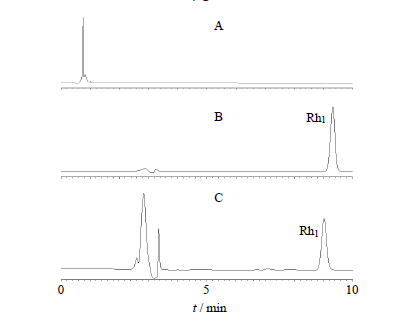 | 图 1 空白对照 (A)、Rh1对照品 (B) 和透皮接收液 (C)Fig. 1 HPLCof blank sample (A), Rh1 reference substance (B), and percutaneous absorption liquid (C) |
精密称取一定量的Rh1对照品,用甲醇溶解并定容,配置成0.5 mg/mL储备液;用甲醇稀释成质量浓度分别为1、1.5、5、10、20、50、180 μg/mL的对照品溶液,分别进样测定。以峰面积为纵坐标(Y),质量浓度为横坐标(X)进行线性回归,计算得到标准曲线Y=11 435 X+56,r=0.999 5,Rh1在1~180 μg/mL线性关系良好。
2.1.3 精密度考察取质量浓度为1、10、50 μg/mL的溶液,1 d内连续测定5次,连续5 d测定。计算得日内及日间精密度的RSD分别为1.49%、1.88%、1.72%和1.92%、0.98%、1.35%。
2.1.4 稳定性考察取质量浓度为50 μg/mL的溶液,32 ℃震荡24 h,分别于0、2、8、12、24 h进样,记录峰面积,计算RSD为1.63%,表明Rh1溶液在32 ℃温度下、24 h内稳定性良好。
2.1.5 重复性试验取5份不同的供试品溶液进行进样,测定峰面积,计算得Rh1量的RSD值为1.47%,表明本方法的重复性良好。
2.1.6 回收率试验取一定量的Rh1对照品溶液,加入到12 h空白皮肤渗透液中,制成低、中、高质量浓度(1、10、50 μg/mL)系列溶液,并按照“2.1.1”项色谱条件进样,测定峰面积并计算其平均回收率为97.63%,RSD为1.25%。
2.2 数据处理与分析 数据采用x±s表示。采用SPSS软件,对组间数据的差异性进行配对t检验;对组间数据的相关性进行Pearson双侧检验(P<0.05)。 2.3 Rh1溶解度考察[12]采用摇瓶法测定Rh1在不同溶剂中的表观溶解度。称取过量的Rh1,分别溶于一定量的蒸馏水或添加一定量促渗剂的蒸馏水中,配置成过饱和溶液,在摇床中32 ℃震荡24 h,离心(4 000 r/min,10 min),微孔滤膜滤过,适当稀释后用HPLC检测药物质量分数,计算药物在不同溶剂中的溶解度,结果如表 1所示。由表 1可知,Rh1在水中的表观溶解度为(60.70±3.21)μg/mL,属于难溶药物。5%的OA和MT的水溶液并没有表现出对Rh1的增溶作用;5%的IPM表现出一定的增溶作用。而Rh1在3%的 [BMIM][Cl] 水溶液中溶解度显著提高(P<0.05),在5% [BMIM][Cl] 的溶解度则比空白溶液提高了将近3倍。表明 [BMIM][Cl] 对Rh1有着显著的增溶作用[9]。
| 表 1 Rh1在不同介质中的溶解度 Table 1 Solubility of Rh1 in different aqueous solutions. |
小鼠剪去腹部毛发,处死后剥离腹部皮肤,去除皮下脂肪及黏液组织,用生理盐水反复冲洗干净,置于−20 ℃冰箱保存备用。使用前须对小鼠皮肤的完整性、均匀性进行肉眼检查。
2.4.2 接收液制备称取8 g NaCl、0.2 g KCl、1.44 g Na2HPO4和0.24 g KH2PO4,加适量蒸馏水溶解,调pH值至7.4,制备为0.01 mol/L pH 7.4的等渗磷酸盐缓冲液(PBS 7.4),作为透皮实验接收液。
2.4.3 经皮渗透实验采用Franz立式扩散池对Rh1的经皮渗透性能进行测定。实验时先将小鼠皮在室温下自然解冻,用生理盐水洗净,滤纸吸干表面水分,将处理好的皮肤固定于扩散装置的中间,使角质层面向供药池,用配套钢夹夹稳。以“2.3”项中制备的Rh1饱和溶液为供药试液。在供给池中加入1 mL的供试药液,供给池顶覆以铝箔纸。在接收池中加入15.0 mL 0.01 mol/L的PBS溶液,使皮肤与接收液充分接触,池内水温设置为36.5 ℃,恒温磁力搅拌。加样后平衡30 min后开始计时,于0.5、1、2、3、4、6、8、10、12 h从样品接 收池中取出1 mL样品,同时补加等量同温的接收液至接收池,将取出的样品经0.45 μm微孔滤膜滤过,用HPLC法测定药物的量。
2.4.4 Rh1皮肤滞留量考察[13]透皮实验结束后,取下离体皮肤,剪下给药部位,用蒸馏水和无水乙醇交替擦拭皮肤表面各3次,以除去离体皮肤表面残留药物,用滤纸吸干水分后,将皮肤剪碎,置于离心管中,加甲醇1 mL旋涡5 min后超声提取1 h,离心15 min,取上清液经0.45 μm微孔滤膜滤过,用HPLC测定药物的量。
2.4.5 Rh1经皮吸收曲线绘制及透皮参数计算采用式(1)计算Rh1的累积透皮量(Qt)。式中,Ct为t时刻取样点测得的药物质量浓度;Ci为第i个取样点的药物质量浓度;A为透皮面积(1.57 cm2);V0为接收池中溶液的体积(15.0 mL);V为取样体积(1.0 mL)。以Qt对t</ span>作图,绘制药物的Qt-t曲线。
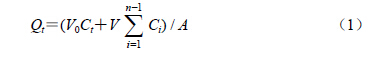
采用式(2)计算Rh1的皮肤滞留量。式中,Qm为12 h的药物累积滞留量,C为皮肤中提取的药物质量浓度,V为甲醇用量(1.0 mL),A为透皮面积(1.57 cm2)。

由药物的Qt-t曲线直接计算透皮时滞Tlag,由图中直线部分的斜率得出药物的稳态流量(J)。采用式(3)计算药物的经皮扩散系数(Pm)。

采用式(4)计算促渗剂的经皮促渗效率(ER)。式中,Je为促渗剂组药物的J,J0为空白对照组药物的J。

实验中选择了小鼠皮和猪皮2种皮肤模型,考察了 [BMIM][Cl] 以及其他常用促渗剂OA、IPM、MT对Rh1体外经皮促渗作用,如图 2所示。各实验组的透皮参数如表 2所示。
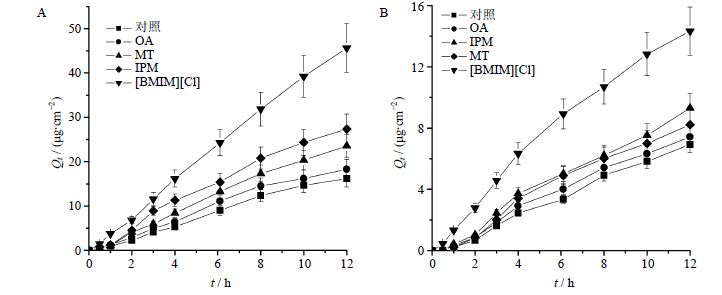 | 图 2 各促渗剂对Rh1经小鼠皮 (A) 和猪皮 (B) 吸收的影响Fig. 2 Effect of mice skin (A) and porcine skin (B) permeation enhancers on Rh1 transdermal absorption |
由图 2-A、B可知,Rh1对于小鼠皮肤的通透性要显著高于猪皮皮肤。不同的促渗剂对药物具有不同的促渗效果。与空白对照组(Rh1饱和水溶液)相比,OA的加入并没有显著改变药物在小鼠皮和猪皮中的经皮渗透行为。MT和IPM则表现出一定的经皮促渗作用。以小鼠皮为例,在2种促渗剂的作用下,药物的J和Q12都出现了明显的增加(P<0.05);而透皮时滞减少(表 2);增渗比分别为1.36(MT)和1.59(IPM)。综合考察发现,离子液体 [BMIM][Cl] 作为一种新型的促渗剂,表现出了最佳的经皮促渗效果:以小鼠皮为例进行分析,[BMIM][Cl] 组具有最高的J、Q12和ER值(与其他促渗剂组相比P<0.05)。以猪皮为皮肤模型同样可以得到相似的考察结果(图 2-B,表 2)。
| 表 2 不同促渗剂对Rh1在小鼠皮和猪皮中经皮渗透参数的影响 Table 2 Effect of permeation enhancers on permeation coefficients of Rh1 in mice skin and porcine skin. |
而另一方面,实验考察了各促渗剂对药物的皮肤滞留量的影响,结果如图 3所示。OA、MT和IPM并没有增加药物在小鼠皮和猪皮中的滞留量;与其他促渗剂相比,Rh1在 [BMIM][Cl] 组的皮肤滞留量明显提高,表明 [BMIM][Cl] 通过增加药物从供给液到皮肤中的分配和扩散,从而起到经皮促渗的作用。
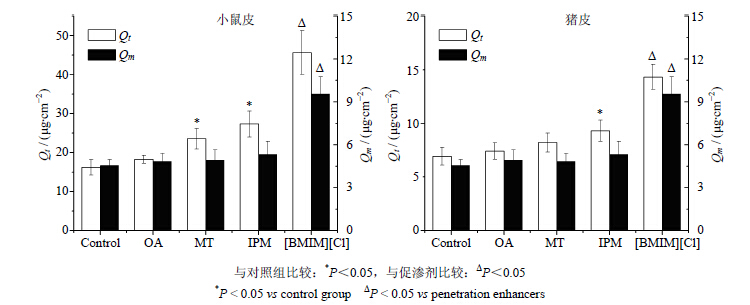 | 图 3 各促渗剂对Rh1累积经皮渗透量和累积滞留量对比 Fig. 3 Comparison on permeation/retention amount of Rh1 with treatment of different enhancers |
实验中以小鼠皮肤为模型,考察了不同质量浓度的 [BMIM][Cl] 对Rh1经皮渗透作用的影响,结果见图 4和表 3。由图 4-A可知,随着离子液体质量浓度的增加,其对药物的经皮促渗作用明显增强:当离子液体质量浓度从10 g/L上升到50 g/L时,药物的经皮渗透参数J和Q12均有显著提高,ER值也由1.32上升为2.69(表 3)。
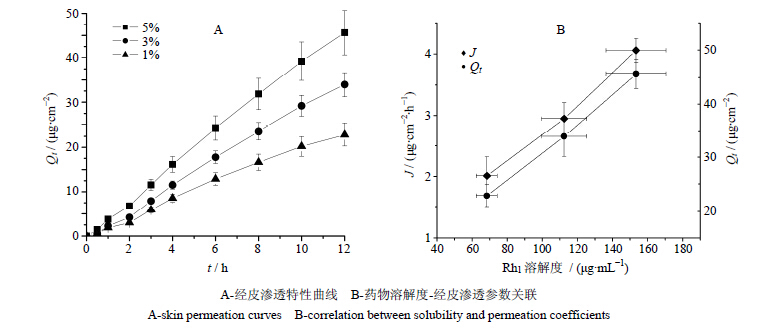 | 图 4 [BMIM][Cl] 质量浓度对Rh1经皮吸收的影响Fig. 4 Effect of [BMIM][Cl] concentration on skin permeation profiles of Rh1 |
| 表 3 [BMIM][Cl] 质量浓度对Rh1经皮渗透参数的影响 Table 3 Effects of [BMIM][Cl] concentration on Rh1 |
实验中将Rh1在不同质量浓度的 [BMIM][Cl]-水溶液中的溶解度(表 2)与药物的经皮渗透参数J和Q12进行了关联。结果如图 4-B所示。随着 [BMIM][Cl] 在水中质量浓度的增加,Rh1的溶解度逐渐增大,因此在介质中表现出更强的经皮渗透能力。药物在介质中的溶解度和其经皮渗透参数有着很好的线性关系(r>0.95)。
2.5 模型皮肤的FTIR谱图研究 2.5.1 皮肤的FTIR测定[14]为考察离子液体的促渗机制,实验中测定了离子液体处理过的皮肤的FTIR。“2.4.2”项下透皮实验结束后,取下离体小鼠皮肤,剪下给药部位,用蒸馏水和无水乙醇交替擦拭皮肤表面各3次,以除去离体皮肤表面残留药物。将皮肤真空干燥(22 ℃,12 h)除去水分,进行FITR检测。检测波长范围1 000~4 000 cm-1,扫描精度为0.1 cm-1。
2.5.2 [BMIM][Cl] 对小鼠皮肤结构的影响角质层的主要成分为脂质和角蛋白。实验中以生理盐水代替药物进行实验作为对照,考察了 [BMIM][Cl] 对小鼠皮肤角质层结构的影响,结果见图 5。由图 5-A可知,角质层脂质的特征吸收峰位于2 849.2 cm-1(C-H对称振动)和2 918.3 cm-1(C-H非对称振动)以及1 739.1 cm-1(C=O振动)处;角蛋白的特征峰为3 288.7 cm-1(N-H振动),1 650.3、1 540.3 cm-1(NH-C=O振动)[14, 15]。
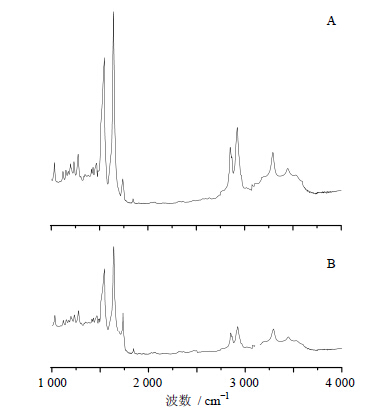 | 图 5 对照组 (A) 和5% [BMIM][Cl] 组 (B) 小鼠皮肤FTIR谱图Fig. 5 FTIRspectraof mice skin treated with normal saline (A) and 5% [BMIM][Cl] aqueous solution (B) |
经过5% [BMIM][Cl] 的离子液体处理,小鼠皮肤的结构出现了一定程度的变化。如图 5-B所示,角质层脂质的特征峰向高频区发生了位移,C-H对称振动峰移至2 850.6 cm-1处;而非对称振动峰移至2 919.5 cm-1处;此外,角蛋白的特征峰向低频区发生了轻微的移动:NH-C=O峰移动至1 649.2、1 539.1 cm-1处。而另一方面,C=O和N-H特征吸收峰并没有发生移动。
3 讨论实验中以咪唑类离子液体 [BMIM][Cl] 为促渗剂,考察了其对三七中稀有人参皂苷Rh1的经皮促渗作用。由“2.3”项的考察结果可知,与常用促渗剂OA、MT、IPM相比,[BMIM][Cl] 对Rh1具有显著的增溶作用[9],药物的溶解度随着离子液体在介质中的质量浓度增加而增加。
各种动物之间的解剖差异很大。不同动物的角质层厚度、单位面积汗腺数量与毛孔数量等都不一样。小鼠皮和猪皮是药物经皮渗透研究中2种常用的皮肤模型。据文献报道,猪皮的角质层厚度约为26 μm,而小鼠角质层厚度仅为6 μm左右。因此,Rh1在小鼠皮中具有更好的经皮通透特性,由“2.4”项的考察结果可知,Rh1在小鼠皮中的J值和Q12值均为猪皮中的2~3倍。与之相对应,药物在小鼠皮中的滞留量也高于猪皮中的滞留量。
在几种促渗剂中,离子液体对药物具有最强的经皮促渗作用;且促渗作用随着 [BMIM][Cl] 质量浓度的增加而增强。结合“2.3”项和“2.4”项的考察结果发现,离子液体通过增加药物在介质中的溶解度,从而增加药物经皮扩散的浓度梯度,促进药物的经皮吸收;且促渗作用和离子液体的浓度存在着良好的量-效关系。另一方面,离子液体可以显著增加药物在皮肤中的滞留量,使药物在皮肤中形成药物贮库,保证药物以一定的速率持续地释放到接收池中。
由“2.5”项的考察结果可知,[BMIM][Cl] 能够影响皮肤角质层的FTIR。C-H键的伸缩振动吸收峰来自于角质层中脂质(游离脂肪酸)。C-H伸缩振动吸收峰位移的大小与反式结构转变为交叉式结构的多少有直接关系,即与角质的无序排列程度有关:C-H伸缩振动峰向高波数移动,表明角质层有序排列的结构被破坏[16]。有文献报道,使C-H伸缩振动吸收峰向高波数移动的的促进剂可以提高药物的透过量[15]。实验结果提示,[BMIM][Cl] 与皮肤角质层中脂质发生作用,使侧链无序性变大,导致脂质的流动性增加,减少了药物透过皮肤进入体内的阻力。此外,NH-C=O键的伸缩振动来自于角质层中的角蛋白。NH-C=O峰向低波数移动,意味着角蛋白α-螺旋结构的量减少,使角蛋白从α-螺旋结构向β-折叠结构与无规则卷曲结构转变,从而导致角蛋白堆积结构变得疏松而增加药物的通透性[16]。
综上所述,[BMIM][Cl] 对Rh1具有显著的体外经皮促渗作用。其促渗作用可从以下2方面进行推测:首先,[BMIM][Cl] 具有显著的增溶作用,能够增加药物在溶液中的质量浓度,从而增加药物在皮肤中的扩散浓度梯度;其次,[BMIM][Cl] 能够破坏皮肤中致密的脂质结构,增加了脂质的流动性,减小了药物经皮渗透的阻力。研究离子液体作为经皮促渗剂的结构与促渗效果之间的关系;同时对其作为药用辅料的皮肤安全性做出评价,是今后值得继续深入考察的2个方向。
| [1] | Lee Y J, Jin Y R, Lim W C, et al. A ginsenoside-Rh1, a component of ginseng saponin, activates estrogen receptor in human breast carcinoma MCF-7 cells [J]. J Steroid Biochem, 2003, 84(4): 463-468. |
| [2] | Liu W K, Xu S X, Che C T. Anti-proliferative effect of ginseng saponins on human prostate cancer cell line [J]. Life Sci, 2000, 67(11): 1297-1306. |
| [3] | Samukawa K, Suzuki Y, Ohkubo N, et al. Protective effect of ginsenosides Rg2 and Rh1 on oxidation-induced impairment of erythrocyte membrane properties [J]. Biorheology, 2008, 45(6): 689-700. |
| [4] | Park E K, Choo M A, Han M J, et al. Ginsenoside Rh1 Possesses antiallergic and anti-inflammatory activities [J]. Int Arch Allergy Immuno, 2004, 133(2): 113-120. |
| [5] | Li L, Hao H P, Liu Y T, et al. Characterization of pharmacokinetic profiles and metabolic pathways of 20 (S)-ginsenoside Rh1 in vivo and in vitro [J]. Planta Med, 2009, 75(8): 797-802. |
| [6] | 张星辰. 离子液体-从理论基础到研究进展 [M]. 北京: 化工出版社, 2009. |
| [7] | Moniruzzaman M, Kamiya N, Goto M. Ionic liquid based microemulsion with pharmaceutically accepted components: Formulation and potential applications [J]. J Colloid Interface Sci, 2010, 352(1): 136-142. |
| [8] | Moniruzzaman M, Tahara Y, Tamura M, et al. Ionic liquid-assisted transdermal delivery of sparingly soluble drugs [J]. Chem Commun, 2010, 46(9): 1452-1454. |
| [9] | Moniruzzaman M, Tamura M, Tahara Y, et al. Ionic liquid-in-oil microemulsion as a potential carrier of sparingly soluble drug: characterization and cytotoxicity evaluation [J]. Int J Pharm, 2010, 400(1/2): 243-250. |
| [10] | Jaitely V, Karatas A, Florence A T. Water-immiscible room temperature ionic liquids (RTILs) as drug reservoirs for controlled release [J]. Int J Pharm, 2008, 354(1/2): 168-173. |
| [11] | Dobler D, Schmidts T, Klingenhofer I, et al. Ionic liquids as ingredients in topical drug delivery systems [J]. Int J Pharm , 2013, 441(1/2): 620-627. |
| [12] | Zhao L G, Fang L, Xu Y N, et al. Effect of O-acylmenthol on transdermal delivery of drugs with different liophilicity [J]. Int J Pharm, 2008, 352(1/2): 92-103. |
| [13] | Wang C X, Ma J F, Liu R, et al. A thermoplastic elastomer patch matrix for traditional Chinese medicine: design and evaluation [J]. Drug Dev Ind Pharm, 2014, 40(2): 211-221. |
| [14] | Kuljit S B, Gao S, Singh J. Effect of penetration enhancers and iontophoresis on the FTIR spectroscopy and LHRH permeability through porcine skin [J]. J Controlled Release, 1997, 47: 81-89. |
| [15] | Takahashi K, Sakano H, Yoshida M, et al. Characterization of the influence of polyol fatty acid esters on the permeation of diclofenac through rat skin [J]. J Controlled Release, 2001, 73(2/3): 351-358. |
| [16] | 赵利刚. 新型薄荷醇酯类衍生物经皮促透作用评价及其促透机理的初步研究 [D]. 沈阳: 沈阳药科大学, 2009. |
 2014, Vol. 45
2014, Vol. 45


