2. 中国医学科学院 北京协和医学院药用植物研究所, 北京 100193
Development, Chinese Academy of Medical Sciences, and Peking Union Medical College, Jinghong 666100, China;
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences, and Peking Union Medical College, Beijing 100193, China
金线莲别名金线兰、金丝草,在民间以全草作为药用,为珍稀名贵中药材,其主要基原植物为福建金线莲Anoectochilus roxburghii (Wall.) Lindl. 和台湾金线莲A. formosanus Hayata [1-2]。其中,福建金线莲具备清热凉血、祛风利湿、除湿解毒等功效,具有较高的药用价值[3]。同时由于生长习性独特、野生资源分布较少,再加上人为的过度采挖,造成其野生资源的日益匮乏和市场价格的居高不下。另外,由于形态特征近似,一些同属以及斑叶兰属和血叶兰属的其他种在市场上也称为金线莲,造成了金线莲种源混杂,影响了金线莲的药材品质。
金线莲规范化栽培是保护野生资源、缓解药材短缺的重要举措。筛选出农艺性状好、药效成分高的优良品种是规模化栽培的前提,而品种选育需要对种质资源遗传背景进行深入研究。因此,通过分子标记等技术手段了解种质资源的遗传信息是十分必要的。直接扩增片段长度多态性(direct amplification of length polymorphism,DALP)标记是基于PCR的一种检测DNA多态性的方法,具有信息量大、无需预知DNA序列信息,以及较高重复性和稳定性的优点[4],被用于物种分类、品种鉴定、居群遗传学研究等 [5, 6, 7, 8],是研究植物遗传多样性常用的分子生物学技术。
由于目前关于福建金线莲的研究较多集中在生物学特性[9, 10, 11]、组织培养[12]、化学成分和药理作用等方面[13],与其遗传背景相关的研究较少,因此本研究采用DALP分子标记技术,以不同地理来源14个福建金线莲及4个近似种居群为样本,从分子水平了解野生福建金线莲资源的多样性和遗传差异,为其驯化栽培、保护和利用提供理论参考。 1 材料与仪器 1.1 材料
依据金线莲的地理分布特点,样品分别采集自云南、福建、海南等地(表 1),并由中国医学科学院药用植物研究所云南分所李海涛副研究员鉴定。每份材料选取6棵植株,每棵植株分别取1~2片幼嫩叶片,放于纸袋中,于-20 ℃保存。
| 表 1 试验材料及来源 Table 1 Samples and resources of A. roxburghii |
Eppendorf 5804R台式离心机,Eppendorf BioPhotometer Plus核酸蛋白测定仪,Biometra TProfessional PCR仪,Biorad PowerPacTM基础电泳仪电源,Biorad Sub-Cell® GT Cell电泳槽,UVI FireReader凝胶成像系统,ABI 3730XL DNA分析仪。 2 方法 2.1 总DNA的提取
每份样本分别采集6个单株上的新鲜叶片,叶片经液氮冷冻后研成细粉,用OMEGA E. Z. N. A. SP Plant DNA Kit进行DNA的提取,以50 μL Elution 缓冲液进行洗脱。通过1%琼脂糖电泳检测DNA的完整度,用核酸蛋白测定仪检测DNA的纯度和质量浓度,最后将DNA质量浓度调整为25 ng/μL。 2.2 DALP扩增及检测
参照已有文献中报道的扩增引物[14, 15, 16],筛选出6对引物进行PCR扩增(表 2)。PCR反应体系为20 μL,包括2 μL 10×PCR缓冲液,2 μL DNA模板(25 ng/μL),0.5 μL正/反向引物(1 mmol/L),5 μL dNTPs(1 mmol/L),1 μL DNA聚合酶(0.5 U/μL),灭菌双蒸水9 μL。PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s、52 ℃退火30 s,72 ℃延伸30 s,共36个循环;72 ℃延伸5 min。通过毛细管电泳检测电泳结果,将PCR产物稀释30倍,在96孔板的各孔中分别加入9.05 μL 去离子甲酰胺、0.05 μL Genescan 1 200相对分子质量内标和1 μL稀释后的PCR产物,95 ℃变性5 min,4 ℃静置10 min,3 000 r/min离心1 min,于ABI 3730XL DNA分析仪上进行毛细管电泳。5 kV预电泳2 min,2 kV进样10 s,15 kV电泳40 min,最后用Data Collection软件收集原始数据。
| 表 2 DALP标记分析的引物序列 Table 2DALP primer sequence |
按扩增产物在相对迁移位置的有无,有赋以“1”,无赋以“0”,生成分子数据矩阵,应用POPGENE 1.32软件对18个居群进行遗传参数分析,计算观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性(H)、Shannon信息指数(I)、遗传距离与遗传一致度等参数。
使用NTSYS 2.1软件对Nei’s遗传距离进行非加权配对算术平均法(UPGMA)聚类分析,构建各居群之间亲缘关系聚类图。 3 结果与分析 3.1 不同引物检测的位点数和多态性
筛选6对能产生清晰、稳定谱带的引物对全部108个样本进行扩增,共检测到355个位点,多态性比率为100%,片段大小在100~1 200 bp。其中14个福建金线莲居群的多态性位点为340个,多态性比率为95.77%。6对引物检测的位点从43到67个不等,平均每对引物能检测到59.2个位点。 3.2 遗传距离
根据扩增位点信息计算得出,18个居群样本的遗传距离介于0.024 3~0.146 2,18个居群中,种上水平遗传距离最大的是A4和A13,为0.146 2;遗传距离最小的是A14和A16,为0.054 8。种内遗传距离最大的是A2和A13,为0.094 1,遗传距离平均值最小的是A9和A10,为0.024 3,种内遗传距离平均值为0.059 0(表 3)。
| 表 3 18份样本的DALP标记扩增结果 Table 3 DALP amplification results of 18 populations |
14个福建金线莲居群间基因分化系数(Gst)值为0.423 0,表明有42.30%的遗传分化存在于不同福建金线莲居群之间,有57.70%的遗传分化存在于居群内;居群每代基因流(Nm)为0.681 9,表明不同福建金线莲居群之间存在的基因流较小。这说明不同产地金线莲居群之间存在较大的遗传分化,而且各居群间基因流动性较小。其中Na介于1.191 5~1.374 6,平均1.273 4;Ne介于1.047 2~1.111 8,平均1.074 4;H介于0.036 7~0.082 2,平均0.056 2;I介于0.064 5~0.139 3,平均0.096 9(表 4)。结果显示不同地理来源福建金线莲居群内的遗传多样性水平较低。
| 表 4 18份样本的遗传多样性指数 Table 4 Genetic diversity indexes of 18 populations |
UPMGA聚类分析可以看出(图 1),以遗传相似性系数0.08为界,可以将18份样本划分为2个部分:第1部分为福建金线莲,包括居群A2、A3、A5~A15、A18,共计14份,根据聚类结果可将其划分为3类,第1类包括福建永安居群A3、云南蒙自居群A8~A10、云南屏边居群A11、A13、A14、云南文山居群A12、A15,越南河江居群A18,其中亲缘关系较近的居群为云南蒙自居群A8~A10和云南屏边居群A11,云南文山居群A12和云南屏边居群A13,云南屏边居群A14、云南文山居群A15和越南河江居群A18;第2类包括云南景洪居群A2,云南金平居群A6、A7;第3类为云南金平居群A5。从采集样本的分布区域来看,第1类福建金线莲来源较广,包括福建永安,云南蒙自、屏边、文山,越南河江;第2、3类福建金线莲来源仅限于云南景洪和金平。第2部分为福建金线莲近似种,包括云南文山居群A1、海南海口居群A4、福建永安居群A16和云南保山居群A17,其中同属的A1和A16与福建金线莲的亲缘关系较近,非同属的A4和A17与福建金线莲亲缘关系较远。
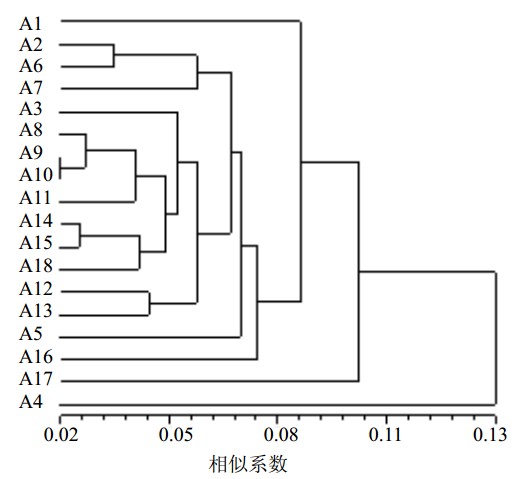 | 图 1 基于DALP标记18份样本的UPMGA聚类图 Fig. 1 DALP cluster analysis of 18 populations by UPMGA |
居群的遗传多样性丰富程度与其进化历程相关,是其适应环境和生存能力的体现。对遗传多样性的研究可以揭示居群的进化历程,为进一步分析其进化潜力和前景提供重要的资料,从而有助于探讨物种濒危的原因及过程。
从物种水平上看,14个福建金线莲居群总的多态位点百分率(PPB)为95.77%,多态性较高,但是从居群水平上看,各居群的PPB介于22.54%~40.28%,多态性较低。福建金线莲居群间Gst值为0.423 0,即居群间的遗传变异为57.70%,居群内的遗传变异为42.30%,说明福建金线莲的变异主要存在于居群间,而居群内的遗传分化相对较小。Nm值为0.681 9,说明居群间基因流较小,这种情况会加大居群之间的遗传分化。由于一方面福建金线莲多分布于海拔300~600 m的中低丘陵区,生长于气候凉爽、腐殖质丰富、水湿条件良好,荫蔽度60%~80%、空气相对湿度85%~95%的环境下[17],苛刻的生长条件造成福建金线莲居群在地理上呈不连续分布;另一方面,虽然福建金线莲在中国南方地区分布广泛,然而不少分布地区由于生境破坏、过度采挖等情况,造成金线莲的分布范围日益狭窄化、片段化。因此,由上两方面产生的选择压力可能是导致居群分化的主要因素。
由于野生福建金线莲资源短缺、价格较高,药材市场常出现以次充好的现象。另外,即使是相同的物种,由于分布地区、气候条件、栽培方式等因素不同,不同产地的福建金线莲在化学成分方面也存在一定的差异[18]。因此,对其基原植物的鉴别也是十分必要的。顾慧芬等[19]对金线莲进行了多态性分析,认为随机扩增多态性(RAPD)方法可以区分不同产地的金线莲;吴佳溶[18]采用相关序列扩增多态性(SRAP)技术获得的聚类结果能对福建金线莲和台湾金线莲进行区分。张福生等[20]对鉴定金线莲的ISSR技术进行了优化。DALP的UPGMA聚类结果显示,不同产地的各个金线莲居群之间存在一定的遗传差异,在种上水平差异更为明显。因此,虽然以上几种不同分子标记的原理不同,但其结果均可为金线莲药材分类鉴别研究提供一定的参考。同时DALP是以通用测序引物M13为核心序列的双引物扩增,可扩增得到5’和3’端的序列不同但都含有M13序列的DNA产物。由于本研究中PCR产物长度可达到1 200 bp左右,对于一些存在长度差异的序列可以省去克隆步骤直接通过M13引物进行扩增测序而进一步获得其序列信息。
福建金线莲作为珍稀濒危植物已经被列入《野生动植物濒危物种国际贸易公约》的保护范围,生境变迁和过度采收等因素使得其居群的个体数量锐减,这很可能导致其遗传多样性降低,从而削弱其长期生存和适应环境的能力。保护野生资源、推广人工栽培是福建金线莲可持续利用的必经之路。目前已有不少公司和个人对福建金线莲进行收购和种植,这对缓解野生资源的紧缺起到一定的积极作用。然而,对于栽培的福建金线莲药材尚缺乏相关的质量标准,而且产地、种源、栽培方式等因素都可能对福建金线莲药材的品质产生影响,因此了解种质资源遗传背景信息,有目的地进行杂交组合及对其杂交后代的选择,培育优良品种,规范化种植,是维系福建金线莲这一珍稀药材合理利用的重要举措。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志(第17卷) [M]. 北京: 科学出版社, 1999. |
| [2] | 江苏省植物研究所. 新华本草纲要 [M]. 上海: 上海科学技术出版社, 1990. |
| [3] | 侯宽昭. 中国种子植物科属词典 [M]. 北京: 科学出版社, 1998. |
| [4] | Desmarais E, Lanneluc I, Lagnel J. Direct amplification of length polymorphisms (DALP) or how to get and characterize new genetic markers in many species [J]. Nucleic Acids Res, 1998, 26(6): 1458-1465. |
| [5] | Wang R J, Wang Y F, Lei G C, et al. Genetic differentiation with in metapopulations of Euphydryas aurinia and Melitaea phoebe in China [J]. Biochem Gene, 2003, 41(3/4): 107-118. |
| [6] | Marie J, Perrot M, Jacques L, et al. Tracking paternal genes with DALP markers in a pseudoarrhenotokous reproductive system: biparental transmission but haplodiploid-like inheritance in the mite Neoseiulus californicus [J]. Heredity, 2001, 84: 702. |
| [7] | Wai Y H, Forrest Chung F Y, Paul P H B, et al. Direct amplification of length polymorphism analysis differentiates Panax ginseng from P. quinquefolius [J]. Planta Med, 2001, 67: 587. |
| [8] | 夏惠茵, 游仲辉, 王骏, 等. 直接扩增长度多态性技术在人参与西洋参鉴定中的应用 [A] // 劭鹏柱, 曹晖. 中药分子鉴定 [M]. 上海: 复旦大学出版社, 2004. |
| [9] | 吴海清, 龚祝南. 金线莲和银线莲的比较解剖学研究 [J]. 江苏农学院学报, 1996, 17(3): 25-29. |
| [10] | 张振珏, 陈裕, 林坤瑞, 等. 花叶开唇兰营养体的结构 [J]. 云南植物研究, 1992, 14(1): 45-48. |
| [11] | 唐菲, 张小琼, 徐江涛, 等. 金线莲降血糖活性部位的筛选 [J]. 中草药, 2011, 42(2): 340-342. |
| [12] | 张铁. 金线莲组织培养研究进展 [J]. 文山学院学报, 2013, 26(6): 11-13. |
| [13] | 张红艳, 潘馨. 金线莲化学成分及药理活性研究进展 [J]. 海峡药学, 2009, 21(1): 82-84. |
| [14] | 王琼, 程舟, 张陆, 等. 野山人参和栽培人参的DALP指纹图谱 [J]. 复旦学报: 自然科学版, 2004, 43(6): 1030-1034. |
| [15] | 王海英, 虞泓, 李南高, 等. 云南丽江山慈菇遗传多样性的DALP分析 [J]. 云南植物研究, 2005, 27(2): 156-162. |
| [16] | 吴刚, 虞泓, 崔光芬. 云南桃儿七遗传多样性的DALP分析 [J]. 中草药, 2009, 40(6): 951-955. |
| [17] | 许文江, 陈裕, 林坤瑞. 药用野生金线莲植物资源的研究 [J]. 福建热作科技, 2000, 25(4): 9-10. |
| [18] | 吴佳溶. 不同地理种源金线莲有效成分含量测定及SRAP标记 [D]. 福州: 福建农林大学, 2012. |
| [19] | 顾慧芬, 庄意丽, 梅其春. 野生与组培金线莲有效成分的比较及RAPD分析 [J]. 中成药, 2011, 33(8): 1364-1367. |
| [20] | 张福生, 郭顺星. 金线莲ISSR反应体系的建立与优化[J]. 中草药, 2011, 42(1): 137-142. |
 2014, Vol. 45
2014, Vol. 45


