肿瘤细胞多药耐药(multidrug resistance,MDR)是人类癌症化疗失败的主要原因之一,是指肿瘤细胞在接触一种化疗药物后,不仅对这种药物具有耐药性,同时对其他结构及作用机制不同的化疗药物也产生交叉耐药的现象。目前认为产生MDR的机制主要有:转运蛋白过度表达[1, 2, 3]、多药耐药相关酶表达异常[4, 5]、DNA损伤修复能力异常、控制细胞凋亡的相关基因异常等。从番荔枝科植物番荔枝中分离得到的番荔枝内酯是一类含35~37个碳原子的长链化合物,其末端含有一个甲基取代的或经重排的α,β-不饱和γ-内酯环,分子中有0~3个四氢呋喃环。此外,碳链上有多种类型的取代基,如羟基、乙酰基等。这些化合物中通常含有多个手性碳,因此立体化学结构复杂[6, 7, 8, 9]。已有文献报道,番荔枝内酯化合物能够抑制耐药肿瘤细胞的生长[10]。其机制可能与抑制线粒体呼吸链传递,使细胞产生的能量受阻[11, 12],诱导肿瘤细胞凋亡[13],从而杀死肿瘤细胞有关。
番荔枝内酯类化合物结构复杂,其结构与抑制耐药肿瘤细胞活性之间的关系值得深入研究。本实验选用分离得到的15个番荔枝内酯类化合物,主要考察结构中四氢呋喃环与γ-内酯环两环间的碳数、羟基个数、四氢呋喃环的相对构型及绝对构型与抑制耐阿霉素乳腺癌MCF-7/ADR细胞生长活性的相关性,以期为临床治疗找到一种高活性抗多药耐药性肿瘤的化合物结构模型。 1 材料
15个番荔枝内酯化合物:annotemoyin-1(1)、annosquamin B(2)、annosquamin A(3)、annosquamin C(4)、annosquacin C(5)、urarigrandin A(6)、isodesacetyluvaricin(7)、annosquacin D(8)、annosquacin B(9)、12,15-cis-squamostatin-A(10)、squamostatin-A(11)、squamostanin-B(12)、squamostanin-A(13)、squamostatin-D(14)、squamostatin-E(15)(表 1、图 1)均为本实验室前期分离得到,经HPLC-DAD检测,质量分数均>98%。盐酸维拉帕米注射液,批号121101,上海禾丰制药有限公司;顺铂,批号2WA2A1307047B,齐鲁制药有限公司;阿霉素,批号130707,浙江海正药业股份有限公司。MCF-7/ADR细胞购自中国药科大学。RPMI 1640培养基,Gibco;胎牛血清,浙江天杭生物科技有限公司;胰蛋白酶,Biosharp公司;青链霉素混合液(100 X)、磷酸盐缓冲液(PBS)、MTT、EDTA,均购自北京索来宝科技有限公司;二甲基亚砜(DMSO),分析纯,无锡海硕生物有限公司。酶标仪,BIO-RAD。
| 表 1 化合物1~15的结构特征 Table 1 Structure characteristics of compounds 1—15 |
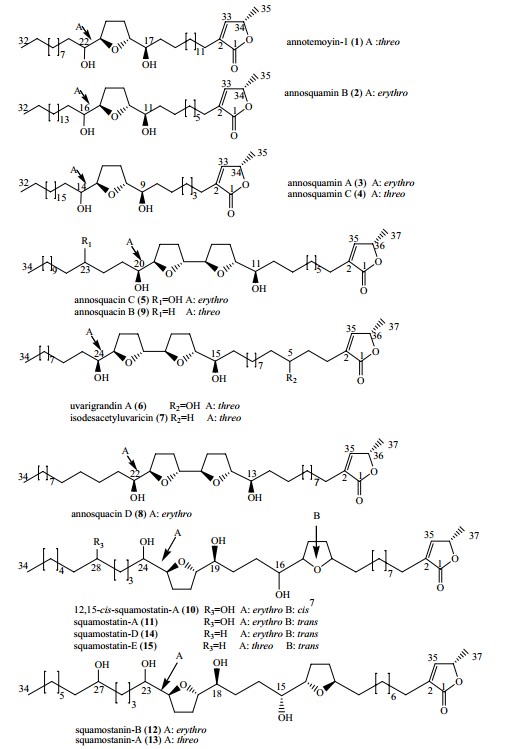 | 图 1 化合物1~15结构 Fig. 1 Structures of compounds 1—15 |
MCF-7/ADR细胞株在含5 μg/mL阿霉素、10%胎牛血清及1%青链霉素混合液的RPMI 1640培养基中培养1周,再换成不含阿霉素的培养液培养2周后开始实验。细胞置于CO2培养箱中,在37 ℃和5% CO2条件下培养。 2.2 MTT实验
取对数生长期细胞,确定活细胞数大于90%。用RPMI 1640培养液调整细胞浓度为5×104/mL接种于96孔板,200 μL/孔,每孔细胞数约为1×104个。将细胞分为阴性对照组(细胞用培养基)、溶媒对照组(细胞用含0.1% DMSO的培养基处理)、给药组(细胞用50、25、12.5、6.25、3.125、1.562 5、0.781 25、0.390 625 μmol/L浓度梯度的药物处理)。培养24 h后,将上清液吸出,给药组加入200 μL含各浓度梯度的番荔枝内酯化合物的培养基,DMSO体积分数<0.1%。然后将96孔板置于37 ℃、5% CO2饱和湿度培养箱中培养48 h。随后每孔加入5 mg/mL MTT试剂20 μL,继续培养4 h。然后轻轻吸出96孔板中培养液,加入DMSO,150 μL/孔。震荡摇匀10 min,使结晶物充分溶解,并在490 nm波长处用酶标仪测定各孔吸光度(A)值。实验中采用顺铂和维拉帕米作为阳性对照。采用直线回归法计算药物对MCF-7/ADM细胞的半数抑制浓度(IC50)。实验重复3次。
细胞抑制率=1-实验孔A值 / 对照组A值 3 结果 3.1 对耐药细胞的抑制活性
化合物1~15对MCF-7/ADR细胞均有较强的抑制作用,其中化合物1的活性最强,对MCF-7/ADR细胞的IC50达到维拉帕米的190倍之多,达到顺铂的270倍之多,见表 2。
| 表 2 化合物1~15对MCF-7/ADR细胞的IC50 Table 2 IC50 values of compounds 1—15 |
根据15个受试化合物对耐药细胞的IC50值,结构相似的化合物进行对比分析。 3.2.1 四氢呋喃环与内酯环间的碳数对化合物活性的影响
由表 2可见,单四氢呋喃型番荔枝内酯化合物中,化合物1(两环间碳数为15个)的活性约为化合物4(两环间碳数为7个)的23倍,此外,化合物2(两环间碳数为9个)的活性也达到化合物3(两环间碳数为7个)的13倍。在邻双和间双型番荔枝内酯类化合物中,化合物8(两环间碳数为11个)的活性比化合物9(两环间碳数为9个)强,化合物11(两环间碳数为9个)的活性比化合物12(两环间碳数为8个)强。由此推测,该类化合物结构中,四氢呋喃环与内酯环间碳数越多活性越强。 3.2.2 取代羟基个数对化合物活性的影响
在邻双型番荔枝内酯类化合物中,化合物5和6(有3个羟基)的活性强于化合物9和7(有2个羟基)。此外,在间双型番荔枝内酯类化合物中,化合物11(有4个羟基)的活性约是化合物14(有3个羟基)的2倍。有文献报道[14],链上含有3个羟基的番荔枝内酯化合物的活性最强,但本实验发现,这并不绝对,至少在间双型番荔枝内酯类化合物中,含有4个羟基的番荔枝内酯化合物比含有3个羟基的番荔枝内酯化合物活性强。由此推测,链上含有的羟基个数越多,化合物活性可能越强。 3.2.3 四氢呋喃环构型对化合物活性的影响
四氢呋喃环的构型对化合物的活性也有较大的影响。由表 2可以发现,化合物3和4仅在四氢呋喃环的构型上略有不同,而化合物3(构型为threo/ trans/erythro,即苏式/反式/赤式)的活性比化合物4(构型为threo/trans/thero,即苏式/反式/苏式)的活性略强,此外在间双型番荔枝内酯类化合物中,化合物14和12的活性分别比化合物15和13的活性要强。前者的构型均为trans/threo-threo/ trans/erythro,即反式/苏式-苏式/反式/赤式,而后者的构型均为trans/threo-threo/trans/threo,即反式/苏式-苏式/反式/苏式。由此推测,具有赤式构型的番荔枝内酯化合物抑制耐药细胞生长活性比具有苏式构型的番荔枝内酯化合物活性强。此外,化合物10(构型为cis/threo-threo/trans/erythro,即顺式/苏式-苏式/反式/赤式)的抑制活性比化合物11(构型为trans/threo-threo/trans/erythro,即反式/苏式-苏式/反式/赤式)强,由此推测,四氢呋喃环为顺式构型的番荔枝内酯类化合物对耐药细胞的抑制活性比反式的强。 4 讨论
通过以上分析,番荔枝内酯类化合物对MCF-7/ADR细胞的抑制活性的影响可以总结如下:(1)所有受试的化合物均表现出比阳性药维拉帕米和顺铂更强的抑制活性;(2)四氢呋喃环与内酯环间的碳数越多,抑制活性越强;(3)链上取代羟基越多,抑制活性越强;(4)具有赤式构型和顺式构型的番荔枝内酯化合物比具有苏式构型和反式构型的番荔枝内酯化合物活性强;(5)相对分子质量为622、链上含有3个取代羟基、构型为赤式的邻双型番荔枝内酯活性显著。这为合成更为有效的番荔枝内酯化合物模型提供了理论基础。
由本实验结果推测,对耐药细胞抑制活性的影响因素主要包括四氢呋喃环与内酯环间的碳数、取代羟基个数、四氢呋喃环构型等方面。然而,这些因素并非单独作用,而是相互影响,综合作用。各因素的影响力度也不一样,这可能与各因素导致番荔枝内酯化合物与受体的结合程度不同有关。
本实验在细胞水平对各种类型的番荔枝内酯化合物抑制耐药细胞生长活性进行了较为系统的研究,已有研究报道番荔枝内酯化合物如asimicin的作用靶点为线粒体复合酶I的ND2亚基[15],因此,番荔枝内酯类化合物与线粒体复合酶I上的ND2亚基表达之间的构效关系仍然需要进行进一步的研究。
| [1] | Borst P, Evers R, Kool M, et al. A family of drug transporters: the multidrug resistance-associated proteins [J]. J Nat Cancer Inst, 2000, 92(16): 1295-1302. |
| [2] | Takara K, Sakaeda T, Okumura K. An update on overcoming MDR1-mediated multidrug resistance in cancer chemotherapy [J]. Curr Pharm Des, 2006, 12(3): 273-286. |
| [3] | 张慧, 符立梧. 多药耐药相关蛋白及其在肿瘤耐药中的作用 [J]. 药学学报, 2011, 46(5): 479-486. |
| [4] | Jensen P B, Sorensen B S, Sehested M, et al. Different modes of anthracycline interaction with topoisomerase II: Separate structures critical for DNA-cleavage, and for overcoming topoisomerase II-related drug resistance [J]. Biochem Pharmacol, 1993, 45(10): 2025-2035. |
| [5] | Holden J A. DNA topoisomerases as anticancer drug targets: from the laboratory to the clinic [J]. Curr Med Chem Anti-cancer Agents, 2001, 1(1): 1-25. |
| [6] | Chen Y, Yu D Q. Classification and NMR characteristics of the γ-lactone and THF rings of antitumor bioactive annonaceous acetogenins [J]. Acta Pharm Sin, 1998, 33: 553-560. |
| [7] | 潘锡平, 于德泉. 大花紫玉盘中的新抗肿瘤活性番荔枝内酯及其绝对构型研究 [J]. 药学学报, 1997, 32(4): 286-293. |
| [8] | 孙兰, 朱久香, 余竞光, 等. 圆滑番荔枝种子化学成分研究 [J]. 药学学报, 2003, 38(1): 32-36. |
| [9] | 陈文森, 姚祝军, 吴毓林. 牛心果化学成分的研究 [J]. 有机化学, 1995, 15(1): 85-88. |
| [10] | Bermejo A, Figadere B, Zafra-Polo M C, et al. Acetogenins from Annonaceae: recent progress in isolation, synthesis and mechanisms of action [J]. Nat Prod Rep, 2005, 22: 269-303. |
| [11] | Morre D J, Cabo R, Farley C, et al. Mode of action of bullatacin, a potent antitumor acegotenin: inhibition of NADH oxidase activity of Hela and HL-60, but not liver, plasma membranes [J]. Life sci, 1995, 56: 343-348. |
| [12] | 程春旭, 高颜茹. 抗肿瘤药物作用机制的研究进展 [J]. 吉林医学, 2009, 30(23): 3080-3083. |
| [13] | Chiu H F, Chih T T, Hsian Y M, et al. Bullatacin, a potent antitumor Annonaceous acetogenin, induces apoptosis through a reduction of intracellular c AMP and c GMP levels in human hepatoma 2. 2. 15 cells [J]. Biochem Pharmacol, 2003, 65(5): 319-327. |
| [14] | Oberlies N H, Chang C, Mclaughlin J L. Structure-activity relationships of diverse annonaceous acetogenins against multidrug resistant human mammary adenocarcinoma (MCF-7/Adr) cells [J]. J Med Chem, 1997, 40: 2102-2106. |
| [15] | Nakamaru-Ogiso E, Han H, Matsuno-Yagi A, et al. The ND2 subunit is labeled by a photoaffinity analogue of asimicin, a potent complex I inhibitor [J]. FEBS Lett, 2010, 584(5): 883-888 |
 2014, Vol. 45
2014, Vol. 45


