玫瑰花Rosae Rugosae Flos为蔷薇科植物玫瑰Rosa rugosa Thunb. 的干燥花蕾[1],主要含有挥发油、黄酮、鞣质、脂肪油、氨基酸等化学成分[2],具有行气活血、和气、止痛的功效。现代药理研究表明玫瑰花有着广泛的药理作用:玫瑰花水煎液有很好的抗氧化活性和自由基清除能力;对金黄色葡萄球菌、结核杆菌及伤寒杆菌均有明显的抑制作用;对白血病病毒、人类免疫缺陷病毒等均有抗病毒作用;还可减轻由冠状动脉结扎导致的心肌缺血程度,有很好的扩张血管作用[3, 4, 5]。
炎症是机体对各种致炎因素引起的局部损伤所产生的具有防御意义的应答性反应,是十分常见而又非常重要的基本病理过程,可以发生于机体的任何部位和任何组织,人类的大多数疾病都与炎症过程有关[6]。核转录因子-κB(NF-κB)是一个十分重要的转录因子,在炎症、免疫及细胞增殖、存活和凋亡等许多生物过程中起着非常重要的作用,可调控如肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)、IL-6、IL-8和嗜酸细胞激活趋化因子等大量细胞因子、趋化因子和黏附分子的合成过程[7]。传统的中药活性成分筛选方法需要提取、分离、纯化等过程,并需要使用药理模型来进行筛选及验证,消耗大量时间和样品。因此建立快速有效的中药抗炎活性成分筛选方法显得非常重要[8]。
本实验复制了由铜绿假单胞菌引起的小鼠急性肺部感染模型[9],考察玫瑰花水提物对铜绿假单胞菌的抑制作用,并建立了一种快速高效的基于超高效液相色谱-四级杆/飞行时间质谱(UPLC-Q/ TOF)结合NF-κB荧光素酶报告基因检测系统筛选玫瑰花抗炎活性成分的方法,探究玫瑰花的抗炎作用药效物质基础,并为其进一步的抗炎机制研究提供参考。 1 材料 1.1 仪器
超高效液相色谱仪串联四极杆/飞行时间质谱(Waters ACQUITYTM UPLC-Q/TOF Premier);超纯水仪Milli-Q(美国MILLIPORE公司);680型酶标仪(美国Bio-Rad公司)。 1.2 试剂
细胞培养试剂(美国GibcoBRL);头孢拉定(海南海力制药有限公司,批号111102);TNF-α(美国PeproTech);pGL4.32(美国Promega);脂质体2000转染试剂(美国Invitrogen);地塞米松(美国Sigma);TNF-α、IL-6、IL-8酶联免疫试剂盒(美国Pierce/Endogen);乙腈、甲醇(色谱纯,美国Fisher);甲酸(色谱纯,比利时Acros);亮氨酸-脑啡肽醋酸盐(美国Sigma-Aldrich公司);超纯水由Milli-Q制备;其他所用试剂均为分析纯。 1.3 试药
玫瑰花购于河北省安国市长安中药材有限公司,批号70067800-7,经天津药物研究院张铁军研究员鉴定为玫瑰Rosa rugosa Thunb. 的干燥花蕾,标本现存于南开大学药学院复方药物与系统生物学实验室。 1.4 动物、细胞及菌株
ICR小鼠(雄性,体质量18~22 g)购自中国食品药品检定研究院,许可证号SCXK-(军)2007-004XC。人胚肾细胞(HEK 293)购于上海拜力生物技术有限公司。铜绿假单胞菌是从临床一例支气管扩张患者送检的痰中分离得到的卡那霉素敏感株,经美国全自动微生物分析仪VI TEK IMS60鉴定为铜绿假单胞菌Pseudomonas aeruginosa,培养于Luria-Bertani培养基并用已灭菌的PBS悬浮,取终浓度为1×109 cfu/mL用于动物实验造模。 2 方法 2.1 玫瑰花实验样品的制备 2.1.1 动物实验样品制备
称取80 g玫瑰花药材于砂锅中加800 mL水浸泡2 h后开火煮沸,再小火继续煮30 min,提取液滤过后旋蒸得浸膏于4 ℃保存,用于动物药效学实验研究。 2.1.2 细胞实验样品制备
玫瑰花粉末加入10倍量的水超声30 min,依次加入石油醚、二氯甲烷、醋酸乙酯和水饱和正丁醇分别以2倍体积量萃取2次,分别得到石油醚、二氯甲烷、醋酸乙酯、正丁醇、水提取部位,将各提取部位依次蒸干,残渣分别溶于含0.1% DMSO的DMEM培养基中,用于细胞实验研究。 2.2 分组、给药及模型制备
小鼠随机分为5组,即对照组、模型组、头孢拉定(50 mg/kg)阳性药组及玫瑰花水提液高、低剂量(3.250、1.625 g/kg)组,每组10只,各组均ig给予对应剂量的药物,对照组及模型组均给予等量生理盐水,连续给药14 d后,除对照组外,其余各组小鼠制备肺炎模型。每只小鼠鼻腔滴入40 μL铜绿假单胞菌(菌数为1×109/mL)建模[9]。造模24 h后取小鼠血浆和肺组织,肺组织固定于4%甲醛溶液中用于HE染色实验。 2.3 炎症因子的测定
ELISA方法测定小鼠血浆中的TNF-α、IL-6及IL-8炎症因子的水平,操作按试剂盒说明书进行。 2.4 玫瑰花样品对NF-κB抑制能力的测定
HEK 293细胞培养于96孔板,细胞融合至50%左右时共转染PGL4.32及内参Renilla质粒,转染24 h后加入玫瑰花不同提取部位(预试验显示玫瑰花水提物0.3 mg/mL为保证细胞存活率在80%的最大给药质量浓度,故各提取部位终质量浓度确定为0.3 mg/mL)或地塞米松(10 μmol/L)孵育6 h,再加入TNF-α(10 ng/mL)刺激6 h后裂解细胞,用双荧光素酶报告基因试剂盒检测各组细胞NF-κB的表达量[10]。数据以相对荧光比值表示:相对荧光比值=NF-κB荧光值/内参Renilla荧光值。 2.5 UPLC色谱条件及样品流分收集
ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm,Waters),流动相为乙腈(A)-0.1%甲酸超纯水(B),梯度洗脱条件:0~3 min,2% A;3~15 min,2%~15% A;15~16 min,15%~95% A;16~20 min,95% A;体积流量0.4 mL/min,柱温35 ℃,进样量2 μL。使用96孔深孔板进行流分收集,按照UPLC分离时间,每隔30 s收集至1个孔。40 ℃减压干燥,残渣用100 μL细胞培养基溶解以进行生物活性分析。 2.6 质谱条件
采用电喷雾离子源(ESI),正、负模式测定。参数:V模式;毛细管电压负模式2.5 kV、正模式3.0 kV;锥孔电压负模式25 V、正模式30 V;离子源温度100 ℃;脱溶剂气温度300 ℃;脱溶剂氮气流量600 L/h;锥孔气流量50 L/h;检测器电压1 800 V;采样频率0.1 s,间隔0.02 s;检测范围m/z 100~1 200;Lockmass采用LEA([M-H]- 553.277 5,[M+H]+ 555.293 1)。 2.7 统计分析方法
采用SPSS 18.0软件进行统计分析,实验数据均以x±s表示,组间比较采用方差分析(One-Way ANOVA)。 3 结果 3.1 对肺炎小鼠的影响 3.1.1 肺组织病理观察结果
小鼠肺组织经HE染色后进行切片观察,结果见图 1。对照组小鼠肺组织结构完整,无炎症表现。与对照组比较,模型组小鼠肺组织呈现大量炎症细胞聚集,炎症细胞以中性粒细胞浸润为主,肺泡壁结构破坏;头孢拉定组和玫瑰花水提液给药组小鼠肺组织炎症状况有明显改善,且玫瑰花水提液高剂量组炎症程度轻于低剂量组。
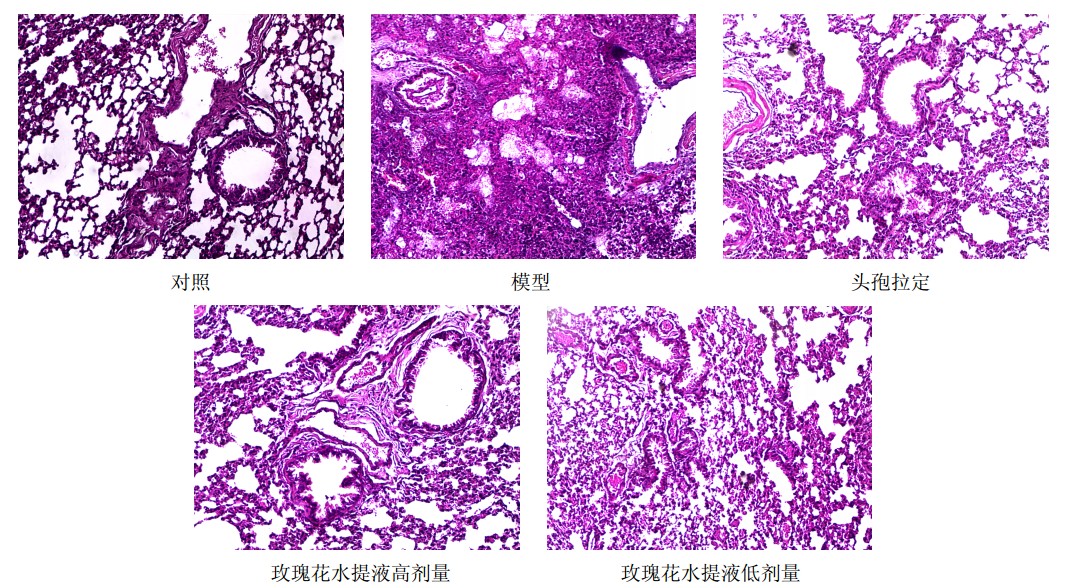 | 图 1 各组小鼠肺组织病理观察结果 Fig. 1 Histopathological observation of lung tissue in mice of each group |
各组小鼠血浆TNF-α、IL-6和IL-8测定结果见图 2。可以看出,头孢拉定组和玫瑰花水提液给药组小鼠血浆中TNF-α、IL-6和IL-8水平均较模型组有明显降低(P<0.001),且玫瑰花水提液高剂量组比低剂量组降低更明显。动物实验结果表明,玫瑰花水提液给药14 d可以预防由铜绿假单胞菌引起的小鼠急性肺部感染。
 |
与对照组比较:###P<0.001;与模型组比较:***P<0.001
###P < 0.001 vs control group; ***P < 0.001 vs model group 图 2 各组小鼠血浆中TNF-α、IL-6和IL-8水平比较(x±s n=6) Fig. 2 Comparison on levels of TNF-α,IL-6,and IL-8 in mice plasma(x±s n=6) |
玫瑰花石油醚、二氯甲烷、醋酸乙酯、水饱和正丁醇和水提取部位对NF-κB的抑制作用见图 3。结果显示,阳性药地塞米松组(10 μmol/L)和玫瑰花水提取部位组(300 μg/mL)的NF-κB表达与模型组相比有明显降低(P<0.01、0.001),说明玫瑰花水提取部位对NF-κB有很好的抑制作用。因此,在筛选玫瑰花抗炎有效成分实验中选取玫瑰花水提取部位进一步研究。
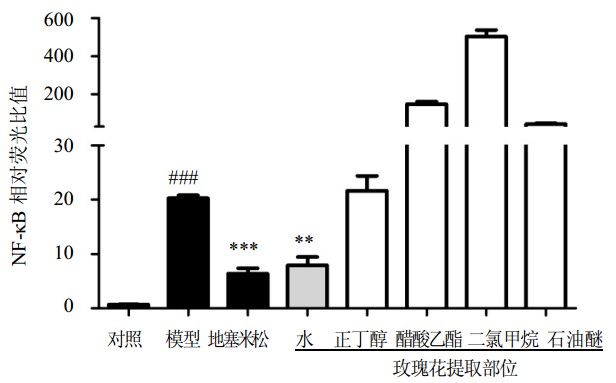 |
与对照组比较:###P<0.001;与模型组比较:**P<0.01 ***P<0.001 ###P < 0.001 vs control group; ***P < 0.001 **P < 0.01 vs model group 图 3 玫瑰花5个不同提取部位对NF-κB抑制作用比较(x±s n=6) Fig. 3 Comparison on effects of five extracts from RRF on NF-κB inhibition(x±s n=6) |
为了筛选出玫瑰花中的抗炎活性成分,对其水提取部位进行UPLC分离,按照保留时间每30 s为1个流分进行收集,分别进行细胞水平的NF-κB抑制实验,比较每个流分对NF-κB的抑制效果。图 4为玫瑰花水提取部位谱效关系图。图中显示了与UPLC保留时间相对应的流分对NF-κB的抑制率,得到抑制率较强的7个色谱峰为抑制NF-κB表达的潜在活性物质。
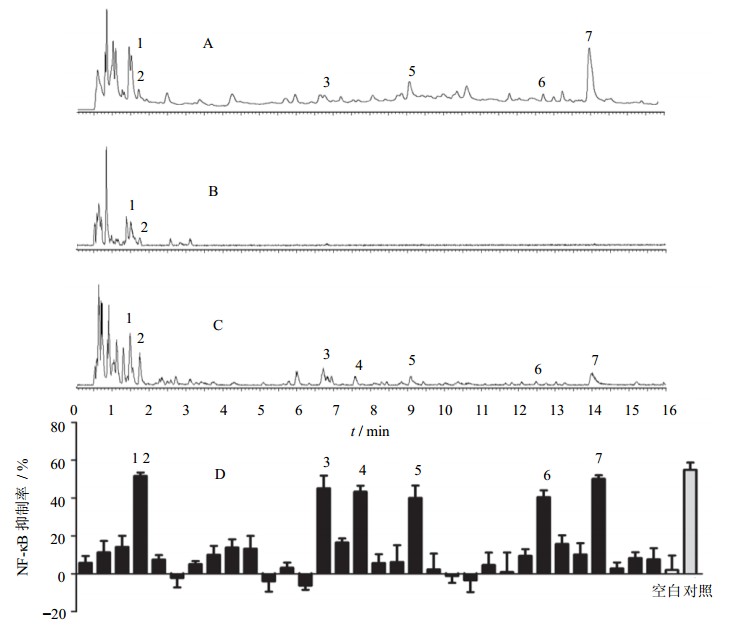 |
A-254 nm紫外吸收谱图 B-正离子模式BPI图 C-负离子模式BPI图 D-NF-κB抑制率 A-UV chromatogram of 254 nm B-BPI chromatogram in positive mode C-BPI chromatogram in negative mode D-The bioactivity chromatogram of NF-κB inhibition 图 4 UPLC-Q/TOF结合荧光素酶报告基因检测系统筛选玫瑰花水提取部位中抑制NF-κB活性的单体成分 Fig. 4 Screening of NF-κB inhibitors in water extract from RRF using UPLC-Q/TOF coupled with luciferase reporter assay system |
为鉴定出玫瑰花中的抗炎活性物质,使用UPLC-Q/TOF对细胞实验所筛选出的几个抗炎活性单体进行二级质谱鉴定。运用小数点后四位的精确质量数进行元素组成分析,选择 [M-H]-和 [M+H]+为母离子进行二级质谱实验。将精确质量数和二级质谱裂解碎片与文献进行对比,并结合物质保留时间对其进行鉴定[11]。得到抗炎活性物质的鉴定结果,分别为没食子酸、4-O-没食子酰基奎宁酸、没食子酸甲酯、矢车菊黄素、小木麻黄素、木麻黄鞣质及并没食子酸,见表 1。
| 表 1 玫瑰花中部分具有生物活性化合物的质谱数据 Table 1 MS/MS data from (+/-) ESI-MS of bioactive compounds in RRF |
玫瑰花在我国有着悠久的应用历史,随着医疗模式的转变和人们保健意识的增强,玫瑰花在心血管疾病治疗、抗衰老及美容保健方面的作用得到人们越来越多的关注,然而针对玫瑰花抗炎、抗菌功效的研究仍比较匮乏。因此,本实验建立了用铜绿假单胞菌感染的小鼠肺部急性感染模型来探究玫瑰花的体内抗菌效果。实验结果表明,玫瑰花水提物可以通过降低TNF-α、IL-6和IL-8的表达来有效预防铜绿假单胞菌引起的肺部感染,对肺组织起到很好的保护作用。
化学物质基础模糊,作用机制不明确仍然是中药现代化进程中亟待解决的问题。近几十年来,HPLC及其他现代分离技术联合活性检测的筛选方法已被应用于中药活性物质筛选,传统的通过分离、纯化结合动物实验来评价活性的筛选方法不但花费高而且耗时长,已逐渐被代替[12, 13]。UPLC与HPLC相比,有着更强的分离能力,更高的分辨率和灵敏度,结合TOF-MS技术在结构信息方面的独特优势,UPLC-Q/TOF近几年来已广泛应用于中药成分的分离鉴定[14]。基于DNA、蛋白质、细胞等高通量筛选的生物系统可以快速检测大量具有潜在生物活性的物质,其中萤火虫荧光素酶基因作为活性检测的报告基因具有信号灵敏、细胞体内合成迅速且不会长时间积累的优点[15]。因此,将UPLC-Q/TOF与NF-κB依赖的双荧光素酶报告基因系统整合,建立了快速有效的筛选NF-κB抑制剂的新方法。本实验中分析鉴定出玫瑰花水层萃取物中7个抗炎活性单体,分别为没食子酸、4-O-没食子酰基奎宁酸、没食子酸甲酯、矢车菊黄素、小木麻黄素、木麻黄鞣质及并没食子酸。
分离、筛选中药中的有效成分不仅能明确药效物质基础,更是阐释作用机制必不可少的条件。本实验对玫瑰花中NF-κB抑制剂的筛选不仅明确了其抗炎药效物质基础,更有助于阐释玫瑰花抗炎的作用靶点及通路,为玫瑰花后续作用机制的研究提供了实验基础。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 李明, 李艳芳, 孙永超. 中药玫瑰花的研究进展 [J]. 卫生职业教育, 2007, 25(8): 146-148. |
| [3] | 周达, 罗成, 鲁晓翔. 玫瑰花总黄酮微波辅助提取及其抗氧化研究 [J]. 食品工业科技, 2010, 31(4): 269-272. |
| [4] | 徐艳, 丰震, 赵兰勇. 玫瑰鲜花抑菌能力的品种差异及动态变化研究 [J]. 北方园艺, 2012(10): 78-81. |
| [5] | Gao X M, Shu L D, Yang L Y, et al. Phenylethanoids from the flowers of Rosa rugosa and their biological activities [J]. Bull Korean Chem Soc, 2013, 34(1): 246-248. |
| [6] | Krishnamoorthy S, Honn K V. Inflammation and disease progression [J]. Cancer Metastasis Rev, 2006, 25(3): 481-491. |
| [7] | Albert S, Baldwin J. The transcription factor NF-κB and human disease [J]. J Clin Invest, 2001, 107(1): 3-6. |
| [8] | Yue G G, Chan B C, Kwok H F, et al. Screening for anti-inflammatory and bronchorelaxant activities of 12 commonly used Chinese herbal medicines [J]. Phytother Res, 2012, 26(6): 915-925. |
| [9] | Bai F, Xu H, Zhang Q, et al. Functional characterization of pfm in protein secretion and lung infection of Pseudomonas aeruginosa [J]. Can J Microbiol, 2011, 57(10): 829-837. |
| [10] | Cheng B F, Hou Y Y, Wang L Q, et al. Dual-bioactivity-based liquid chromatography-coupled quadrupole time-of-flight mass spectrometry for NF-κB inhibitors and β2AR agonists identification in Chinese medicinal preparation Qingfei Xiaoyan Wan [J]. Anal Bioanal Chem, 2012, 404(8): 2445-2452. |
| [11] | Gu D Y, Yang Y, Bakri M, et al. A LC/QTOF-MS/MS application to investigate chemical compositions in a fraction with protein tyrosine phosphatase 1B inhibitory activity from Rosa Rugosa Flowers [J]. Phytochem Anal, 2013, 24(6): 661-670. |
| [12] | Sykora J, Bernásek P, Zarevúcká M, et al. High-performance liquid chromatography with nuclear magnetic resonance detection-A method for quantification of alpha-and gamma-linolenic acids in their mixtures with free fatty acids [J]. J Chromatogr A, 2007, 1139(1): 152-155. |
| [13] | Zeng J, Zhang X, Guo Z, et al. Separation and identification of flavonoids from complex samples using off-line two-dimensional liquid chromatography tandem mass spectrometry [J]. J Chromatogr A, 2012, 1220: 50-56. |
| [14] | Cheng X L, Wei F, Xiao X Y, et al. Identification of five gelatins by ultra performanceliquid chromatography/ time-of-flight mass spectrometry (UPLC/Q-TOF-MS) using principal component analysis [J]. J Pharm Biomed Anal, 2012, 62: 191-195. |
| [15] | McNabb D S, Reed R, Marciniak R A. Dual luciferase assay system for rapid assessment of gene expression in Saccharomyces cerevisiae [J]. Eukaryotic Cell, 2005, 4(9): 1539-1549. |
 2014, Vol. 45
2014, Vol. 45


