《中国植物志》记载,商陆属Phytolacca L. 植物全球有35种,其中中国有4种,分别为商陆Phytolacca acinosa Roxb.、垂序商陆P. americana L.、多蕊商陆P. polyandra Batal. 以及日本商陆P. ajaponica Makino;而其中被《中国药典》2010年版[1]收录作为药用的为商陆和垂序商陆。作为传统中药,商陆具有逐水消肿、通利二便、解毒散结的功效;主治水肿胀满、二便不通,外治痈肿疮毒等。现有研究发现商陆的特征性化学成分为三萜皂苷类,其显著的生理活性已成为研究的热点。现代药理实验发现商陆有显著的利尿、抗菌、抗病毒、抗炎、抗肿瘤活性;临床多用商陆治疗乙型肝炎、银屑病、白带症、血小板减少性紫癜以及乳腺增生等临床疑难病症。但是商陆是有毒中药,因为其毒性,临床使用受到极大限制[2]。近年来商陆的研究有了较多新的成果,为了开发利用商陆这一药用植物资源,本文对商陆的主要化学成分、药理与毒性作用和临床应用情况进行了综述,为商陆的进一步开发利用提供参考。
1 化学成分商陆中分离发现的化合物类型包括三萜皂苷类、黄酮类、酚酸类、甾醇类以及多糖类等,其中对三萜皂苷元与三萜皂苷类成分研究得较为深入。
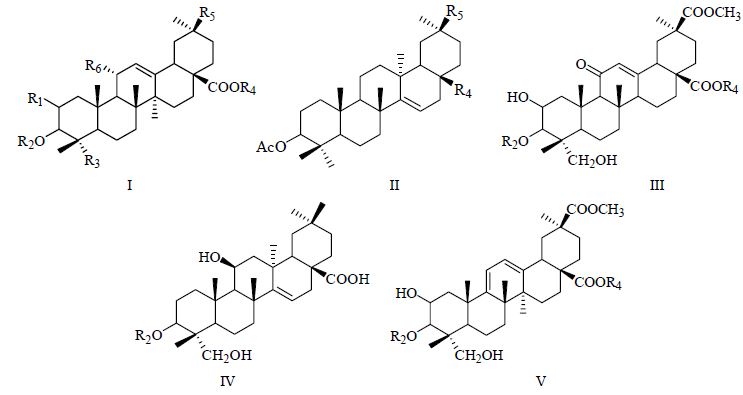
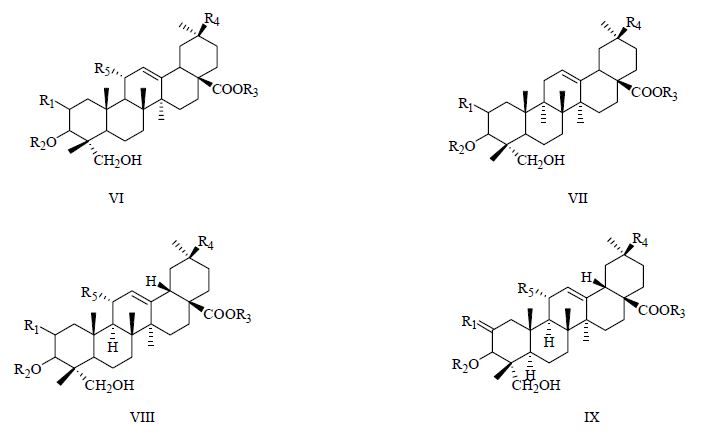
1.1 三萜皂苷类商陆最主要的特征性化学成分为三萜皂苷。20 世纪70年代至今,已从商陆中分离得到21个三萜皂苷元,且均为齐墩果烷型,具体分为5种母核类型:商陆酸、商陆酸30-甲酯、美商陆皂苷元、加利果酸、商陆酸G,结构和名称见图 1及表 1。此外,还有42种三萜皂苷配糖体从商陆中分离得到,结构和名称见图 2及表 2。
|
图 1 三萜皂苷元母核结构 Fig.1 Skeletons of triterpenoid sapogenins |
|
|
表 1 三萜皂苷元类化合物 Table 1 Triterpenoid sapogenins |
|
图 2 三萜皂苷母核结构 Fig.2 三萜皂苷母核结构 |
|
|
表 2 三萜皂苷类化合物 Table 2 Triterpenoid saponins |
商陆中所含的黄酮类成分主要为黄酮醇类和黄酮木脂素类,其中以山柰酚型黄酮醇为主,黄酮类成分结构和名称见图 3及表 3。

|
图 3 黄酮类、酚酸类及甾醇类成分结构 Fig.3 Structures of flavonoids,phenolic acids,and phytosterols |
|
|
表 3 黄酮类、酚酸类、甾醇类及其他类化合物 Table 3 Flavonoids,phenolic acids,phytosterols,and other constituents |
目前商陆的酚酸类成分有对羟基苯甲酸、香草酸、芥子酸、香豆酸、加利果酸、咖啡酸、齐墩果酸、阿魏酸,其结构和名称见图 3及表 3。
1.4 甾醇类目前报道已知的商陆甾醇类成分,分别为β-谷甾醇、β-胡萝卜素、α-菠菜甾醇、麦角甾醇、Δ7-豆甾烯醇,结构和名称见图 3及表 3。
1.5 挥发油与脂溶性成分刘瑞娟等[29]利用水蒸气蒸馏法提取结合GC-MS分析鉴定成分得出24个化合物,其中量最多的是棕榈酸(52.49%)和亚油酸(21.60%),大于2%的6个成分分别为1-甲基环十二烯、7-甲氧基- 2,2,4,8-四甲基三环十一烷、邻苯二甲酸丁基十四烷基酯、正十五酸、十六酸甲酯、7,10-十八碳二烯酸甲酯。易杨华[30]采用GC-MS鉴定了2-乙基-正己醇、2-甲氧基-4-丙烯基苯酚、邻苯二甲酸二丁酯、棕榈酸乙酯、带状网翼藻醇、2-单亚油酸甘油酯、油酸乙酯、棕搁酸8种脂溶性成分。
1.6 其他类另外从商陆中还分离得到了生物碱、有机酸类化合物,以及大分子多糖类[28]及糖蛋白类成分,其中多糖由半乳糖醛酸、半乳糖、阿拉伯糖和鼠李糖组成,平均相对分子质量分别为9 921和3 279;而研究表明商陆糖蛋白是一种具有显著活性的抗病毒剂,而且有很强的抗细菌感染作用。结构和名称见表 3。
2 药理与毒性作用 2.1 对泌尿系统的影响作为峻下逐水类中药,商陆具有显著的利尿作用。研究表明商陆根水提液可使离体蟾蜍肾尿流量增加,毛细血管扩张,血流量增加;但是对狗未见显著的利尿作用,对其血压也无明显影响。
近年来,关于商陆对于肾脏疾病的研究较为深入,发现对于多种类型的肾脏疾病均具有显著作用。庞军等[31]发现商陆水煎液可能通过降低血清中的可溶性白介素2受体(sIL-2R)水平使阿霉素肾病大鼠模型的蛋白排泄量明显减少,血清白蛋白量增高;将商陆水煎剂与原发性肾病综合征(PNS)病人血清共培养后,发现上清液中IL-6、肿瘤坏死因子-α(TNF-α)的量显著降低,说明商陆能够抑制淋巴细胞产生细胞因子,推测其可能对原发性肾病综合征具有治疗作用。
商陆皂苷甲(EsA)对于各类肾病模型有很好的疗效。张亮等[32]发现EsA可使抗-Thy1系膜增生性肾炎模型大鼠的尿蛋白降低,并能抑制系膜细胞增殖及基质增生,其疗效优于地塞米松。鞠佃文等[33]发现EsA给药2周后的Heymann肾炎模型大鼠,尿蛋白量显著降低,但三酰甘油和胆固醇的变化不明显;此外,EsA还能改善免疫复合物沉积,并能抑制细胞因子TNF、IL-1或IL-6的产生。商陆抗病毒蛋白(PAP)能显著改善IgG加速型肾毒血清的生化指标,使血清白蛋白量升高,血清尿素氮、血清总胆固醇、腹腔吞噬细胞及外周白细胞量减少。
2.2 对免疫系统的影响商陆中三萜皂苷、多糖均具有显著的免疫活性。商陆皂苷能诱生干扰素,采用商陆总皂苷和商陆皂苷辛(EH)能诱导人正常脾细胞和扁桃体细胞产生γ-干扰素(IFN-γ)、IL-2及细胞毒素;商陆皂苷辛(EH)还能诱导小鼠处于TNF启动状态,在诱导剂作用下释放TNF。曹颖瑛等[34]发现商陆皂苷辛(EH)在一定浓度范围内能够显著增强刀豆蛋白A(Con A)激活的脾淋巴细胞IL-3、IL-6的活性,以及IL-3 mRNA、IL-6 mRNA的表达。但是当EH浓度更高时,其促进作用不再增加,反而下降。肖振宇等[35]发现EsA能降低自身免疫综合征模型小鼠的高水平的抗dS-DNA抗体及抑制T、B细胞的过度增殖,这提示EsA可能通过抑制自身免疫反应亢进的淋巴细胞功能来参与免疫调节,调整机体内的免疫失衡。
王洪斌等[36]发现商陆多糖PAP-I体外能显著促进小鼠脾淋巴细胞增殖,促进Con A及脂多糖(LPS)诱导的淋巴细胞增殖,同时刺激小鼠脾淋巴细胞产生IL-2及集落刺激因子(CSF);还可激活T淋巴细胞分泌IL-2、IL-3,这可能与其促进腹腔巨噬细胞(MΦ)分泌IL-l有关。在双向混合淋巴细胞培养反应模型中,PAP-I能增强混合淋巴细胞反应,说明PAP-I可能是通过作用于免疫效应细胞达到增强混合淋巴细胞反应的作用。PAP-I还可呈剂量依赖性地促进NC裸鼠脾淋巴细胞增殖,说明PAP-I为非特异的T细胞丝裂原,但PAP-I是否为B细胞丝裂原仍待进一步研究。王洪斌等[37]还发现PAP-I体外显著增强对Con A诱导的小鼠脾细胞DNA多聚酶α的活性,提示PAP-I增强DNA多聚酶α活性水平可能是其促进免疫功能的重要机制之一。王洪斌等[38]证实了商陆多糖-II(PAP-II)体外能显著促进小鼠脾细胞增殖,提示PAP-II具有免疫增强作用,进一步观察PAP-II对Con A、LPS诱导的淋巴细胞增殖的影响,发现PAP-II小剂量可显著促进丝裂原诱导的淋巴细胞增殖,且PAP-II能显著并呈剂量及时间依赖性促进小鼠脾细胞产生CSF,提示PAP-II可能对造血功能有保护作用。
2.3 抗肿瘤作用目前对于商陆抗肿瘤活性的研究主要集中在商陆多糖上。商陆本身无细胞毒活性,但可以通过增强机体的活性细胞及刺激免疫系统产生细胞因子而发挥强大间接细胞毒活性。商陆能增强脾细胞杀伤P815和L929肿瘤细胞活性及IL-2诱导的LAK细胞活性,提高MΦ对MethA的细胞毒活性,延长腹水型小鼠的存活期,显著抑制移植型肿瘤S180;由商陆诱生的含多种淋巴因子的制品对人肺癌细胞株、HeLa细胞、人肝癌细胞株、Jurkat及Malt-4细胞等均有不同的细胞毒作用,而对人的正常细胞(WISH细胞株)无毒性作用[39]。
商陆多糖PEP-I能够显著抑制移植性肿瘤S180生长,促进脾脏增生,提高T淋巴细胞和IL-2的产生能力,使MΦ对S180和L927的细胞毒作用增强。经过PEP-I治疗后的荷S180小鼠的脾细胞对ConA诱导的转化能力显著高于空白组;在LPS的辅助下可呈剂量依赖性地诱生TNF[40]。以上结果说明PEP-I可通过激活MΦ和启动诱生TNF来发挥抗肿瘤作用;通过增强T淋巴细胞功能来抑制移植性肿瘤;其增强MΦ细胞毒作用与IL-l密切相关。王洪斌等[41]研究发现ip PEP-I显著抑制移植性肿瘤S180,其抗肿瘤活性是通过增强机体的免疫活性实现的;而体外对S180细胞并无细胞毒作用。进一步研究发现PEP-I合用环磷酰胺(Cy)组的抗S180效果、IL-2产生能力、外周血白细胞数、骨髓有核细胞数及骨髓细胞对rmGM CSF刺激增殖能力都显著高于Cy组,说明PEP-I不仅具有增强免疫功能作用,而且还有保护造血功能的作用。
商陆对肿瘤细胞表面免疫相关分子(如HLA- DR分子)的修饰作用也是其发挥细胞毒作用的途径之一。将商陆抗病毒蛋白(PAP)结合到单克隆抗体上制备成免疫毒素,显示出极强的抗白血病活性,且可通过氯喹来增强PAP免疫毒素杀伤急性成淋巴细胞白血病细胞的能力,能特异而高效地杀伤T细胞及T淋巴细胞白血病细胞CEM,对抗原阴性的SP2/O细胞杀灭作用较弱,说明商陆以及含PAP的免疫毒素对靶癌细胞有高效特异的杀伤作用,而对非靶细胞/正常细胞的杀伤作用很弱[42]。
2.4 抗炎作用对于商陆的抗炎作用,目前的研究主要集中在抗炎活性极强的EsA上。研究发现EsA对乙酸提高小鼠腹腔毛细血管通透性,二甲苯引起的小鼠耳壳肿胀、小鼠足跖肿胀和棉球肉芽肿均具有显著地抑制作用;且对摘除肾上腺的大鼠仍有明显的效果[43]。郑钦岳等[44]发现EsA剂量依赖性抑制LPS刺激的人外周血单核细胞上清中TNF浓度下降,使TNF产生的动力学过程亦发生改变;且能抑制兔滑膜细胞产生IL-1和TNF;说明抑制TNF和IL-1产生可能是EsA抗炎作用的重要机制。邓俐等[45]发现EsA能显著抑制钙离子载体卡西霉素(A23187)刺激大鼠腹腔巨噬细胞释放PAF,且其抑制作用随剂量和时间的增加而增大,表明ESA可通过抑制巨噬细胞释放血小板活化因子(PAF)发挥抗炎作用。肖振宇等[46]发现在LPS刺激下,EsA能够抑制中性粒细胞和内皮细胞黏附水平的升高,显著降低LPS诱导的HUVEC304细胞黏附分子ICAM-1 mRNA及中性粒细胞CD18 mRNA的表达水平,说明EsA的抗炎作用可能与影响白细胞与内皮细胞间的黏附有关。
2.5 抗病毒作用PAP为商陆抗病毒的主要活性成分,具有广谱的抗病毒活性,既能够抑制植物病毒,也能抑制动物病毒;PAP作用机制主要表现为核糖体失活作用[47]。PAP能抗黄瓜花叶病毒(CMV)、烟草花叶病毒(TMV)、首箱花叶病毒(AMV)、马铃薯X病毒(PVX)、马铃薯Y病毒(PVY)、花椰菜花叶病毒(CaMV)、非洲木薯花叶病毒(ACMV)和芜花叶病毒(TuMV)等植物病毒;也可抑制脊髓灰质炎病毒、流感病毒、I型单纯疱疹病毒、淋巴细胞性脑络丛脑膜炎病毒的复制[48]。
目前有研究利用PAP的细胞毒特性,将其结合在单克隆抗体上,以CD4+细胞为靶细胞,可抑制人免疫缺陷病毒(HIV-1),在CD4+T细胞中的复制可使其抗病毒能力提高1 000倍,且治疗剂量的PAP则对细胞无毒性作用[49]。潘延凤等[50]发现PAP家族中核糖体失活活性最强的PAP-S可在乙肝病毒(HBV)DNA、乙肝病毒e抗原(HBeAg)、乙肝病毒表面抗原(HBsAg)水平上抑制HepG212115细胞中的HBV,且这种抑制作用呈时间、剂量依赖性,质量浓度>1 μg/mL的PAP体外表现出较强的抑制HBV作用,其作用靶点可能在HBV结构蛋白的表达水平上。贺永文等[51]发现PAP-S通过抑制HBV DNA多聚酶及乙肝病毒X蛋白(HBxAg)的翻译,间接地抑制了HBV的复制。PAP对于正常细胞影响不大,但对感染细胞表现了较强的抑制力。动物实验表明,在有效治疗范围内小鼠表现了较好的耐受性,而活性最强的PAP-S抗HIV能力与齐多夫定相当。
2.6 抗菌作用赵国栋等[52]发现不同极性、不同部位的商陆提取物对大肠杆菌、金黄色葡萄球菌、巨大芽孢杆菌、副溶血弧菌的抑菌活性各有差异。使用商陆1∶4浸液配制成30%培养基,对许兰氏黄癣菌、奥杜盎氏小芽胞癣菌有抑制作用;而商陆煎剂及酊剂对流感杆菌、肺炎双球菌(部分菌株)和奈瑟菌有一定抑制作用,且煎剂效果优于酊剂。此外,商陆对木霉、立枯丝核菌、棉枯萎镰刀菌、圆锥羊肚菌等多种真菌的生长也有抑制作用。
2.7 对胃肠功能的影响关于商陆对胃肠道功能影响的研究并不多见,但调查显示,湖南民间用商陆治疗胃溃疡效果较好。实验发现,商陆总皂苷对大鼠幽门结扎型、醋酸型和小鼠利血平型溃疡具有一定的防治作用,推测其抗溃疡作用可能与促进病灶血液循环、组织修复、抑制胃液分泌等有关,但是其确切机制有待进一步研究[53]。
2.8 其他作用Funayana发现给大鼠iv商陆52%乙醇提取物可产生明显的降压作用,在提取物通过离子交换色谱后,这种作用并不减少,并证明了γ-氨基丁酸和组胺为商陆的降压活性成分[54]。王一飞[55]通过抑精实验,由精子复活实验和精子形态学观察结果发现,4、2.6 g/L商陆总皂苷均可抑制兔精液中全部精子的活性,且有明显的量效关系。
2.9 毒副作用原思通等[56]采用商陆水浸剂、煎剂、酊剂给小鼠ig,其LD50值分别为26.0、28.0、46.5 g/kg,而采用ip其LD50值分别为1.05、1.3、5.3 g/kg,在大剂量时,小鼠出现活动降低、闭眼伏下不动、呼吸变快逐渐变慢变弱,时有全身抽搐现象,中毒死亡多在给药后3 h内。从垂序商陆中得到毒性成分酸性甾体皂苷,小鼠ip的最低致死剂量(MLD)值为0.13 mg/g。而选择PS-E小鼠采用ig、ip、iv给药的LD50分别为1 200、486、43.6 mg/kg。大鼠灌服煎剂5 g/kg,连续3周,浸膏3.6 g/kg,连续30 d,心、肺、肝、肾等脏器均未见异常[2]。李啸红等[57]采用小鼠骨髓嗜多染红细胞微核实验法、小鼠胚胎细胞转移微核实验法研究发现一定剂量的商陆水煎液对小鼠具有潜在的致突变性,且与剂量呈效应关系。此外,不同动物对商陆的敏感性不同,猫与狗则较为敏感。
3 临床应用 3.1 乙型肝炎乙型肝炎并发自身免疫性疾病是乙型肝炎反复活动、病情加重的重要因素。陈继华使用商陆治急慢性肝炎丙氨酸转氨酶(ALT)高者,具有很好的降酶作用,一般用药2周即可收效,随访半年未见复发,除肝区时有刺痛外,其余症状均缓解。如配伍得当并无明显致泻的副作用,只有个别病例药后每天有1~2次软便,但是对兼患心脏病者应慎用[58]。乙肝虽可表现为胁痛、黄疸等不同病症,但其病因病机复杂,为肝郁脾虚、湿热内蕴[59]。商陆有促进和调节机体免疫功能的作用这也许是商陆降酶有效的机制之一。商陆利水消肿,能起到排除毒素和病理产物的作用,有利于消除肝细胞的肿胀,恢复肝细胞的功能,这也许是另一个有效机制[58]。
3.2 银屑病王琪[60]将生商陆切片置于高压蒸锅中蒸2 h后烤干,粉碎成粉,压片备用。成人每日po 9 g,分3次服用,儿童量酌减,可用于治疗寻常型银屑病、关节病型银屑病、砺壳状银屑病、急性点滴状银屑病;对玫瑰糠疹、全身性湿疹等也可应用。
3.3 白带症《全国中草药汇编》上册商陆项下记载:商陆60 g(鲜品120 g)文火炖烂母鸡或猪肉放盐少许,弃渣分2、3次吃汤及肉;主治宫颈糜烂、白带、功能性子宫出血。临床使用该方治疗白带8例,均获良效,仅服用时咽部有轻微刺激感,用量超过9 g也未见中毒[61]。
3.4 血小板减少性紫癜有报道用商陆制成100%煎剂,对21例血小板减少性紫癜患者进行治疗观察,除1例疗效不显著外,其余均在2~4 d内紫癜逐渐消失,鼻衄、牙龈出血好转,有半数病例在服药后第2周左右血小板计数可恢复到正常范围,9例患者经骨髓象复查,6例的巨核细胞已出现有血小板形成,表明对骨髓病变有缓解作用[62]。
3.5 乳腺增生病临床使用商陆治疗乳腺增生病253例,治愈(乳房疼痛消失,肿块消失)94例,占37.15%;显效(乳房疼痛减轻,肿块缩小1/2)72例,占25.46%;好转(乳房疼痛减轻,肿块缩小不及1/2或结节变软)74例,占29.25%;无效(乳房疼痛不减,肿块未见缩小)13例,占5.26%;总有效率为94.86%,疗程最短者1个月,最长者3年,91例治愈患者经随访1年以上无复发,5年以上复发4例(2.55%),253例随访无1例发生癌变。商陆对乳腺增生病有明显的疗效,其疗效明显优于化学药组。服药后患者普遍反应精神好转,食欲增加,原有之肋痛、饱胀、月经不调等均有不同程度的好转。病程短、服药量大者疗效较好,疗程亦短;男性疗效较女性为好[63]。
3.6 其他疾病临床用商陆制成蜜浆或蜜丸治疗慢性气管炎,总有效率89.3%,近控显效率57.03%,用商陆粗总皂苷元治疗慢性气管炎60例,有效率90%,近控显效率78.33%[64]。使用商陆干品5~24 g或鲜品50~100 g,水煎成200 mL,分2次服,治疗消化道出血3例,痔疮出血1例,均在服药2~3剂止血[50]。此外,临床还用商陆制成相关制剂治疗肾性、心源性及肝硬化腹水以及癌症等疾病[52]。
3.7 临床毒性反应临床已有关于服用商陆出现急性中毒报道[65],患者有不同程度交感神经兴奋和胃肠道刺激症状,常见烦躁、乏力、头晕头痛、恶心呕吐、视物模糊、膝反射亢进、精神恍惚、言语不清、心电图显示窦性心动过速。严重者可血压下降、抽搐、昏迷、瞳孔散大、休克、心跳或呼吸停止而死亡。其中毒原因可能为几种因素:有些地区习惯用毒性较大的商陆替代品代替正品商陆使用,使用剂量过大,使用的商陆炮制不当。
4 结语与展望商陆在我国广泛分布,具有悠久的药用历史,也是多个少数民族的常用药物。商陆临床疗效显著,已被开发用于治疗多种疑难病症,且商陆在我国大量栽培,资源丰富,具有良好的开发前景。然而,目前对商陆的研究除三萜皂苷以外其他成分研究很少,药理活性也局限于初提物及个别化合物,有效部位不明晰,作用机制不明确。因此,如何在临床治疗实践以及民间验方的基础上,确切地阐明商陆的活性成分及其作用机制,并将其开发应用于临床是一个亟待解决的问题。此外,商陆为有毒中药,其使用范围与使用价值因其毒性受到极大限制,并且目前为止对商陆的有毒成分及其毒理机制未进行深入系统地研究。因此,在今后的研究工作中,对商陆进行系统深入的化学成分研究,尤其是在活性筛选指导下的活性成分的研究尤为重要;并且在活性成分研究的基础上,进一步阐明商陆的药效物质基础和作用机制,同时建立稳定可靠的质量评价方法。此外,还需明确商陆毒性的物质基础,结合中药炮制、构效关系、结构修饰等研究,达到减毒增效的目的,从而为更好地开发商陆的药用价值,以及为商陆的临床安全及其合理用药提供依据。
| [1] | 国家药典委员会. 中国药典 [S]. 一部. 2010. |
| [2] | 李一飞, 姚广涛. 商陆药理作用及毒性研究进展[J]. 中国实验方剂学杂志, 2011, 17(13): 248-251. |
| [3] | 吴立军. 天然药物化学 [M]. 第4版. 北京: 人民卫生出版社, 2003. |
| [4] | 张巧艳, 郑汉臣, 易杨华. 商陆属植物皂苷类成分及其药理活性[J]. 国外医药: 植物药分册, 2000, 15(3): 105-106. |
| [5] | 刘斤秀. 商陆化学成分和质量分析研究 [D]. 北京: 中国中医科学院中药研究所, 2007. |
| [6] | Spengel S, Schaffner W. A new triterpene from the leaves of Phytolacca acinosa[J]. Planta Med, 1990, 56(3): 284-286. |
| [7] | 易杨华, 王著禄. 商陆有效成分的研究-I三萜皂苷的分离与鉴定[J]. 中草药, 1984, 15(2): 7-11. |
| [8] | Yi Y H. A triterpenoid and its saponin from Phytolacca esculenta[J]. Phytochemistry, 1991, 30(12): 4179-4181. |
| [9] | Yi Y H. Two new saponins from the roots of Phytolacca esculenta[J]. Planta Med, 1992, 58(1): 99-101. |
| [10] | 王著禄, 易杨华. 商陆有效成分的研究-II商陆皂苷戊、己的分离与鉴定[J]. 药学学报, 1984, 19(11): 825-829. |
| [11] | Yi Y H. A triterpenoid saponin from Phytolacca esculenta[J]. Phytochemistry, 1992, 31(7): 2552-2554. |
| [12] | Yi Y H, Wang C L. A new active saponin from Phytolacea eseulenta[J]. Planta Med, 1989, 55(6): 551-552. |
| [13] | Yi Y H. Esculentoside L and K: two new saponins from Phytolacca esculenta[J]. Planta Med, 1990, 56(3): 301-303. |
| [14] | Strauss A. Saponins from root cultures of Phytolacca acinosa[J]. Phytochemistry, 1995, 38(4): 861. |
| [15] | Yi Y H. Two new saponins from the roots of Phytolacca esculenta[J]. Planta Med, 1992, 58(1): 99-101. |
| [16] | 易杨华, 黄 翔. 商陆中三种新皂苷的分离与鉴定[J]. 药学学报, 1990, 25(10): 745. |
| [17] | Sam S K. A new saponin from Phytolacea eseulenta[J]. Planta Med, 1987, 17(1): 338. |
| [18] | Yi Y H, Zhang J M, Zheng H C, et al. New saponins from the roots of Phytolacca polyandra.[J]. J Nat Prod, 1995, 58(12): 1880-1882. |
| [19] | Gao H M, Liu J X, Wang Z M, et al. Phytolacacinoside A, a new triterpenoid saponin from Phytolacca acinosa Roxb[J]. J Asian Nat Prod Res, 2009, 11(5): 433-438. |
| [20] | Wang L Y, Bai L M, Nagasawa T, et al. Bioactive triterpense saponins from the roots of Phytolacca Americana[J]. J Nat Prod, 2008, 71(1): 35-40. |
| [21] | Nielsen S E, Anthoni U, Christophersen C, et al. Triterpenoid saponins from Phytolacca rivinoides and Phytolacca bogotensis[J]. Phytochemistry, 1995, 39(3): 625-630. |
| [22] | Thiilborg S T, Christensen S B, Cornett C, et al. Molluscicidal saponins from a Zimbabwean strain of Phytolacca dodecandra[J]. Phytochemistry, 1994, 36(3): 753-759. |
| [23] | Wieslawa B, Irena M. Flavonoids and free phenolic acids from Phytolacca americana L. leaves[J]. Acta Poloniae Pharm-Drug Res, 2001, 58(1): 69-72. |
| [24] | Hironobu T, Yuki A, Masami T, et al. Triterpene glycosides from the cultures of Phytolacca americana[J]. Chem Pharm Bull, 2001, 49(2): 246-248. |
| [25] | 贾金萍, 秦雪梅, 李青山. 商陆化学成分和药理作用的研究进展[J]. 山西医科大学学报, 2003, 34(1): 89-92. |
| [26] | 郑汉臣, 钟 武, 瞿振兴, 等. 五种商陆根中微量元素与氨基酸分析[J]. 西北药学杂志, 1991, 11(3): 110. |
| [27] | 国家中医药管理局《中华本草》编委会. 中华本草精选本 (上册) [M]. 上海: 上海科学技术出版社, 1998. |
| [28] | 王著禄, 陈海生, 郑钦岳, 等. 商陆多糖的分离和纯化[J]. 第二军医大学学报, 1990, 11(1): 56-57. |
| [29] | 刘瑞娟, 段 静, 赵国栋, 等. 商陆中挥发油的提取及其化学成分分析[J]. 北方园艺, 2010, 14: 63-64. |
| [30] | 易杨华. 中药商陆脂溶性成分的研究[J]. 中国药学杂志, 1990, 25(10): 585-586. |
| [31] | 庞 军, 张克非, 祝荣文, 等. 商陆对阿霉素肾病大鼠可溶性白介素2受体的影响[J]. 中药药理与临床, 2006, 22(3): 107-108. |
| [32] | 张 亮, 张克非, 吴雄飞. 商陆皂甙甲治疗大鼠抗- Thy1. 1系膜增生性肾炎的实验研究[J]. 四川大学学报: 医学版, 2004, 35(5): 662-664. |
| [33] | 鞠佃文, 郑钦岳, 曹雪涛, 等. 商陆皂苷甲对大鼠Heymann肾炎的治疗作用及对细胞因子的影响[J]. 药学学报, 1999, 34(1): 9-12. |
| [34] | 曹颖瑛, 郑钦岳, 姜远英, 等. 商陆皂甙辛对小鼠脾脏细胞产生IL-3和IL-6的影响[J]. 上海免疫学杂志, 2002, 22(5): 334-336. |
| [35] | 肖振宇, 郑钦岳, 张俊平, 等. 商陆皂苷甲对自身免疫综合征模型小鼠的疗效[J]. 第二军医大学学报, 2003, 24(10): 1108-1111. |
| [36] | 王洪斌, 郑钦岳, 鞠佃文, 等. 商陆多糖I对小鼠脾淋巴细胞增殖及脾淋巴细胞、巨噬细胞分泌细胞因子的影响[J]. 药学学报, 1993, 28(10): 732-737. |
| [37] | 王洪斌, 王 劲, 郑钦岳, 等. 商陆多糖I对小鼠淋巴细胞DNA多聚酶α活性的影响[J]. 第二军医大学学报, 1996, 17(2): 150-153. |
| [38] | 王洪斌, 郑钦岳, 鞠佃文, 等. 商陆多糖II体外对小鼠脾细胞增殖及产生集落刺激因子的影响[J]. 药学学报, 1993, 28(7): 490-493. |
| [39] | 徐志工, 郑玲莉, 杨嗣冲, 等. 中国商陆皂苷诱生淋巴因子的能力及其抗肿瘤细胞效应的研究[J]. 第二军医大学学报, 1990, 11(5): 409-411. |
| [40] | Zhang J P, Qian D H. Antitumor activity and tumor necrosis factor production of Phytolacca acinosa polysaccharides I in mice[J]. Acta Pharmacol Sin, 1993, 14(6):542-545. |
| [41] | 王洪斌, 郑钦岳, 沈有安, 等. 商陆多糖I对荷S180小鼠的抑瘤, 增强免疫和造血保护作用[J]. 中国药理学与毒理学杂志, 1993, 7(l): 52-55. |
| [42] | 董海东, 王 晓, 沈 洁. 凝集素美洲商陆对人单核细胞及白血病细胞的HLA-DR分子表达的影响[J]. 中国免疫学杂志, 1995(12): 218-221. |
| [43] | 郑钦岳, 麦 凯, 潘祥福, 等. 商陆皂苷甲的抗炎作用[J]. 中国药理学与毒理学杂志, 1992, 6(3): 221-222. |
| [44] | 郑钦岳, 方 军, 王洪斌. 商陆皂甙甲对人外周血单核细胞产生肿瘤坏死因子的抑制作用[J]. 第二军医大学学报, 1997, 18(5): 415-417. |
| [45] | 邓 俐, 张堂德, 杜 江. 商陆皂苷甲对银屑病患者外周血单个核细胞产生肿瘤坏死因子和可溶性白介素受体的影响[J]. 临床皮肤科杂志, 2004, 33(7): 407-409. |
| [46] | 肖振宇, 张俊平, 陆 峰. 商陆皂苷甲对细胞间粘附的影响[J]. 药学学报, 2003, 38(10): 728-730. |
| [47] | Rajamohan F, Ozer Z, Mao C, et al. Active center cleft residues of pokeweed antiviral protein mediates its high affinity binding to the ribosomal protein L3[J]. Biochemistry, 2001, 40(3): 91-104. |
| [48] | 刘 爽, 杨爱国, 赵 琦, 等. 美洲商陆抗病毒蛋白的研究[J]. 生物技术通报, 2005(6): 17-33. |
| [49] | Zarling J M, Moran P A, Haffar O, et al. Inhibition of HIV replication by pokeweed antiviral protein targeted to CD4+ cells by monoclonal antibodies[J]. Nature, 1990, 347: 92-95. |
| [50] | 潘延凤, 贺永文, 王 萍, 等. 商陆抗病毒蛋白体外抑制HBV的实验研究[J]. 临床肝胆病杂志, 2004, 20(2): 80-82. |
| [51] | 贺永文, 潘延凤, 王 萍, 等. 商陆抗病毒蛋白体外对HepG2. 2. 15细胞HBV复制的影响[J]. 实用肝脏病杂志, 2004, 7(2): 80-82. |
| [52] | 赵国栋, 王立宽, 段 静, 等. 商陆不同极性、根和茎提取物的抑菌性能分析[J]. 基因组学与应用生物学, 2010, 29(4): 717-720. |
| [53] | 刘春宇, 吴文倩, 唐丽华, 等. 商陆皂苷的抗胃溃疡作用[J]. 中国野生植物资源, 1998(4): 54-56. |
| [54] | 徐炳祥. 商陆的降压成分[J]. 国外药学, 1985, 2(1): 25. |
| [55] | 王一飞. 商陆总皂甙的抗生育活性[J]. 河南医科大学学报, 1996, 36(1): 91. |
| [56] | 原思通, 王祝举. 中药商陆的研究进展 (II)[J]. 中药材, 1991, 14(3): 46-48. |
| [57] | 李啸红, 杨 柳, 李朝平, 等. 商陆遗传毒性研究[J]. 中药药理与临床, 2003, 19(2): 27-28. |
| [58] | 徐华元. 中药商陆降转氨酶[J]. 辽宁中医杂志1986(3): 30. |
| [59] | 范盎然, 赵晓春, 邱 彦. 麻黄药理作用及其临床应用进展[J]. 山西中医, 2008, 24(4): 44-45. |
| [60] | 王 琪. 商陆治疗银屑病40例介绍[J]. 中医杂志, 1984(12): 38-40. |
| [61] | 刘百录. 商陆炖肉治疗久带[J]. 四川中医, 1985(5): 1. |
| [62] | 江苏新医学院. 中药大辞典 [M]. 上海: 上海人民出版社, 1977. |
| [63] | 田普永, 刘锡昌, 李建国, 等. 商陆治疗乳腺增生病253例疗效观察[J]. 兰后卫生, 1985, 6(3): 235-236. |
| [64] | 田普永. 商陆的药理作用及临床作用[J]. 西北药学杂志, 1989, 4(1): 33. |
| [65] | 陈金香. 中西医结合治疗急性商陆中毒26例[J]. 浙江中医药大学学报, 2010, 34(2): 221. |
 2014, Vol. 45
2014, Vol. 45




