2. 成都中医药大学药学院, 四川 成都 611137;
3. 江西中医药大学 现代中药制剂教育部重点实验室, 江西 南昌 330004
2. College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China;
3. Key Laboratory of Modern Preparation of TCM, Ministry of Education, Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
《神农本草经百种录》记载:“入口则知其味”,味道是药物基本的自然属性。固囿于传统五味理论,中药学对于涩味一直缺乏深入的认识与理解。作为中药的真实滋味之一,涩味广泛存在于中药材及成方制剂中,一些药物或制剂的涩味非常强烈,甚至难以接受。从某种程度上讲,药物的涩味对于候选药物的成药性、患者服药的顺应性乃至中药安慰剂的发展都具有一定的影响。因此,本文对本草中涩味的含义、涩味存在的普遍性、涩味的化学本质与形成原理、涩味在制剂过程链的传递规律以及制剂中涩味的掩蔽方法5方面进行了概述,以期深化对涩味的认识,促进适宜于中药特性的涩味掩蔽技术与特色辅料的发展。
1 传统本草文献中“涩”的含义在传统本草文献中,涩味有2层含义,一是反应药物的真实滋味,如《神农本草经》云“龙胆,味苦涩”、《本草经集注》云“槟榔,广州以南者,形大而味涩”;一是表征药物的性能,如《灵枢•五味论》云“酸入于胃,其气涩以收”、《本草经集注》云“朴硝,炼之白如银,能寒能热,能滑能涩”。
自《黄帝内经》论述五味与五脏的关系、五味的阴阳属性、偏食五味的弊端,至《神农本草经•序例》提出“药有酸、咸、甘、苦、辛五味”,中药的五味理论初步形成。由于《内经》与《本经》是中医药学的经典与基石,尽管后人发现真实滋味并不止5种,还有淡味与涩味,但为了使五味理论与五行学说相对应,仍牵强地认为涩味是酸味的变味,而附于酸味。事实上,酸味与涩味无论从滋味还是作用特点上都有很大差异,并不能完全归为一类[1]。
作为性能的“涩”是与“滑”相对应的,主要用于指导脱证的治疗。陈藏器在《本草拾遗》序例中提出“十剂”分类,涩与滑相对,即涩可去脱;又如《新修本草》云“有二种,苗有刺而涩者,无刺而滑者,俱是门冬”。此外,“涩”也与“利”相对,如《本草经集注》:“蝼蛄,以自出者,其自腰以前甚涩,主止大小便。从腰以后甚利,主下大小便”。
2 涩味存在的普遍性涩味作为药物的真实滋味,在中药中是普遍存在的。以《中国药典》2010年版一部[2]收载的514味药物为研究对象,真实滋味标有涩味的共有105味,占药物总数的17.7%;其中,标为极涩的药物有1味,为白矾;标有涩味的药物有57味,分别为儿茶、土荆皮、土茯苓、大青叶、山茱萸、山楂叶、小叶莲、制天南星、木通、木棉花、五倍子、毛诃子、升麻、石榴皮、布渣叶、四季青、冬葵果、西青果、赤芍、牡丹皮、何首乌、制何首乌、皂矾、余甘子、沙棘、诃子、灵芝、鸡血藤、青果、板蓝根、刺五加、虎杖、委陵菜、侧柏叶、鱼腥草、荔枝核、柿蒂、穿山龙、莲须、桃枝、核桃仁、拳参、桑寄生、菝葜、梅花、野马追、麻黄、断血流、续断、紫草、锁阳、滇鸡血藤、榧子、槟榔、焦槟榔、藕节、绵马贯众炭;标为微涩或稍涩的药物47味。
涩味在成方制剂中的存在也相当普遍。笔者对《新编国家中成药》[3]收载的近7 000种中成药进行了统计,在性状项下标明涩或微涩的有667个,约占总数的10%;值得一提的是,有9个口腔含服制剂也标注了涩味,分别是复方两面针含片、喉舒口含片、三果汤含片、舒灵喉片、藏青果喉片、喉痛丸、清咽滴丸、阮氏上清丸、参贝陈皮。
3 涩味的化学本质与形成原理 3.1 涩味的定义涩味是由于上皮细胞暴露在明矾或鞣质溶液所产生的起皱、收缩的感觉[4]。这是一组复杂的感觉,涉及口腔表面的干燥、粗糙,以及口腔黏膜和肌肉的紧缩、拖曳或起皱的感觉。严格地讲,涩味是一种感觉或触觉,而非味觉,并不是通过作用于舌头上的味蕾产生的,只是由于产生于口腔中,而被误以为是味觉。
3.2 涩味的化学基础及形成机制产生涩味的化学物质主要有明矾类与多酚类。两者产生涩味的原理并不完全相同。
明矾的化学成分为KAl(SO4)2•12H2O,在水中电离出Al3+,易水解生成带正电的胶体状Al(OH)3,吸附能力强。而唾液蛋白的等电点(pI)<6,在唾液(pH 6.6~7.1)中带负电。因此,两者易发生吸附沉淀反应,产生蛋白质被凝固的收敛感。
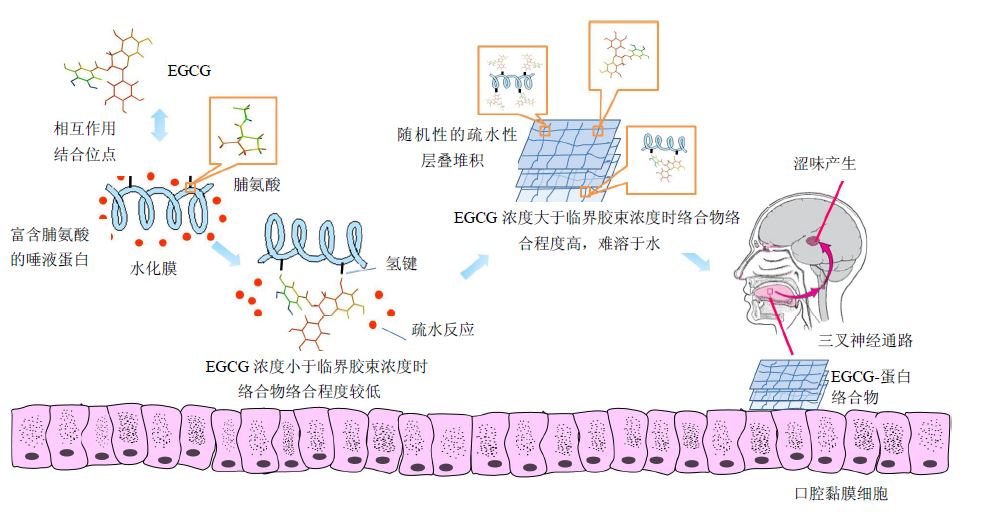
多酚又称鞣质,是一类广泛存在于植物液泡中的次生代谢产物,在维管束植物中量尤高。现普遍认为,涩味是人唾液中富含脯氨酸的蛋白(salivary proline-rich proteins,PRPs)与多酚类物质的相互作用引起的。具体地,PRPs的脯氨酸残基上五元吡咯环外羰基与多酚苯环上的酚羟基发生熵驱动下的氢键效应;反应开始阶段,多酚浓度小于其临界胶束浓度(CMC)时,相互作用是特异的,绑定总是发生在3个相同的结合位点,形成络合程度较低的络合物。随着浓度增加,两者反应点位迅速增加,络合物的络合程度增加,PRPs外的结合水被大量挤走,发生疏水性相互作用,PRPs从唾液中完全脱离;当多酚浓度大于CMC时,多酚、蛋白及已形成的络合物发生随机性的疏水性层叠堆积,在口腔黏膜、舌头上形成一个由多酚-蛋白络合沉淀物组成的疏水性网状结构,刺激黏膜下神经,涩味产生。该沉淀物兼有弹性固体和黏性流体的双重特性,可在唾液的持续作用下或外力作用下被缓慢清除[5, 6]。
为了阐释该过程的分子机制,Jobstl等[7]采用原子力显微镜单分子力谱对茶多酚中的表没食子儿茶素没食子酸酯(EGCG)与牛奶中的β-酪蛋白(与唾液蛋白类似,富含脯氨酸)的相互作用过程进行了研究。结果发现,EGCG与一个单一的酪蛋白分子的相互作用是多价作用(构筑基元间多个点位同时相互作用,其强度可大于相应的各个点位相互作用的线性加合[8]),通过蠕虫链状模型的计算结果可发现酪蛋白相关长度与回转半径的减小。酪蛋白被EGCG拉伸额外所需的力是由熵驱动的,多价疏水性相互作用引起了酪蛋白胶束的压实。唾液蛋白与EGCG相互作用形成络合物的过程机制及涩味形成的原理见图 1。
|
图 1 唾液蛋白与EGCG相互作用形成络合物的过程及涩味形成的原理 Fig.1 Complexes forming process in interaction between saliva proteins and EGCG as well as forming principle of astringency |
涩味形成的实质就是唾液蛋白与多酚物质形成疏水性络合物的过程。诸多因素能对该过程产生影响,具体可分为生理因素与环境因素2类。
生理因素主要指唾液的影响。人类唾液分为2部分:一部分游离存在于口腔中,另一部分固定于口腔黏膜及舌头上。游离的唾液蛋白在高尔基体的加工装配过程中经过了复杂的美拉德反应,糖基化水平远高于口腔黏膜上的唾液蛋白;糖基化水平越高,对多酚-蛋白络合物的溶解性越好。因此,固定于黏膜上的唾液蛋白是与多酚反应形成络合物,引起涩味的主要原因;而游离的唾液蛋白则具有缓慢清除络合物的作用[9]。Yao等[10]研究发现全唾液比腮腺唾液对多酚具有更强的亲和力,说明除唾液淀粉酶外,下颌腺分泌的唾液中产生的诸多肽类(酸性磷酸酶、核糖核酸酶等)也参与了沉淀反应。此外,个体差异导致不同人群维持唾液蛋白浓度的能力[11]、唾液蛋白糖基化水平[12]不同,对涩味的敏感度也不同。
环境因素包括多酚浓度、多酚类型、乙醇、果胶以及pH值等。单位时间内多酚浓度越高,形成疏水性络合物速度越快,涩味刺激越强烈。结合型儿茶素比游离儿茶素的相对分子质量大,酚羟基多,与唾液蛋白络合过程越容易,沉淀物越大,涩味越强[13]。葡萄酒的相关研究提示,对相同多酚浓度的水溶液与13%醇溶液(葡萄酒酒精浓度)进行对比评价,乙醇能增强对涩味的感知程度,这与其具有的脱水作用有关[14]。而葡萄酒中适当添加酸性果胶能在一定程度上抑制缩合鞣质与α-蛋白的结合,有助于降低涩味[15],这可能与果胶调控络合物的黏弹性有关。多酚溶液呈酸性,降低溶液或葡萄酒的pH值,涩味增强[16],这可能与低pH值抑制多酚电离,增加分子态多酚与唾液蛋白结合能力有关。
3.4 涩味的神经传导通路口腔中产生的涩味是由分布于口腔黏膜下的游离神经末梢感知的。当发生沉淀反应时,上颌的感受器,舌前2/3黏膜及口腔底或侧壁的黏膜下的感受器分别将感知的触觉信号延上、下颌神经传至三叉神经节;感觉神经元的中枢突汇成粗大的三叉神经感觉根,入脑后终止于脑干三叉神经感觉核团。由三叉神经脑桥核发出的纤维,组成三叉丘系,上行至背侧丘脑的腹后内侧核,发出纤维经内囊投射到大脑皮层第1躯体感觉区的面区(躯体感觉核),感觉到涩味的产生[17]。
4 涩味在制剂过程中的传递规律对于大部分植物药材而言,由于细胞壁屏障的保护,直接口尝涩味较弱。但经过加工处理后,涩味会发生明显的变化。
多酚的水溶性较好,能被水或含水醇大量提取,故提取液的涩味明显强于药材。浓缩后,多酚类物质浓度增加,涩味增强。对于未通过醇沉或大孔树脂分离的粗提取物而言,涩味较为明显。大花红景天药材仅微涩,但经70%乙醇浸提、喷干制成红景天提取物涩味明显[18]。安胃疡胶囊也与之类似,由甘草提取物与辅料组成,内容物的涩味也非常明显,几乎无甜味[3]。在浸膏或颗粒的干燥过程中,多酚类物质容易随水分的蒸发而迁移至表面,在与口腔黏膜接触过程中,会感觉到涩味的增强。
对于含鞣质的部分药材,粉碎也能增强涩味。以散剂为例,粉碎后部分细胞破壁,鞣质成分外溢,包覆于粉末表面,涩味增强。若采用超微粉碎,该情况可能更为明显,如含有大黄的一捻金、含儿茶的红花七厘散等。此外,液体状态下药物的涩味可能比固体状态更为明显,如《中国药典》2010年版收载的甘草流浸膏比甘草浸膏涩味强[2]。
5 涩味的掩蔽技术研究概况针对涩味形成机制,其掩味技术主要包括去除多酚、隔绝与唾液蛋白的接触、调控PRPs-多酚的络合反应、添加矫味剂、阻断三叉神经传导通路等。
5.1 分离去除、水解多酚类成分若经过药理实验或临床实践证实多酚类成分为无效成分,可采用制剂学手段分离除杂,降低多酚的量。吉欣等[19]采用超滤法去除红景天葡萄酒中的苦涩味。鉴于中药起效的物质基础并不十分明确,该法主要在食品饮料及保健品中应用,常用方法有明胶沉淀法[20]、钙盐沉淀法[21]、PVPP吸附法[22]等,也可选用硅藻土等吸附澄清剂物理性吸附多酚。
茶科学领域的研究发现,酯性儿茶素苦涩味非常明显,而游离儿茶素苦涩味很低,因此,可采用鞣质酶水解的方法水解酯性儿茶素,降低苦涩味。徐文平等[23]发现咖啡因对EGCG的涩味有明显的增强作用,采用活性炭或高分子多孔材料吸附咖啡因,然后醇类试剂脱吸附,分离除去咖啡因,可降低涩味[24]。
5.2 微囊化处理通过微囊化处理防止或减少多酚在口腔中的释放,使其在口腔中保持完整至少30~60 s,以保证囊化多酚有足够时间被咀嚼或吞咽,进入胃肠道被分解释放,能避免与多酚有关的苦、涩味。路德维希等[25]采用热熔体流化床系统制备微囊,囊材或包衣材料为脂质(氢化棕榈油、氢化大豆油、乙酰化甘油单酯、椰子油等)或明胶或阿拉伯胶,显著降低了涩味。
5.3 环糊精包合易鹤翔[26]向银杏提取液中加入50%的环糊精,并在80 ℃条件下保存2 h,能显著降低干燥后提取物的涩味。杨意成[27]向茶汤中添加0.4%~0.6%的β-环糊精,对茶汤中苦涩味的包埋作用最好。尽管采用环糊精掩蔽涩味的报道较多,但β-环糊精呈现“内疏水、外亲水”的特性,对客体分子的包合源于其空腔的尺寸和疏水性,客体分子的大小及疏水基团暴露的位置直接影响包合效果;分子体积越小,疏水常数越大,包合效果越好[28]。因此,笔者认为,环糊精类对于极性较强的多酚类物质的包合效果与机制还需深入研究。
5.4 粒子复合处理白矾味极涩,具有较强的抗菌与凝固蛋白作用,遇水能引起口腔黏膜蛋白质的剧烈收缩。对于传统的粉末给药系统,白矾粒径大,分散不均匀,给药过程中易出现因局部浓度过高而造成的严重酸涩味,刺激口腔黏膜,甚至组织溃烂。青黛、白矾药对是治疗口腔溃疡的常用药对,为克服白矾的涩味,课题组采用复合粒子的方法,将青黛粉碎成微粉后与白矾复合,利用表面力的作用,将青黛微粉包覆于白矾表面,降低了白矾与口腔黏膜的接触面积,解决了白矾突释产生的局部浓度过高的强烈涩味[29, 30]。
5.5 添加苯酞类化合物苯酞类化合物是从伞形科植物的根茎中分离出的一类具有特殊辛辣气味的化合物,能从川芎、当归、蛇床子等药材中分离,能缓和涩味食品的刺激。其中,较为有效的成分为瑟丹酸内酯、瑟丹内酯、3-正丁基苯酞和3-亚丁基苯酞等。黑林淑子等[31]向茶类饮品中添加微量(0.01%~1%)的苯酞类化合物,在不产生苯酞类化合物特色气味的前提下,显著降低了茶类饮品涩味,取得了满意的效果。因此,可在处方研究过程中,结合功能主治,适当添加一定的川芎、当归等药物,或分离苯酞类化合物进行新型辅料开发。
5.6 添加果胶多糖类物质Carvalho等[32]采用固相合成法从唾液中分离出α-淀粉酶和IB8c(富含脯氨酸的蛋白质)2种蛋白质,研究葡萄酒中酸性果胶(源于葡萄籽)对缩合鞣质与2种蛋白质聚集反应的影响。结果显示,酸性的阿拉伯半乳聚糖能抑制缩合鞣质与2种蛋白的聚集结合,而聚鼠李半乳糖醛酸II仅能抑制与α-淀粉酶的聚集;该研究提示,一些多糖类物质能在一定程度上抑制多酚与蛋白质的结合,降低涩味。Hayashi等[33]采用味觉传感器系统及1H-NMR光谱对果胶与4种不同的儿茶素类物质进行了涩味评价及机制研究。结果显示,果胶能与收敛性没食子酸酯型儿茶素 [EGCG和表没食子儿茶素(ECG)] 形成紧密的络合物,降低其涩味,对于非收敛性没食子酸酯型儿茶素 [EGC和表儿茶素(EC)] 无影响。上述研究提示,果胶对于儿茶素的类型具有选择性,采用该法降低涩味时应加以区分。
5.7 添加蛋白类物质或碳水化合物还可利用酸性酪蛋白掩蔽或减轻多酚组合物涩味或苦味[24]。其原理是利用酪蛋白与多酚类生成络合物减少游离多酚数量,及利用酪蛋白吸附于唾液蛋白或口腔黏膜表面降低多酚与唾液蛋白的接触面积而实现的。路德维希等[25]也采用喷雾干燥系统,将多酚组合物与蛋白质(乳蛋白、大豆蛋白)或碳水化合物等一起喷雾干燥。常用的乳蛋白是乳蛋白分离物和酪蛋白酸钠,碳水化合物是麦芽糖糊精或海藻糖。其机制可能是喷雾干燥过程中多酚沿着各蛋白链物理吸附,也可能是多酚包藏在载体材料的基质中。此外,生活经验提示,添加咖啡伴侣(植脂末、奶精)能降低多酚的涩味,与其中含有的酪蛋白酸钠有关。酪蛋白用于涩味的掩蔽机制较为清楚,效果也比较肯定,但酪蛋白与多酚形成的络合物对多酚药理作用及吸收代谢有无影响需要深入研究。
5.8 添加甜味剂、芳香剂与辅助甜味剂添加甜味剂、芳香剂是针对苦味、涩味药物矫味最常用的方法,其原理主要是通过混淆大脑味觉感知、增加特异性气味与香味来实现的[34]。常用甜味剂有阿斯巴甜、三氯蔗糖、甜菊糖苷、蔗糖、甘露醇等;常用的芳香剂主要是薄荷脑与薄荷油。上述方法对涩味较低的药物有一定效果,对于强涩味物质效果并不理想。此外,多酚与唾液蛋白的结合是放热反应,而甘露醇、薄荷脑等物质在与口腔中能吸附一定的热量,产生清凉感,改善口腔黏膜感觉。另有文献报道,发现植物甾醇酯具有辅助甜味,掩蔽苦、酸、涩味的作用,在食物或饮料中添加极少量就能显著降低蔗糖、果糖等甜味剂的用量,掩蔽涩味[35]。
5.9 阻断或减弱三叉神经通路的信号传导根据涩味的神经传导通路,可选择阻断或减弱三叉神经信号传导的一些药物,来减弱对涩味的感知程度。如用于缓解三叉神经痛的药物卡马西平,具有膜稳定作用,能降低神经细胞膜对Na+、Ca2+的通透性,降低神经的兴奋性,延长不应期。但并不提倡化学药的使用,以避免无法预知的中西药配伍禁忌引起的不良反应。
6 适宜于中药口含片特点的涩味掩蔽方法初探味道是影响中药口含片研究制备与生产实践的关键因素。中药中的鞣质、黄酮等含有酚羟基成分具有一定的药理活性,采用分离纯化、水解等方法会造成物质基础的重大变化。采用微囊化、包合物等方式避免多酚与唾液蛋白的结合,又会明显改变制剂成分的释放吸收部位。而β-酪蛋白、酸性果胶、苯酞化合物、甾醇酯等并非药用级辅料,其掩蔽涩味的机制也不明确,安全性与有效性也需深入研究。
鉴于此,笔者提出“在确保物质基础及释放吸收部位不变、不明显增加服用量的前提下,基于口腔释药的特殊环境,通过对多酚-唾液蛋白络合反应过程的调控实现对涩味掩蔽调控”的研究思路,即生理因素决定了涩味的消除速率,不易改变,只能通过环境因素降低涩味的生成速率。在多酚物质溶出释放环节,将含片看成一个“药物仓库”,添加少量骨架型缓释辅料,适当延缓成分的溶出速度,避免成分突释,降低唾液中多酚类成分浓度。在多酚与唾液蛋白相互作用环节,通过制粒压片前升高浸膏pH,使多酚类物质的酚羟基部分“质子化”,减少孤对电子数,降低多酚与唾液蛋白的结合能力,降低疏水性络合物的生成量与生成速率。通过上述2种手段的合理联用,降低涩味的生成速率,将涩味控制在可接受的范围内,建立适宜中药口含片特点的涩味掩蔽技术。
7 结语涩味是明矾或多酚类与唾液蛋白结合形成不溶性络合物的结果,涩味的强弱受到个体差异、涩味物质的种类与浓度、服用方式、伴随物质等诸多因素的影响。客观而言,涩味的形成机制及有效的掩蔽方法主要是由食品、茶、葡萄酒等领域的研究人员完成的,中药学学科对该方面的研究甚为薄弱。涩味在中药材及制剂中占有相当比例,但由于中药的化学成分复杂,物质基础尚不明确,明显不同于食品与饮料,其他学科的方法能否照搬还需要深入系统地研究。因此,开展适宜于中药(口含片)特色的涩味掩蔽技术及开发相关辅料,有利于实现“良药苦口”向“良药可口”的转变,对于发展中药掩味技术、促进中药辅料工业的发展具有一定的推动作用。
| [1] | 张廷模. 临床中药学 [M]. 上海: 上海科学技术出版社, 2006. |
| [2] | 中国药典 [S]. 2010. |
| [3] | 宋民宪, 杨 明. 新编国家中成药 [M]. 第2版. 北京: 人民卫生出版社, 2011. |
| [4] | 童华荣, 金孝芳, 龚雪莲. 茶多酚感官性质及其对茶叶涩味的影响[J]. 茶叶科学, 2006, 26(2): 79-86. |
| [5] | Jobstl E, O Connell J, Fairclough J P, et al. Molecular model for astringency produced by polyphenol/protein interactions[J]. Biomacromolecules, 2004, 5(3): 942-949. |
| [6] | Cala O, Pinaud N, Simon C, et al. NMR and molecular modeling of wine tannins binding to saliva proteins: revisiting astringency from molecular and colloidal prospects[J]. FASEB J, 2010, 24(11): 4281-4290. |
| [7] | Jobstl E, Howse J R, Fairclough J P, et al. Noncovalent cross-linking of casein by epigallocatechin gallate characterized by single molecule force microscopy[J]. J Agric Food Chem, 2006, 54(12): 4077-4081. |
| [8] | 张义恒, 王治强, 张 希. 分子间相互作用力的直接测量[J]. 高分子学报, 2009(10): 973-979. |
| [9] | Nayak A, Carpenter G H. A physiological model of tea-induced astringency[J]. Physiol Behav, 2008, 95(3): 290-294. |
| [10] | Yao J W, Lin C J, Chen G Y, et al. The interactions of epigallocatechin-3-gallate with human whole saliva and parotid saliva[J]. Arch Oral Biol, 2010, 55(7): 470-478. |
| [11] | Dinnella C, Recchia A, Fia G, et al. Saliva characteristics and individual sensitivity to phenolic astringent stimuli[J]. Chem Senses, 2009, 34(4): 295-304. |
| [12] | Sarni-Manchado P, Canals-Bosch J M, Mazerolles G, et al. Influence of the glycosylation of human salivary proline-rich proteins on their interactions with condensed tannins[J]. J Agric Food Chem, 2008, 56(20): 9563-9569. |
| [13] | 钟世安, 贺国文, 涂秋云, 等. 大孔吸附树脂对酯性儿茶素吸附性能的研究[J]. 离子交换与吸附, 2007, 23(5): 392-399. |
| [14] | Obreque-Slíer E, Peña-Neira A, López-Solís R. Enhancement of both salivary protein-enological tannin interactions and astringency perception by ethanol[J]. J Agric Food Chem, 2010, 58(6): 3729-3735. |
| [15] | Hayashi N, Ujihara T, Kohata K. Reduction of catechin astringency by the complexation of gallate-type catechins with pectin[J]. Biosci Biotechnol Biochem, 2005, 69(7): 1306-1310. |
| [16] | Kallithraka S, Clifford M N, Bakker J. Effect of pH on astringency in model solution and wines[J]. J Agric Food Chem, 1997, 45(6): 2211-2216. |
| [17] | 项 涛. 简明人体解剖学 [M]. 西安: 西安世界图书出版西安公司, 2005. |
| [18] | 林俊芝. 红景天提取物的制剂前评价研究 [D]. 成都: 成都中医药大学, 2013. |
| [19] | 吉 欣, 吴贵林, 张利娟, 等. 超滤祛除红景天葡萄酒中苦涩味[J]. 中国酿造, 2006(6): 63-65. |
| [20] | 张 磊, 吕远平. 果汁涩味脱除工艺的研究[J]. 饮料工业, 2009, 12(8): 19-22. |
| [21] | 刘晓艳, 白卫东, 赵文红, 等. CaCl2溶液对柿子汁涩味的影响[J]. 现代食品科技, 2007, 33(11): 136-138. |
| [22] | 刘 东. PVPP吸附余甘果汁中多酚物质的研究[J]. 果树学报, 2007, 24(2): 176-179. |
| [23] | 徐文平, 李大祥, 张正竹, 等. 绿茶几种化学组分苦涩味非线性回归分析及在感官审评中的应用[J]. 茶叶科学, 2010, 30(5): 399-406. |
| [24] | 张志美, 张诗若. 一种有效去除滇橄榄果汁尖酸苦涩味的方法及其应用: 中国, 201210018829.5 [P]. 2012-07-18. |
| [25] | 路德维希, 温索尔, 高恩卡, 等. 多酚组合物中涩味的减轻: 中国, 200780048388.0 [P]. 2009-06-26. |
| [26] | 易鹤翔. 一种银杏提取物去除苦涩味的方法及其应用: 中国, 200310125175. 7 [P]. 2004-12-15. |
| [27] | 杨意成. 绿茶饮料苦涩味控制技术研究 [D]. 杭州: 浙江大学, 2008. |
| [28] | 马鸿雁. 常用增溶辅料与难溶中药成分相互作用的分子模拟和实验研究 [D]. 成都: 成都中医药大学, 2011. |
| [29] | 张定堃, 林俊芝, 韩 丽, 等. 基于粒子设计原理的青黛-白矾复合粒子的制备及表征[J]. 中草药, 2013, 44(24): 3457-3464. |
| [30] | 张定堃, 秦春凤, 韩 丽, 等. 粒子设计对口腔溃疡散粉体学性质的影响[J]. 中国中药杂志, 2013, 38(3): 334-340. |
| [31] | 黑林淑子, 中井节子, 久保田纪久枝. 含苦味饮食品的苦味改良剂和含涩味饮食品的涩味改良剂: 中国, 201080047123. 0 [P]. 2012-07-18. |
| [32] | Carvalho E, Mateus N, Plet B, et al. Influence of wine pectic polysaccharides on the interactions between condensed tannins and salivary proteins[J]. J Agric Food Chem, 2006, 54(23): 8936-8944. |
| [33] | Hayashi N, Ujihara T, Kohata K. Reduction of catechin astringency by the complexation of gallate-type catechins with pectin[J]. Biosci Biotechnol Biochem, 2005, 69(7): 1306-1310. |
| [34] | 廖正根, 钟文静, 蒋且英, 等. 苦味形成机理与中药苦味掩味技术的研究[J]. 时珍国医国药, 2008, 19(5): 1276-1278. |
| [35] | 洪卡宁, 库希斯托, 拉赫蒂宁, 等. 掩蔽了苦味、酸味和/或涩味的可食产品: 中国, 200480010668. 9 [P]. 2006-05-31. |
 2014, Vol. 45
2014, Vol. 45


