高良姜为姜科山姜属植物高良姜Alpinia officinarum Hance的干燥根茎,是我国传统中草药,其味辛,性温,具有温胃祛寒、理气祛风、消食止痛的功效;主治腹脘疼痛、胃寒吐泻、嗳气吞酸、消积食滞、消化不良等症,是中医临床上常用的温里药[1]。高良姜素(galangin,3,5,7-三羟基黄酮)是高良姜最主要的药理活性成分,对高良姜的鉴别具有独特的专属性。临床药理研究表明,高良姜素具有抗氧化、抗细菌、抗病毒、抗炎、抗致畸、抗突变、抗肿瘤等多种生理活性[2,3,4,5],具有良好的临床应用价值和研究前景。目前,从天然产物中提取分离高良姜素的方法主要有传统的溶剂提取法、柱色谱法、逆流色谱与硅胶柱色谱相结合的方法等[6,7],这些方法操作繁杂、加之溶剂及时间的消耗,使得该方法分离效率差、回收率低、成本高。
分子印迹技术(molecular imprinting technique,MIT)指合成在空间结构上和结合位点上具有与某一分子(模板分子)完全匹配的聚合物的一种技术,是以目标分子为模板分子,制备对该分子具有特异选择性的交联聚合物,即分子印迹聚合物(molecular imprinting polymer,MIP)[8,9,10]。MIT提供了一种简单的直接具有分子识别能力的方法,MIP因其具有制备简单、稳定性好(耐高温、耐酸碱、耐有机溶剂)、使用寿命长等特点,因而在临床药物分析、手性拆分、固相萃取、生物传感器等方面得到广泛应用[11,12]。
近年来,科研工作者们又成功地将MIT应用到天然产物有效成分的分离纯化中[13,14],为其有效成分的分离富集提供了新的途径和方法[15]。目前,采用MIT分离纯化高良姜素的研究尚未见报道。本实验以高良姜素为模板分子,采用MIT合成了对高良姜素具有特异选择性吸附的MIP,并对其性能特性进行研究。以期建立一种从天然产物中提取纯化高良姜素的新方法。
1 仪器与材料FTIR—8300傅里叶红外光谱仪,日本岛津公司;HH—S型恒温水浴锅,江苏省金坛市医疗仪器厂;760CRT双光束紫外-可见分光光度计,上海精密科学仪器有限公司;KQ—250DE型超声波清洗器(40 kHz),昆山市超声仪器有限公司;BS—210S电子天平,北京赛多利斯天平有限公司;800型离心沉淀器,上海医疗器械(集团)有限公司手术器械厂;电热真空干燥箱,上海实验仪器厂有限公司。
高良姜素,成都锦泰和医药化学技术有限公司,批号110501,质量分数99%;丙烯酰胺,成都市科龙化工试剂厂,质量分数≥99%;甲基丙烯酸,天津市登峰化学试剂厂;偶氮二异丁腈(AIBN),上海试四赫维化工有限公司;乙二醇二甲基丙烯酸酯(EGDMA),阿拉丁试剂公司,批号30184;四氢呋喃,天津化学试剂三厂;丙酮、乙醇,天津市北辰方正试剂厂;乙腈、甲醇、冰醋酸,南京化学试剂有限公司;所有试剂均为分析纯。
2 方法与结果 2.1 高良姜素MIP(GMIP)的制备及处理分别对模板分子、功能单体、交联剂的投料比、反应时间和反应温度等GMIP的反应条件及聚合物处理方法进行优化[16,17],得到最佳制备及处理方法:称取0.27 g(1.0 mmol)高良姜素和0.28 g(4.0 mmol)功能单体丙烯酰胺充分溶解于4 mL丙酮中,于10 mL比色管中超声2 h,使模板分子与功能单体充分发生作用,再加入3.8 mL(20 mmol)交联剂EGDMA和0.022 g引发剂AIBN,充分混溶后,通N2脱氧10 min,在真空状态下密封。将密封好的比色管于60 ℃下聚合24 h,所得的棒状聚合物用研钵磨碎并过筛,用体积比为9∶1的甲醇-乙酸混合溶液于索氏提取器中提取24 h,以除去模板分子及未反应的化合物,然后用甲醇洗涤除去残留的乙酸至中性,聚合物颗粒经丙酮反复沉降,除去悬浮的细颗粒后,真空干燥至恒定质量,即为GMIP。空白MIP(NMIP)的合成除不加高良姜素外,其余方法同上。
在非共价型MIP的制备过程中,溶剂的极性对反应过程中氢键的形成和离子键作用力的影响较大,因为极性溶剂能与MIP的空间识别位点的功能基结合,从而使其失去与模板分子结合的能力。为了提高MIP的识别性能常选用非极性或弱极性的非质子溶剂,如二氯甲烷、氯仿、乙腈、N,N-二甲基甲酰胺(DMF)等。高良姜素中含有3个酚羟基,具有一定的极性,在氯仿中的溶解性较差。为此本实验比较了丙酮、四氢呋喃、乙腈等弱极性溶剂中高良姜素和功能单体的溶解效果,结果溶解效果均良好。如图 1所示,对比合成的MIP的紫外吸收,丙酮组的紫外吸收较强,且最大吸收波长未发生红移,与高良姜素的最大吸收波长相同,均为355 nm,故选择丙酮作为溶剂。
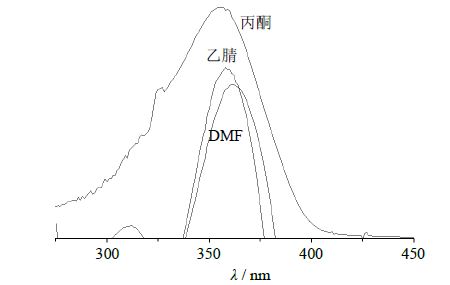
|
图 1 在不同溶剂中的紫外光谱 Fig.1 UV absorption spectra of GMIP in different solvents |
将制备的GMIP及NMIP分别作SEM观察,对比其形貌异同。聚合物的形状、表面形态、颗粒大小及均匀度等特征会影响聚合物的吸附性能。由SEM图(图 2)可见,NMIP(图 2-B)表面看起来更光滑,但形状不规则,而GMIP(图 2-A)空隙均匀,粒度大小基本一致;通过SEM可以比较直观的分析聚合物的形貌特征,为解释聚合物的吸附性能提供依据。

|
图 2 GMIP (A) 和NMIP (B) 的SEM图 (×4 800) Fig.2 SEM of GMIP (A) and NMIP (B) (× 4 800) |
将高良姜素、丙烯酰胺、制备的GMIP及NMIP分别用溴化钾压片,测定FTIR图,分析对比其结构异同。
将所得的聚合物进行FTIR表征(KBr压片法),如图 3所示由各种聚合物的FTIR图可见,制备的聚合物都有明显的羟基(3 310 cm-1)、羰基(1 731 cm-1)、酯基(1 265和1 161 cm-1)的特征吸收峰。在1 500~1 600 cm-1没有出现苯环的多重特征吸收峰,则表明该MIP没有模板分子存在,说明通过充分清洗,已经将模板分子清洗干净。高良姜素聚合前的分子内氢键吸收带在3 310 cm-1附近,聚合后被更强且宽的吸收峰在3 467 cm-1处取代,说明有大量分子间氢键形成。NMIP的谱图与清洗后的GMIP谱图大体相似,只是相对于NMIP酰胺基在3 448 cm-1的伸缩振动,GMIP(3 467 cm-1)红移了19 cm-1。这说明在GMIP合成过程中高良姜素和功能单体丙烯酰胺之间发生了相互作用,形成了氢键。GMIP和NMIP为同一路线合成,只是聚合物的内部结构存在差别,导致吸收峰的位置和强度略有区别。
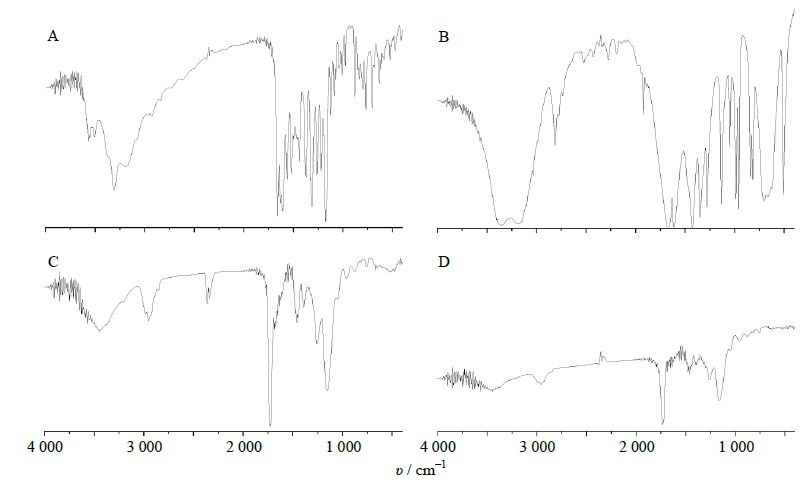
|
图 3 高良姜素 (A)、丙烯酰胺 (B)、GMIP (C) 和NMIP (D) 的FTIR图 Fig.3 FTIR of galangin (A),aerylamide (B),GMIP (C),and NMIP (D) |
分别称取8份10.0 mg GMIP装于25 mL锥形瓶中,加入1.0 mL系列不同浓度的高良姜素丙酮的标准溶液,在振荡器上避光、恒温振荡24 h后,转入高速离心机中离心5 min,取适量的上层离心液,用孔径为45 nm的微孔滤膜滤过,用丙酮稀释至一定体积,用紫外-可见分光光度计在一定波长下测定平衡吸附液中模板分子高良姜素的游离浓度,根据吸附前后的溶液中高良姜素的浓度变化,计算GMIP对模板分子高良姜素的结合量,绘制吸附等温线,用同样的方法对NMIP进行实验,计算公式为Q=(C0-C)×V/m,其中Q为聚合物的吸附量(μmol/g),C0为平衡实验中底物初始浓度(μmol/mL),C</i>为达吸附平衡后上层清液中底物的浓度(μmol/mL),V为吸附溶液的体积(mL),m为聚合物的质量(g)。
为了研究GMIP的结合特性,测定它对不同浓度高良姜素甲醇溶液的结合量,同样的方法对NMIP进行实验,对比反应的结合量,绘制吸附等温线(图 4)。
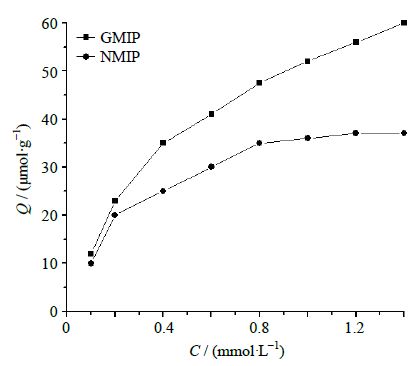
|
图 4 GMIP和NMIP的吸附等温线 Fig.4 Adsorption isotherm of GMIP and NMIP |
由图 4可见,吸附开始时,随着溶液浓度的增加,GMIP和NMIP对模板分子的吸附量都迅速增加。当浓度达到一定时吸附量达最大值,之后曲线逐渐趋于平缓,吸附量达饱和。相同浓度下,GMIP对高良姜素的吸附量明显高于的NMIP的吸附容量,这是由于高良姜素与GMIP中的空穴结构要比NMIP中的空穴更加匹配,所以对高良姜素的吸附量大;而且在NMIP中功能团的分布是任意的,没有形成形状与高良姜素互补的分子识别位点。因此,尽管NMIP有着与GMIP相同的化学组成,但它对模板分子高良姜素不显示特异选择性,仅仅依靠弱的非特异性吸附作用来与底物结合,选择性比较低,吸附量相对较少。GMIP相对于NMIP有较高的结合容量,说明在GMIP内存在着由印迹作用形成的分子空穴。
在MIP的研究中常采用Scathard模型来评价分子印迹聚合物的吸附特性,用于确定反应平衡键合常数以及键合位的数目,是对受体的平衡键合进行分析的一种数学方法[18]。Scathard方程:Q/C=(Qmax-Q)/Kd,其中Kd为结合位点的平衡离解常数(mol/L);Qmax为结合位点的最大结合量(μmol/g),C为底物在上清液中的平衡浓度。
以Q/C对Q作图(图 5),可得到聚合物的平衡力加常数Kd和最大表观结合位点数Qmax。通过回归分析获得2条直线,计算出2类键合位点的离解常数和最大表观键合常数。高亲和力结合位点的离解常数Kd1=0.961 mmol/L,Qmax1=19.79 μmol/g;低亲和力结合位点:Kd2=0.101 mmol/L,Qmax2=51.09 μmol/g。
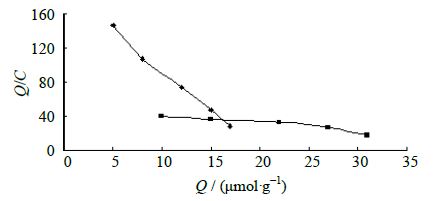
|
图 5 MIP的Scathard方程曲线 Fig.5 Scatchard equation curves of MIP |
本实验以黄酮类化合物高良姜素为模板分子,分别采用乙腈、丙酮、四氢呋喃为致孔剂,丙烯酰胺为功能单体,以EGDMA为交联剂,制备了一系列MIP,并通过电镜扫描、红外光谱对GMIP进行性能表征。运用平衡结合试验研究了GMIP的特征吸附性。Scathard模型分析表明,在本实验所研究的浓度范围内,GMIP对高良姜素的吸附量明显高于NMIP,说明GMIP具有与模板分子相匹配的空穴结构,因而能有效地选择性结合模板分子。证实了所合成GMIP对高良姜素具有特异的选择性识别性能,而NMIP无此分子选择性。本实验的研究结果对从复杂的天然产物中高效分离富集高良姜素具有一定的理论指导意义。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | Zhang Y F, Shi C H. The Extracting techniques and analysis methods for flavonoids in plant[J]. J Anal Sci, 2009, 25(1): 102-107. |
| [3] | 李彩君. 高良姜质量标准研究 [D]. 广州: 广州中医药大学, 2000. |
| [4] | 张文静, 黄启来, 华子春. 高良姜素的生物学活性研究进展[J]. 中国医药生物技术, 2012, 7(4): 294-297. |
| [5] | 霍仕霞, 彭晓明, 高 莉, 等. 不同质量分数高良姜素对人黑色素瘤A375细胞黑素合成及相关基因表达的影响[J]. 中草药, 2014, 45(2): 244-249. |
| [6] | 徐 静, 曹学丽, 尹 鹭, 等. 逆流色谱与硅胶柱色谱相结合分离纯化高良姜中高良姜素[J]. 食品科学, 2013, 34(4): 55-58. |
| [7] | 侯红瑞, 陈 玲, 冯毅凡, 等. 大孔吸附树脂分离纯化高良姜黄酮类化合物的研究[J]. 食品科学, 2007, 28(10): 258-260. |
| [8] | 谭天伟. 分子印迹技术及应用 [M]. 北京: 化学工业出版社, 2010. |
| [9] | 蒋旭红, 吴嫦秋, 刘展眉. 茶碱分子印迹聚合物微球的合成及其性能研究[J]. 中草药, 2013, 44(15): 2055-2058. |
| [10] | 李小燕, 仝海娟, 雷福厚, 等. 青蒿素分子印迹聚合物分子识别性研究[J]. 中草药, 2012, 43(4): 795-798. |
| [11] | 小宫山真. 分子印迹学—从基础到应用 [M]. 吴世康, 汪鹏飞, 译. 北京: 科学出版社, 2006. |
| [12] | 马秀玲, 陈日耀, 郑 曦, 等. 柚皮苷分子印迹传感器的制备与应用[J]. 分析化学, 2010, 38(1): 100-104. |
| [13] | 郭秀春, 李欢欢, 周文辉. 染料木素分子印迹聚合物的制备及其识别性能[J]. 化学研究, 2013, 24(3): 252-255. |
| [14] | 冯建涌. 长春碱分子印迹聚合物的制备、表征及性能评价研究 [D]. 广州: 南方医科大学, 2007. |
| [15] | 周媛媛, 孟子晖, 董美伶. 分子印迹技术在天然产物有效成分分离纯化中的应用[J]. 色谱, 2009, 27(3): 359-363. |
| [16] | 李小燕, 雷福厚, 黄安宝, 等. 以改性松香为交联剂的盐酸川芎嗪分子印迹聚合物吸附性能研究[J]. 化学研究与应用, 2009, 21(10): 1397-1403. |
| [17] | 雷福厚, 赵 慷, 李小燕, 等. 脱氢枞胺分子印迹聚合物的吸附性能研究[J]. 精细化工, 2010, 27(1): 11-15. |
| [18] | Pauling L J. A theory of the structure and process of formation of antibodies[J]. J Am Chem Soc, 1940, 62(3): 2643-2657. |
 2014, Vol. 45
2014, Vol. 45


