2. 中山大学化学化工学院, 广东 广州 510275;
3. 中山大学生命科学学院, 广东 广州 510275
2. School of Chemistry and Chemical Engineering, Sun Yat-sen University, Guangzhou 510275, China;
3. School of Life Science, Sun Yat-sen University, Guangzhou 510275, China
红树林生态系统是一种分布在热带、亚热带潮间带具有海洋环境特有森林类型的木本植物群落,以其为主体,包括海洋微生物、无脊椎动物、鸟类、哺乳动物等共同形成了一个具有显著生态价值的高产出的生态系统[1]。海洋真菌是海洋微生物的一个重要成员,特别是南海红树林来源的内生真菌,在过去几十年的真菌次级代谢产物的相关研究中已显示出能够产生多种多样的新颖的活性代谢产物的能力,一系列结构新颖的或药理活性良好的化合物从中被发现[2, 3, 4]。海洋真菌的活性代谢产物也因此而成为重要的新型药物来源之一,成为了又一个天然药物资源的巨大宝库。由于红树林中的一些药用植物与内生真菌之间存在着互利共生的关系,通过研究一些植物中具有很好药理活性的化学成分,发现这
些化学成分其实就是与其共生的内生真菌的代谢产物。基于这种思路,为了寻找结构新颖且具有药理活性的天然产物,本研究对一株采自于海口的老鼠簕内生真菌黄灰青霉菌Penicillium aurantiogriseum 299及其代谢产物进行了研究。老鼠簕Acanthus ilicifolius L. 是爵床科老鼠簕属的植物,主要分布在潮间带、海滨和海岸地带,是红树林的一种重要药用植物,其本身味淡、性寒,根和全株可入药,具有凉血清热、散痰积、解毒止痛的功效[5],现代关于老鼠簕的药理研究,还发现其具有保肝和抗氧化、抗肿瘤的作用[6, 7]。
本研究从海口采样得到老鼠簕样本,对与其共生的内生真菌进行分离纯化,得到P. aurantiogriseum 299,真菌经放大培养后的初提物经高效液相色谱指纹图谱及TLC分析发现P. aurantiogriseum 299的次级代谢产物非常丰富,采用正反相硅胶、凝胶柱色谱法和高效液相色谱法对其次级代谢产物进行了分离纯化,最终得到了4个化合物,经波谱技术确定分子结构,分别为aurantiogrisidinol a/b(1a/1b)、4-(2′-羟基-丁炔氧基) 苯甲酸 [4-(2′-hydroxybutynoxy)-benzoic acid,2]、(S)-penipratynolene(3)和aurantiamine(4)。其中化合物1a/1b为新化合物,化合物2为首次从青霉菌中分离得到。
1 仪器与材料Bruker AVANCE 400和Bruker AVANCE 500型核磁共振波谱仪(瑞士Bruker公司),LC1620型高效液相色谱仪(上海舜宇恒平科学仪器有限公司),MAT95XP型高分辨质谱仪(美国Thermo公司),ZAB—HS型双聚焦磁质谱仪(FAB,英国VG公司),旋光仪为ADP440型(英国B+S公司)。
薄层色谱硅胶GF254、柱色谱硅胶为青岛海洋化工厂产品;Sephadex LH-20凝胶(GE healthcare);所用试剂均为分析纯,广州化学试剂厂。
2 菌种来源和菌种的发酵培养红树林内生真菌P. aurantiogriseum 299菌种采自海口老鼠簕,由中山大学生命科学学院提供。该真菌菌种由中山大学生命科学学院陆勇军教授提供并鉴定为黄灰青霉菌。菌种在4 ℃条件下保存于中山大学化学化工学院。菌种放大培养时采用GYT培养基进行摇种,发酵培养基采用大米固体培养基:1 000 mL三角瓶,60 mL大米,60 mL培养液(粗海盐30 g/L,水溶液pH 7.0),经120 ℃(0.1 MPa)高温灭菌制得。
3 提取与分离大米培养基经120 ℃(0.1 MPa)高温灭菌25 min后接种,每瓶接种5 mL菌种培养液,共接种60瓶。接种后的大米培养基在28 ℃室温条件下静置培养28 d后,用甲醇进行3次浸泡,滤过收集甲醇相,经减压浓缩后,用醋酸乙酯反复萃取3次,收集醋酸乙酯相,减压浓缩得到粗提物。醋酸乙酯相粗提物采用柱色谱方法用石油醚-醋酸乙酯体系、醋酸乙酯-甲醇体系进行梯度洗脱,收集各极性段组分,再进一步通过正反相硅胶、凝胶柱色谱、HPLC法和重结晶等方法对其进行纯化,得到化合物1a/1b(2.5 mg)、2(24.5 mg)、3(3.4 mg)、4(23.2 mg)。
4 结构鉴定化合物1a/1b:淡黄色油状液体,HR-ESI-MS m/z: 421.223 48 [M+H]+,(C23H33O7,计算值为421.222 08),确定其分子式为C23H32O7。结合1H-NMR (500 MHz,CD3OD) 和13C-NMR (125 MHz,CD3OD) 谱图数据中可以看出,化合物1a/1b中明显包含2个化合物。由于HR-ESI-MS只有一个相对分子质量结果,1H-和13C-NMR谱中又能看到化学位移非常接近的两两相交重叠的信号峰,故推测化合物1a/1b中存在含有手性碳或不饱和碳的2个同分异构体,因为手性碳或不饱和碳的构型不同造成2个同分异构体化合物的氢和碳在1H-和13C-NMR谱中的化学位移存在细微差异。13C-NMR谱中完全重叠的信号峰有δ 166.6 (C-1),164.6 (C-5),88.7 (C-2),78.3 (C-6),57.5 (C-23),22.1 (C-20),13.9 (C-18),13.2 (C-19),10.3 (C-16);1H-NMR谱中δ 5.71 (H-11),5.67 (H-2),4.26 (H-7),1.45 (H-18) 的信号峰均完全重叠。1H-和13C-NMR谱中不能完全重叠的信号峰在表 1中已分别列出。1H-NMR谱中高场区存在7组甲基信号峰,1组是双峰δ 1.16 (3H,d,J = 6.8 Hz),其余组均为单峰 [δ (2.08,2.07),1.73,(1.67,1.66),1.45,(1.38,1.37),1.35],结合碳、氢谱中的化学位移(表 1)可以看出化合物1a/1b中存在6个甲基和1个甲氧基。13C-NMR谱中δ 166.6 (C-1),137.8/137.7 (C-8),133.9/133.6 (C-9),139.7/139.6 (C-10),130.2/129.8 (C-11) 说明化合物1a/1b中存在一个酯羰基碳和4个共轭双键碳;δ 75.3/75.2 (C-6),81.7/81.6 (C-12),68.6 (C-14),78.3 (C-15) 为季碳。
根据HSQC结果确定化合物1a/1b中与碳直接相连的质子,见表 1。1H-1H COSY可以看出δ 5.91(H-9) 与δ 1.37 (H-19) 耦合,δ 5.71 (H-11) 与δ 1.73 (H-21) 耦合,δ 4.05 (H-15) 与δ 1.16 (H-22) 耦合。HMBC显示δ 3.92 (H-23) 与δ 174.2 (C-3) 相关,δ 5.67 (H-2) 与δ 174.2 (C-3),166.6 (C-1) 相关,δ 2.08 (H-16) 与δ 174.2 (C-3),110.9 (C-4)、164.6 (C-5) 相关,再结合H、C的化学位移值,推断化合物1a/1b有1个具有共轭双烯结构的六元内酯环A,甲氧基在3位取代,4位有1个甲基取代。δ 3.57 (H-13) 与δ 81.7 (C-12),68.6 (C-14) 相关,δ 1.45 (H-18) 与δ 68.6 (C-14),78.3 (C-15) 相关,δ 1.16 (H-22) 与δ 78.3 (C-15) 相关,δ 4.05 (H-15) 与δ 81.7 (C-12)、68.8 (C-13),68.6 (C-14) 相关,结合H、C的化学位移值分析出化合物1a/1b具有1个含氧的五元环B,且有2个甲基在14、15位取代。再根据HMBC测试结果分析其他位的C、H相关关系(图 1),结合化学位移值,并参考文献报道[8],可以推测出化合物1a/1b是与verrucosidinol具有相似结构的同分异构体混合物,通过数据对比发现化合物1a/1b与所报道的化合物不同点在于,δ 5.67 (1H,s) 多出1个双键CH信号峰,在δ 10.2少了1个甲基信号峰,2位碳上的季碳信号峰消失,多出1个δ 88.7 (C-2) 的双键CH信号峰。最终鉴定化合物1a/1b的平面结构与2位去甲基的verrucosidinol平面结构一致,是新化合物,命名为aurantiogrisidinol a/b。
|
|
表 1 化合物1a/1b的核磁数据 Table 1 NMR data of compound 1a/1b |
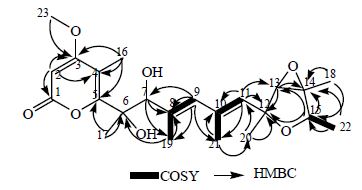 | 图 1 化合物1a/1b主要的HMBC和COSY相关性Fig. 1 KeyHMBC and COSY correlations of compound 1a/1b |
化合物2:白色粉末,EI-MS m/z: 206 [M]+,分子式为C11H10O4。1H-NMR (400 MHz,CD3OD) δ: 7.98 (2H,d,J = 8.3 Hz,H-2,6),7.03 (2H,d,J = 8.3 Hz,H-3,5),4.70 (1H,m,H-2′),4.20~4.07 (2H,m,H-1′),2.92 (1H,s,H-4′);13C-NMR (100 MHz,CD3OD) δ: 169.9 (C-7),164.0 (C-4),133.0 (C-2),133.0 (C-6),124.7 (C-1),115.5 (C-3),115,5 (C-5),83.0 (C-3′),75.2 (C-4′),73.1 (C-1′),61.7 (C-2′)。以上数据与文献报道基本一致[9],故鉴定化合物2为4-(2′-羟基-丁炔氧基) 苯甲酸。化合物2对枯草芽孢杆菌(ATCC 6051)生长表现出一定的抑制活性[9]。
化合物3:无色针晶(甲醇),[α]28.4D +47.25°(c 0.15,EtOH),EI-MS m/z: 220 [M]+,分子式为C12H12O4。1H-NMR (500 MHz,CD3COCD3) δ: 7.96 (2H,m,H-2,6),7.07 (2H,m,H-3,5),4.92 (1H,brd,J = 5.8 Hz,2′-OH),4.74 (1H,m,H-2′),4.20 (1H,dd,J = 9.9,8.9 Hz,H-1′a),4.18 (1H,dd,J = 9.8,11.2 Hz,H-1′b),3.84 (3H,s,H-8),2.97 (1H,d,J = 2.2 Hz,H-4′);13C-NMR (125 MHz,CD3COCD3) δ: 166.9 (C-7),163.5 (C-4),132.3 (C-2,6),123.9 (C-1),115.4 (C-3,5),83.5 (C-3′),74.8 (C-4′),72.8 (C-1′),61.3 (C-2′),52.1 (C-8)。以上数据与文献报道基本一致[10],故鉴定化合物3为 (S)-penipratynolene。化合物3对白色念珠菌Candida albicans NCPF3153和新型细球菌Cryptococcus neoformans ATCC90112生长表现出较弱的抑制活性[11]。
化合物4:白色固体粉末,ESI-MS m/z: 301 [M-H]-,分子式为C16H22N4O2。1H-NMR (500 MHz,DMSO-d6) δ: 12.3 (1H,brs,H-12),11.86 (1H,s,H-1),8.25 (1H,d,J = 2.3 Hz,H-2),7.81 (1H,s,H-6),6.70 (1H,s,H-9),6.06 (1H,dd,J = 17.4,10.5 Hz,H-17),5.07 (2H,m,H-18),3.91 (1H,t,J = 2.8 Hz,H-10),2.16 (1H,dept,J = 7.0,3.0 Hz,H-13),1.42 (6H,s,19,20-CH3),0.94 (3H,d,J = 7.0 Hz,14-CH3),0.84 (3H,d,J = 6.8 Hz,15-CH3);13C-NMR (125 MHz,DMSO-d6) δ: 164.8 (C-11),159.5 (C-8),145.7 (C-17),136.5 (C-5),134.3 (C-2),131.6 (C-4),123.9 (C-7),111.9 (C-18),103.3 (C-6),60.1 (C-10),37.4 (C-16),33.3 (C-13),27.9 (C-19,20),18.1 (C-14),16.6 (C-15)。以上数据与文献报道基本一致[12],故鉴定化合物4为aurantiamine。化合物4对豆炭疽病菌生长表现出一定的抑制活性[13]。
| [1] | Hyde K D, Alias S A. Biodiversity and distribution of fungi associated with decomposing Nypa fruticans [J]. Biodiver Conser, 2000, 9(3): 393-402. |
| [2] | Lin Y C, Shao Z Y, Jiang G C, et al. Penicillazine, a unique quinolone derivative with 4H-5, 6-dihydro-1, 2-ox-azine ring system from the marine fungus Penicillium sp. (Strain 386) from the South China Sea [J]. Tetrahedron, 2000, 56(49): 9607-9609. |
| [3] | Huang Z J, Cai X L, Lin Y C, et al. Chemistry and weak antimicrobial activities of phomopsins produced by mangrove endophytic fungus Phomopsis sp. ZSU-H 76 [J]. Phytochemistry, 2008, 69(7): 1604-1608. |
| [4] | Chen G Y, Lin Y C, Wen L, et al. Two new metabolites of a marine endophytic fungus (No. 1893) from an estuarine mangrove on the South China Sea coast [J]. Tetrahedron, 2003, 59(26): 4907-4909. |
| [5] | 彭 兴, 龙盛京. 老鼠簕的化学成分研究 [J]. 中草药, 2006, 37(7): 971-973. |
| [6] | Babu B H, Shylesh B S, Padikkala J, et al. Antioxidant and hepatoprotective effect of Acanthus ilicifolius [J]. Fitoterapia, 2001, 72(3): 272-277. |
| [7] | Babu B H, Shylesh B S, Padikkala J, et al. Tumour reducing and anticarcinogenic activity of Acanthus ilcifolius in mice [J]. J Ethnopharmacol, 2002, 79(1): 27-33. |
| [8] | Yu K, Ren B, Wei J L, et al. Verrucisidinol and verrucosidinol acetate, two pyrone-type polyketides isolated from a marine derived fungus, Penicillium aurantiogriseum [J]. Marine Drugs, 2010, 8(11): 2744-2754. |
| [9] | Hyuncheol O, Dale C S, James B G., et al. New bioactive rosigenin analogues and aromatic polyketide metabolites from the freshwater aquatic fungus massarina tunicat [J]. J Nat Prod, 2003, 66(1): 73-79. |
| [10] | Jian Y J, Wu Y K. On the structure of penipratynolene and WA [J]. Tetrahedron, 2010, 66(3): 637-640. |
| [11] | Saranyoo K, Vatcharin R, Kwanruthai T, et al. Chlorinated chromone and diphenyl ether derivatives from the mangrove-derived fungus Pestalotiopsis sp. PSU-MA69 [J]. Tetrahedron, 2012, 68(10): 2299-2305. |
| [12] | Thomas O L, Jens C F, Soren R J. Aurantiamine, a diketopiperazine from two varieties of Penicilium aurantiogriseum [J]. Phytochemistry, 1992, 31(5): 1613-1615. |
| [13] | Brenda V B, Nora I P, Gabriela M C. An Antifungal Tetrapeptide from the culture of Penicillium canescens [J]. Chem Biod, 2009, 6(8): 1178-1185. |
 2014, Vol. 45
2014, Vol. 45


