近年来的研究表明,白桦Betula platyphylla Suk. 三萜具有抗菌、抗病毒、抗肿瘤、调血脂、利胆和保肝等作用,特别是白桦酯醇、白桦酯酸等三萜物质作为天然药物在抗肿瘤和抗HIV活性上显示出了与其他药物不同的作用机制,靶向作用性更强,几乎无不良反应[1, 2, 3]。因此,白桦三萜作为药物化学中的先导化合物而逐步受到研究者的关注。
本课题组前期研究表明,白桦酯醇和齐墩果酸等三萜物质可以在白桦愈伤组织和悬浮细胞中积累,但质量分数极低[4, 5]。在调控植物细胞次生代谢物合成的研究中发现,诱导子可以迅速、专一和选择性地诱导植物多种次生代谢物的合成[6]。为此本研究室将蔗糖、果糖、葡萄糖、壳聚糖、水杨酸、茉莉酸甲酯、一氧化氮、多胺以及从白桦树皮中分离的真菌制备成真菌诱导子等生物和非生物诱导子添加到白桦悬浮培养体系中[7, 8, 9, 10, 11, 12, 13],发现这些诱导子均可以不同程度地促进三萜积累。但上述这些诱导子对白桦三萜的调控是否存在相互作用或因果关系还不清楚。为此,本研究将分析不同浓度的外源腐胺对白桦悬浮细胞内蔗糖量、果糖量、葡萄糖量、蔗糖合成酶活性、蔗糖磷酸合成酶活性以及三萜量的影响,初步探索腐胺诱导下白桦细胞内蔗糖代谢与三萜积累的关系,为揭示诱导子促进次生代谢物合成的积累奠定一定的理论基础。
1 材料与仪器白桦Betula platyphylla Suk. 取自东北林业大学白桦强化种子园5~7年生嫁接优树(接穗30年生),外植体取自其诱导的组培苗,由东北林业大学生命科学学院詹亚光教授鉴定。腐胺购于Solarbio公司。
HY—6A双层振荡器,恒温水浴锅,PH070A培养箱/干燥箱,UV—2800紫外分光光度检测器。
2 方法 2.1 白桦愈伤悬浮细胞的培养将白桦愈伤组织接种于B5液体培养基中,添加 0.1 mg/L 6-BA+0.01 mg/L TDZ,蔗糖质量浓度为20 g/L,pH 5.5~6.0,培养温度为(25±1)℃,光照强度2 000 lx,光照16 h/d,转速为120 r/min。每15天继代1次。
2.2 外源腐胺的添加将腐胺添加到培养8d的白桦悬浮培养体系中,使终浓度达到0.1、1、5 mmol/L,对照加入等体积无菌水,诱导6、12、24、48、96 h后取样,每个处理重复3次。
2.3 蔗糖、果糖和葡萄糖的测定[14] 2.3.1 反应液的制备称取0.1 g干样,置于10 mL的离心管中,加入80%乙醇4 mL,80 ℃水浴40 min,重复提取2次,合并提取液,提取液中加入0.1 g活性炭于80 ℃水浴脱色30 min,离心取上清液,然后定容至25 mL备用。
2.3.2 蔗糖的测定测定胞内蔗糖量时,取400 μL反应液,加入50 μL 2 mol/L NaOH,沸水浴5 min,冷却后加入2.8 mL 30% HCl和0.8 mL 0.1%间苯二酚,摇匀后置于80 ℃水浴10min,利用紫外分光光度计测定480nm处的吸光度(A)值;测定胞外(培养液中)蔗糖量时,取滤过脱色后的20 μL培养液,之后操作同“2.3.1”项。制作蔗糖标准曲线,回归方程Y=1.0669 X+0.036 6,R2=0.9928,在0~1 mg/mL内具有良好的线性关系。
2.3.3 果糖的测定测定胞内果糖量时,取80 μL反应液,加入2.8 mL 30% HCl和0.8 mL 0.1%间苯二酚,摇匀后置于80 ℃水浴10 min,利用紫外分光光度计测定480 nm处的A值;测定胞外(培养液中)果糖量时,取6 μL过滤脱色后的培养液,之后操作同“2.3.1”项。制作果糖标准曲线,回归方程Y=3.762 9 X+0.023 8,R2=0.9795,在0~0.25 mg/mL内具有良好的线性关系。
2.3.4 葡萄糖量的测定按照南京建成葡萄糖试剂盒说明书操作,试剂空白调零,测定510nm处的A值。
2.4 蔗糖磷酸合成酶活性的测定[15, 16] 2.4.1 酶液的提取称取1.0 g鲜样,加入5 mL提取缓冲液,冰浴研磨,滤过,取滤液3 mL透析(4 ℃),然后将酶液定容至5 mL。
2.4.2 酶活性的测定取50 μL酶粗提液,加入400 μL的酶反应液(果糖-6-磷酸)和100 μL UDPG,加水至1 mL,30 ℃水浴10min,立刻放入沸水浴中3 min终止反应。加入2 mol/L NaOH 100 μL,沸水浴10 min,冷却至室温,加入3.5 mL 30% HCl和1 mL 0.1%间苯二酚,充分摇匀后80 ℃水浴10min,冷却后测定480 nm处的A值。根据所测得的A值计算蔗糖磷酸合成酶活性。
2.5 蔗糖合成酶活性的测定[14, 15]酶液的提取同“2.4.1”项。取50 μL酶液,加入400 μL的酶反应液(果糖)和100 μL尿苷二磷酸葡萄糖(UDPG),加水至1 mL,30 ℃水浴10min,立刻放入沸水浴中3 min终止反应。加入0.1 mL 2 mol/L的NaOH,沸水浴10 min,冷却至室温,再加入30% HCl 3.5 mL和0.1%间苯二酚1 mL,摇匀后80 ℃水浴10~15 min,冷却后测定480 nm处的A值,根据A值计算蔗糖磷酸合成酶活性。
2.6 三萜的测定三萜的提取采用超声波醇提法,利用紫外分光光度计法测定其量[17, 18]。将白桦悬浮细胞烘干至恒定质量后,研磨成粉末状,称量0.05 g样品,加入2 mL 95%乙醇过夜浸提(重复3次),将提取液合并后于70 ℃水浴1 h,再超声(10 kHz)提取40 min,静置20 min后滤过,取上清溶液70 ℃水浴蒸干,加入200 μL 5%的香草醛-冰醋酸溶液和800 μL高氯酸,继续70 ℃水浴反应15 min,反应结束后迅速冷却,醋酸乙酯定容到5 mL,混合均匀。空白对照加入同样试剂。用紫外分光光度计测定551nm处的A值。用齐墩果酸对照品制作标准曲线,回归方程为Y=0.022 2 X+0.000 9,R2=0.9956,在0~0.030 mg/mL内具有良好的线性关系。
3 结果与分析 3.1 腐胺对白桦悬浮细胞和培养液中蔗糖量的影响将0.1、1、5 mmol/L的腐胺分别添加到培养8 d的白桦悬浮培养体系中处理6~96 h后,采用间苯二酚比色法分析腐胺处理对白桦细胞和培养液中蔗糖量的影响。研究发现,腐胺处理提高了白桦细胞内蔗糖的量,而培养液中的蔗糖量,除0.1 mmol/L和5 mmol/L处理6 h时分别提高26.16%和67.31%外,其他处理均降低了培养液中的蔗糖量,且影响程度与腐胺浓度和处理时间相关(图 1)。其中,5 mmol/L腐胺处理6 h时,白桦悬浮细胞内的蔗糖增加幅度最大,比对照增加了169.41%。而培养液中的蔗糖量在腐胺处理24 h时降低幅度最大,比对照降低了81.94%。
 | 图 1 腐胺处理对白桦悬浮细胞(A)和培养液(B)中蔗糖Fig. 1 Effect of putrescine on sucrose content in suspension cells (A) and media (B) in birch |
由图 2-A可知,在处理的6~48 h内,0.1 mmol/L 腐胺处理后白桦悬浮细胞内的果糖量基本呈增加趋势,其中处理6 h时增长率最高,比对照增加了14.09%。而1 mmol/L和5 mmol/L 腐胺处理后,悬浮细胞内的果糖量基本呈降低趋势,其中,1 mmol/L腐胺处理24 h时降低幅度最大,比对照降低了32.91%。而培养液中的果糖量,除处理12 h时比对照略有增加外,其他处理均降低了培养液中果糖的量(图 2-B),其中1 mmol/L腐胺处理96 h时降低幅度最大,比对照降低了66.45%。
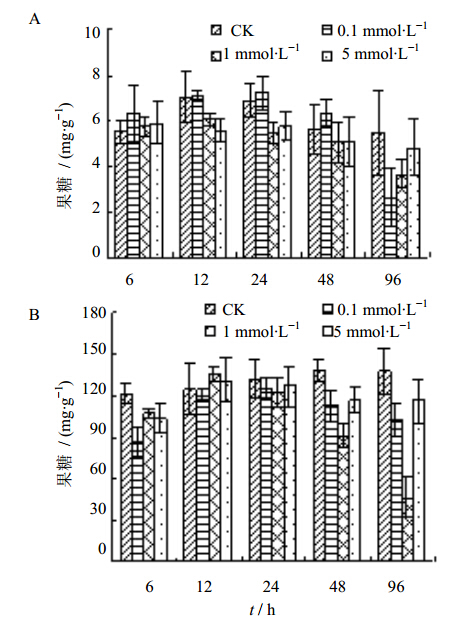 | 图 2 腐胺处理对白桦悬浮细胞(A)和培养液(B)中果糖Fig. 2 Effect of putrescine on fructose content in suspension cells (A) and media (B) in birch |
与对照相比,悬浮细胞内葡萄糖量在腐胺处理的6~96 h内呈先增加后降低趋势(图 3-A),其中0.1 mmol/L 腐胺处理6 h时增加幅度最大,比对照增加了45.96%。1 mmol/L 腐胺处理24 h时降低幅度最大,比对照降低了46.04%。
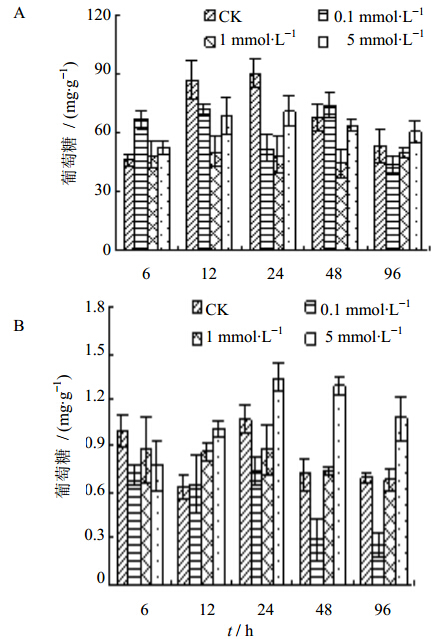 | 图 3 腐胺处理对白桦悬浮细胞(A)和培养液(B)中葡萄糖量的影响Fig. 3 Effect of putrescine on glucose content in suspension cells (A) and media (B) in birch |
由图 3-B可知,0.1mmol/L腐胺处理后,培养液中的葡萄糖量随处理时间的延长呈降低趋势,处理96 h时降低幅度最大,比对照降低了62.43%。1mmol/L 腐胺处理6、24 h后,培养液中的葡萄糖量低于于对照,处理48 h后恢复到对照水平。5 mmol/L 腐胺处理后,除处理6 h比对照降低了22.74%外,培养液中的葡萄糖量均呈增加趋势,其中在处理48 h时增加幅度最大,比对照增加了81.24%。
3.4 腐胺对白桦悬浮细胞蔗糖合成酶活性的影响从图 4可以看出,在腐胺处理6~96 h内,0.1 mmol/L和1 mmol/L腐胺增加了蔗糖合成酶活性,而5 mmol/L腐胺降低了蔗糖合成酶活性。其中,0.1 mmol/L腐胺处理96 h时蔗糖合成酶活性增幅最大,比对照增加了80.53%;1 mmol/L腐胺处理24 h时蔗糖合成酶活性增幅最大,比对照增加了63.77%;5 mmol/L腐胺处理96 h时蔗糖合成酶活性降低幅度最大,比对照降低了31.04%。
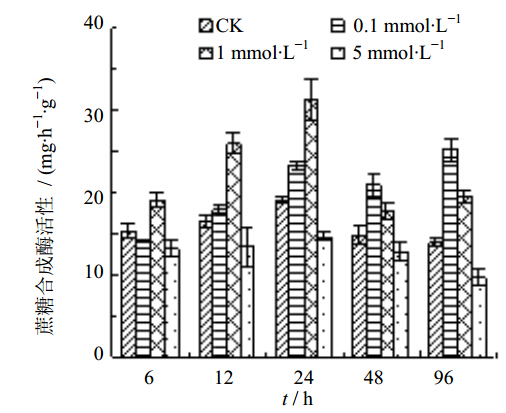 | 图 4 腐胺处理对蔗糖合成酶活性的影响Fig. 4 Effect of putrescine on sucrose synthase activity |
由图 5可知,在腐胺处理的6~96 h,除0.1 mmol/L腐胺处理后的蔗糖磷酸合成酶活性与对照基本相同外,1 mmol/L和5 mmol/L的腐胺均不同程度地增加了蔗糖磷酸合成酶的活性。其中,1 mmol/L腐胺处理6 h时蔗糖磷酸合成酶的活性增幅最大,比对照增加了439.45%。
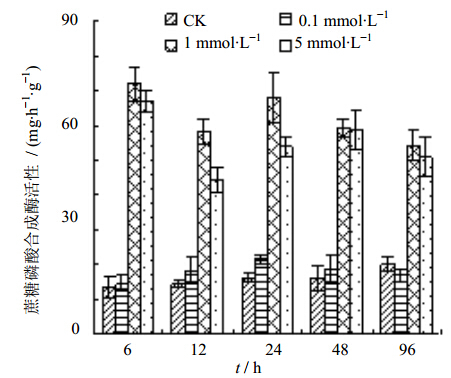 | 图 5 腐胺处理对蔗糖磷酸合成酶活性的影响Fig. 5 Effect of putrescine on sucrose phosphate synthase activity |
0.1、1、5 mmol/L 腐胺处理6~96 h后,白桦悬浮细胞干质量、三萜量和产量的变化见表 1。除5 mmol/L 腐胺处理降低白桦悬浮细胞的干质量外,0.1 mmol/L和1 mmol/L腐胺处理均增加了白桦悬浮细胞的干质量。其中,0.1 mmol/L腐胺处理96 h时干质量增幅最大,比对照增加了35.78%。腐胺处理均不同程度地影响了三萜的合成。其中,0.1 mmol/L腐胺处理12 h时,三萜量增幅最高,为对照的144.23%;1 mmol/L腐胺处理12h时三萜量和产量增幅最大,分别比对照增加了117.17%和125.10%。而5 mmol/L腐胺处理下三萜量随着处理时间的延长而下降,在处理96 h时三萜量降幅最大,比对照降低了51.34%。
| 表 1 腐胺对白桦悬浮细胞干质量和三萜量的影响 Table 1 Effect of putrescine on dry weight and triterpenoid content in suspension cells of birch |
由表 2可以看出,1 mmol/L腐胺处理12 h时三萜量和产量增幅最大。为了进一步明确腐胺与蔗糖对白桦三萜积累的关系,将不同质量浓度(5、10、20、40 g/L)的蔗糖溶液加入1 mmol/L腐胺处理的白桦悬浮体系中,培养12 h,分析腐胺、蔗糖、腐胺与蔗糖共同处理对白桦三萜积累的影响。研究发现,5~40 g/L蔗糖处理12 h后,悬浮细胞干质量的积累量均增加了,其中40 g/L蔗糖处理增加幅度最大,比对照增加了43.04%。腐胺与蔗糖共同处理后,悬浮细胞的干质量变化趋势与蔗糖处理相同,其中腐胺与40 g/L蔗糖处理增加幅度最佳,比对照增加了47.18%。
| 表 2 腐胺和蔗糖对白桦悬浮细胞干质量和三萜量的影响 Table 2 Effects of putrescine and sucrose on dry weight and triterpenoid content in suspension cells of birch |
5~40 g/L蔗糖处理12 h后,悬浮细胞中的三萜量和产量呈增加趋势。其中20 g/L蔗糖处理增加幅度最大,分别比对照增加了52.16%和103.93%。腐胺与蔗糖共同处理后,1 mmol/L腐胺和5 mg/L蔗糖共同处理后三萜量为34.99 mg/g,比对照增加113.22%,比腐胺单独处理提高27.37%,但是腐胺和其他浓度蔗糖共同处理后,三萜量和产量呈下降趋势,腐胺与40 g/L蔗糖处理后,三萜量比对照降低了52.58%。
4 讨论多胺是一类植物内广泛存在的低相对分子质量脂肪胺,常见的游离态多胺主要包括腐胺、精胺、亚精胺,参与调控植物的生长发育,清除自由基,保护植物抵御非生物胁迫[14, 19]。本课题组前期的研究也发现,外源多胺可以促进白桦悬浮细胞中三萜的合成,其中腐胺促进效果最佳[5];蔗糖作为植物生长发育和基因表达的重要调节因子,不仅是能量来源和结构物质,而且在信号转导中具有初级信使作用[12, 20]。Koops等[21]和王春丽等[22]采用同位素U-14C示踪法证明蔗糖被优先整合进入三萜烯中。那么,腐胺促进白桦三萜合成中,蔗糖除了能量与结构物质外,蔗糖代谢与三萜积累的关系是本研究想要探索的科学问题。
本研究发现,腐胺处理提高了白桦悬浮细胞内的蔗糖量,而降低了培养液中的蔗糖量,且影响程度与腐胺浓度和处理时间相关。其中,5 mmol/L 腐胺处理6 h时,白桦悬浮细胞内的蔗糖增加幅度最大,比对照增加了169.41%。与蔗糖相比,腐胺对细胞内外果糖和葡萄糖量的影响程度较小,除了处理6 h细胞内的果糖和葡萄糖增加外,其余处理时间细胞内的果糖和葡萄糖量基本呈降低趋势。
为了进一分析腐胺处理后细胞内外蔗糖、果糖和葡萄糖量变化的原因,本课题组分析了植物中与蔗糖代谢密切相关的酶蔗糖磷酸合成酶和蔗糖合成酶。研究发现,除0.1 mmol/L腐胺对蔗糖磷酸合成酶的活性基本无影响外,1 mmol/L和5 mmol/L的腐胺均不同程度地增加了蔗糖磷酸合成酶的活性。蔗糖磷酸合成酶是合成蔗糖的关键酶之一,腐胺处理后蔗糖磷酸合成酶活性的变化趋势与细胞内蔗糖量的变化趋势相同,进一步证实了腐胺可以增加细胞内蔗糖的量;在腐胺处理后,0.1 mmol/L和1 mmol/L腐胺增加了蔗糖合成酶活性,而5 mmol/L腐胺降低了蔗糖合成酶活性;蔗糖合成酶是主要的蔗糖分解代谢酶,腐胺处理后蔗糖合成酶活性提高了,而蔗糖分解的次级产物果糖和葡萄糖却没有大幅度增加。其原因可能是腐胺通过其他途径调控了果糖和葡萄糖代谢,或蔗糖被优先整合进入其他代谢中,还需进一步研究。
为了明确蔗糖与三萜积累的关系,分析了蔗糖、腐胺以及腐胺与蔗糖共同处理后三萜量变化,发现蔗糖浓度在一定范围内对三萜合成起到促进作用;1 mmol/L腐胺和5 mg/L蔗糖共同处理后三萜量为34.99 mg/g,是腐胺单独处理后三萜量的1.27倍。而1mmol/L腐胺和20 mg/L蔗糖共同处理反而抑制了三萜的合成。上述结果初步说明腐胺和其诱导的蔗糖在一定程度上对三萜积累起到协同促进作用,这同时也解释了5 mmol/L腐胺处理后蔗糖量大幅度上升,但是三萜积累下降的现象。
外源腐胺可以促进白桦悬浮细胞中蔗糖和白桦三萜的积累,且腐胺通过促进蔗糖磷酸合成酶活性而诱导产生的蔗糖在一定程度上介导了三萜的合成,可能是蔗糖自身激发了某种信号途径,或是腐胺在诱导蔗糖合成的过程中激发了某种信号途径,或是腐胺和蔗糖在诱导白桦三萜合成积累过程中存在某种交互作用。但是高浓度的蔗糖对三萜合成的抑制机制以及蔗糖通过哪些下游途径调控三萜的合成仍需要进一步的研究。
| [1] | Fan G Z, Li X C, Wang X D, et al. Chitosan activates defense responses and triterpenoid production in cell suspension cultures of Betula platyphylla Suk. [J]. Afr J Biotechnol, 2010, 9(19): 2816-2820. |
| [2] | 范桂枝, 王 博, 詹亚光, 等. 光处理对白桦愈伤组织生长及其三萜物质积累的影响 [J]. 东北林业大学学报, 2009, 37(1): 1-3. |
| [3] | 徐 军, 王晋萍, 钱辰旭, 等. 白桦脂酸的研究进展 [J]. 生命科学, 2011, 23(5): 503-510. |
| [4] | 范桂枝, 翟俏丽, 于海娣, 等. 白桦细胞悬浮培养产三萜及其营养成分消耗的动态 [J]. 林业科学, 2011, 47(1): 62-67. |
| [5] | 王晓东. PAs、NO和H2O2在真菌促进白桦三萜合成中的对话研究 [D]. 哈尔滨: 东北林业大学, 2012. |
| [6] | 翟俏丽. 拟茎点霉 (Phomopsis) 真菌诱导子促进白桦悬浮细胞中三萜合成机理的初步研究 [D]. 哈尔滨: 东北林业大学, 2011. |
| [7] | Walden R, Cordeiro A, Tiburcio A F. Polyamines: small molecμLes triggering pathways in plant growth and development [J]. Plant Physiol, 1997, 113: 1009-1013. |
| [8] | 薛应龙. 植物生理学实验手册 [M]. 上海: 上海科学技术出版社, 1985. |
| [9] | Kohler J, Komor E, Thom M, et al. Activity of sucrose-phosphate synthase in sugar cane leaves [J]. Phytochemistry, 1988, 27: 1605-1608. |
| [10] | Mion D, Schaffer A A. Sucrose phosphate synthase, sucrosesynthase and invertaseactivities in developing fruit of Lycopersicon esculentum Mill, and the sucrose annumμLation Lycopersicon hirsutum Hubm. and Bonpl [J]. Plant Physiol, 1991, 95: 623-627. |
| [11] | 张 泽, 孙 宏. 高效液相色谱法测定白桦树皮中白桦酷醇的含量 [J]. 林产化学与工业, 2004, 24(l): 61-63. |
| [12] | Shrishailappa B, Wang H Q, Yu J T, et al. Significant improvement of taxane production in suspension cμLtures of Taxus chinensis by sucrose feeding strategy [J]. Process Biochem, 1999, 35: 479-483. |
| [13] | 马明媚, 詹亚光, 王晓东, 等. 腐胺与过氧化氢交互调控白桦三萜合成的初步研究 [J]. 中草药, 2013, 44(20): 2916-2922. |
| [14] | Panagiota F, Chrystalla A, Vasileios F. The nitricoxide donor sodium nitroprusside regμLates polyamine and proline metabolismin leaves of Medicago truncatμLa plants [J]. Free Radic Biol Med, 2013, 56: 172-183. |
| [15] | Shinde A N, Malpathak N, Fulzele D P. Optimized production of isoflavones in cell cultures of Psoralea corylifolia L. using elicitation and precursor [J]. Feeding Biotechnol Bioproc Eng, 2009, 14: 612-618. |
| [16] | Christen A A, Gibson D M, Bland J. Production of taxal or txaol likecompounds in all calture [J]. US Patent, 1991, 50: 190-193. |
| [17] | Ozawa R, Bertea C M, Foti M, et al. Exogenous polyamines elicit herbivore-induced volatiles in lima bean leaves: involvement of calcium, H2O2 jasmonic acid [J]. Plant Cell Physiol, 2009, 50(12): 2183-2199. |
| [18] | Suresh B, Thimmaraju R, Bhagyalakshmi N, et al. Polyamine and methyl jasmonate influenced enhancement of betalaine production in hairy root cultures of Beta vulgaris grown in a bubble column reactor and studies on efflux of pigments [J]. Process Biochem, 2004, 39: 2091-2096. |
| [19] | Walden R, Cordeiro A, Tiburcio A F. Polyamines: small molecμLes triggering pathways in plant growth and development [J]. Plant Physiol, 1997, 113: 1009-1013. |
| [20] | Dong H D, Zhong J J. Enhanced taxane productivity in bioreactor cμLtivation of Taxus chinensis cells by combining elicitation, sucrose feeding and ethylene incorporation [J]. Enzyme Microb Technol, 2002, 31: 116-121. |
| [21] | Koops A J, Italiaander E, Groeneveld H W. Triterpenoid biosynthesis in the seedling of Euphorbia lathyris L. from sucrose and amino acids [J]. Plant Sci, 1991, 74(2): 193-201. |
| [22] | 王春丽. 丹参中次生物质积累与可溶性糖代谢及激素关系的研究 [D]. 杨凌: 西北农林科技大学, 2012. |
 2014, Vol. 45
2014, Vol. 45


