实时荧光定量PCR(real-timefluorescence quantitative PCR,RT-PCR)是20世纪90年代兴起的一种准确、快速的核酸定量分析技术[1],是定量研究基因表达最为有效的方法之一[2, 3, 4]。它是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知浓度的样品进行定量分析[5]。它分为相对定量和绝对定量,在相对定量检测中,对来自不同样本中特定基因的mRNA表达量进行比较分析时,理想的条件是不同样品之间的起始细胞数目、RNA提取效率及目的基因扩增效率等都相同,但实际上这些条件不可能同时得到满足[6]。因此,需要同时对不同样本中的内参基因进行定量PCR,以此对目的基因的定量结果进行校正。内参基因通常是指在不同发育阶段和不同组织细胞中均恒定表达的管家基因,常用的内参基因有β-actin、GAPDH、UBC、Tub、TBP及ABL基因等。其中,β-actin基因作为内参基因被广泛使用,它是构成细胞骨架的主要组成成分,具有基因序列高度保守、mRNA表达量高且稳定的特点[7, 8, 9, 10, 11]。人参β-actin基因作为人参实时荧光定量PCR的内参基因尚未见报道,本研究根据GenBank中其他高等植物的β-actin基因保守区域设计一对引物,建立了人参β-actin基因的实时荧光定量PCR方法,为以β-actin基因作为内参基因进行人参功能基因的表达差异研究奠定基础。
1 材料与仪器 1.1 材料五年生人参取自吉林省抚松县抚南林场(42°03′06′′N、127°33′21′′ E),经吉林农业大学中药材学院杨利民教授鉴定为五加科植物人参 Panax ginseng C. A. Meyer。实验所用部位为人参主根。
1.2 主要试剂与仪器植物RNA提取试剂盒购自北京艾德莱生物科技有限公司,反转录试剂盒、2×PowerTaq PCR Mastermix、质粒提取试剂盒、凝胶回收试剂盒、DNA连接试剂盒等均购自北京百泰克生物科技有限公司,SYBR Premix ex Taq试剂盒、LB培养基购自宝生物工程(大连)有限公司,JM109感受态菌株购自北京鼎国生物技术有限公司。
荧光定量PCR仪(Mx3000P,美国);凝胶成像系统 [Tanon Gis 2010,天能科技(上海)有限公司];普通PCR扩增仪(Gene Amp 9700,西班牙);核酸蛋白质检测仪DU800(Beckman,美国);MDF—382E超低温冰箱(Sanyo,日本)。
2 方法 2.1 引物设计与合成通过对刺五加(KC469585)、陆地棉(AY305726)、葡萄(FQ383380)、桦树(FJ410442)、芍药(JX310002)、白杨(EF418792)、油桐(JQ680035)等几种植物的β-actin基因核苷酸序列进行同源性比较,找出高度保守区的片段,根据引物设计原则,利用DANMAN和Primer5.0生物软件设计一对特异性定量PCR引物F、R,用于扩增人参β-actin基因片段,推测目的片段的长度为140 bp左右。引物由生工生物工程上海有限公司合成,正向:5’-GGCATCACACTTTCTACAACG-3’,反向:5’-GGCAGGAACATTAAAGGTTTC-3’。
2.2 总RNA提取与反转录人参根部总RNA提取方法按照试剂盒说明书操作,并以提取的总RNA为模板,以Oligo-dT为引物,将RNA反转录合成cDNA,保存于-20 ℃。
2.3 β-actin基因目的片段扩增、克隆及鉴定 2.3.1 目的片段PCR扩增以反转录合成的β-actin cDNA为模板,进行普通PCR扩增。反应总体系为20 μL:ddH2O8 μL,2×Taq PCR Mastermix 10 μL,上下游引物各0.5 μL,反转录产物1 μL。PCR反应程序:94 ℃预变性3min;94 ℃变性30s,60 ℃退火30s,72 ℃延伸15s,进行33个循环,最后72 ℃延伸10min。取5 μL扩增产物在2%琼脂糖凝胶电泳上检测,目的片段回收和纯化按照回收试剂盒说明书操作。
2.3.2 克隆与转化将纯化产物与pMD20-TVector连接,总体系为10 μL:目的片段3μL,pMD20-T Vector 1 μL,ddH2O 1 μL,Solution I 5 μL,16 ℃反应30min。将连接产物转化到大肠杆菌JM109感受态细胞中,涂布于含X-gal和ITPG且具氨苄青霉素(Amp)抗性的LB琼脂平板培养基上,37 ℃倒置培养13~16 h至平皿上长出蓝白菌落。
2.3.3 阳性克隆的PCR鉴定及测序挑取白色菌落接种于LB(Amp)液体培养基中,37 ℃振荡培养过夜,以菌液为模板进行PCR扩增鉴定,并将PCR检测为阳性克隆的菌液送生工生物工程上海有限公司进行测序。
2.4 SYBRGreenI RT-PCR方法的建立
2.4.1 阳性对照品的制备含目的片段的重组质粒经PCR扩增和测序鉴定后,采用质粒提取试剂盒提取质粒,用核酸蛋白质检测仪检测并准确定量,换算出单位体积的拷贝数,即为β-actin阳性的对照品。
2.4.2 反应体系的优化采用SYBR Green I染料法,在Mx3000P荧光定量PCR仪上进行扩增和数据分析,以得到最小Ct值和最大的荧光值(ΔRn)为标准,分别对退火温度、引物浓度、循环条件(2步法和3步法)进行优化,确定最佳扩增条件。优化后的反应体系为25 μL:去离子水9.5 μL,SYBR Premix ex Taq12.5 μL,上下游引物各0.5μL,Rox ReferenceDye II 0.5 μL,cDNA 2 μL;反应条件:95 ℃预变性30s,95 ℃变性15s,60 ℃退火30s,72 ℃延伸15s,进行40个循环。
2.4.3 熔解曲线分析为排除引物二聚体及非特异性扩增产物对RT-PCR结果的影响,在PCR后进行熔解曲线分析以确定得到的产物是否为目的产物,温度以0.5℃/10s的速率从55 ℃缓慢递增到95 ℃,连续测定样品的荧光强度以获取熔解曲线。
2.4.4 标准曲线的建立以定量的阳性对照品进行10倍系列稀释作为模板,采用优化好的条件进行SYBR Green I荧光定量RT-PCR。
2.5 可重复性评价分别对5个不同浓度的阳性对照品及2个阴性对照品(以水为模板)在同一次扩增中进行4次重复测定,计算每个样品各反应管之间的批内变异系数;对上述样品分别进行4次测定(各相隔1周),计算同一样品每次测定结果之间的组间变异系数。
3 结果与分析 3.1 PCR扩增人参根部总RNA经反转录合成cDNA后,进行常规PCR后,得到约140bp大小的目的片段,与预期结果一致(图 1)。
 | 图 1 β-actin基因的RT-PCR结果Fig. 1 RT-PCR of β-actin gene |
回收目的片段进行T-A克隆,经转化大肠杆菌JM109,然后对阳性克隆菌液进行PCR扩增鉴定,电泳结果得到约140 bp左右的条带,与预期结果一致(图 2)。对β-actin基因阳性克隆进行测序,发现阳性克隆中含137 bp的外源碱基,经序列比对,证实与其他高等植物β-actin基因核苷酸序列同源性达到92%,说明重组质粒构建正确,可作为建立荧光定量RT-PCR方法的阳性对照品。
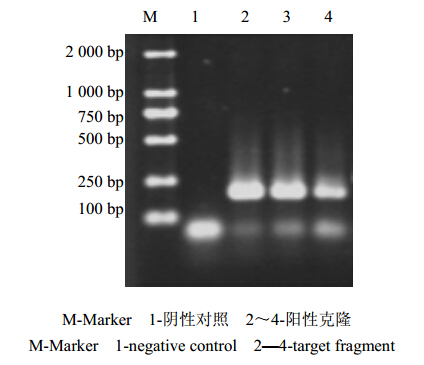 | 图 2 菌液PCR鉴定结果Fig. 2 PCR identification of bacteria liquid |
将荧光定量RT-PCR产物进行熔解曲线分析(图 3),β-actin基因片段在Tm=(84.51±0.01)℃处显示特异性单峰,说明扩增产物无引物二聚体及非特异性扩增,证实了引物设计的合理性和特异性。3.4 标准曲线的建立本实验β-actin阳性对照品原始质量浓度为14.14 μg/mL,换算成拷贝数即4.3×109拷贝/μL。将定量的阳性对照品进行10倍系列稀释,以优化好的条件进行荧光定量RT-PCR扩增,得到的扩增曲线(图 4)和标准曲线结果显示。以Ct值为纵坐标(Y),以稀释倍数的对数为横坐标(X)建立相对定量标准曲线,回归方程为Y=-3.3398 X+30.989。该方法检测的β-actin最低拷贝数为43拷贝/μL,在43~4.3×107拷贝/μL有良好的线性关系(R2=0.9953),扩增效率为99.3%。
 | 图 3 β-actin基因的熔解曲线Fig. 3 Melting curve of β-actin gene |
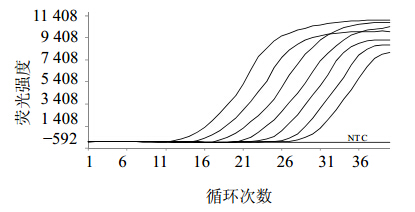 | 图 4 β-actin基因的扩增曲线Fig. 4 Amplification curve of β-actin gene |
对线性范围内的5个不同质量浓度进行了批内检测和批间检测,计算出组内变异系数和组间变异系数。结果显示,β-actin阳性对照质粒组内试验变异系数为0.58%~2.79%,组间试验变异系数为2.61%~4.41%,表明该方法具有良好的重复性。
4 讨论RT-PCR技术是分析目的基因转录水平最为敏感的方法,与传统的定量方法如Northernblotting、竞争性PCR、RT-PCR半定量检测相比,具有重复性好、灵敏度高、定量准确、速度快等优点,能对mRNA进行准确定量[12]。SYBR Green I是一种DNA结合染料,能非特异性地掺入到双链DNA中去,在游离状态下,SYBR Green I不发出荧光,但结合到双链DNA中以后,便可以发出荧光[13]。然而,由于其能与任意DNA双链结合,并可用于任意反应体系中,所以一旦反应体系中出现非特异性扩增,就会影响到定量结果的准确性与稳定性[14]。因此对引物的设计和反应体系的优化显得尤为重要。
RT-PCR分为绝对定量和相对定量,绝对定量是根据已知标准曲线来检测未知样品的精确拷贝数[15];相对定量只比较不同样本之间基因表达差异,不对基因表达水平进行精确的拷贝数计算。相对定量通常需要内参基因作为对照,以此对目的基因进行校正和标准化,进而减少不同样本间RNA提取效率、逆转录及扩增效率的差异对定量结果带来的误差,提高相对定量结果的可靠性和重复性。因此,内参基因在荧光定量RT-PCR技术对目的基因进行相对定量和定性分析中起着至关重要的作用。
β-actin基因常作为内参基因对定量结果进行校正,但目前尚未见到有关人参β-actin基因用于荧光定量PCR分析的报道。近年来,随着对人参各种功能基因的克隆和测序的完成,对这些基因在不同种组织细胞及不同个体中表达水平的定量分析,有助于阐明这些基因的功能及其与人参药效成分含量的关系,进而有利于选育优良品种,增加人们对人参主要药效成分生物合成途径的分子机制的认识。因此,为了给人参基因表达的定量分析提供必要的方法手段,本研究建立了基于SYBR Green I染料技术的人参β-actin基因RT-PCR方法。实验结果表明,所建立的方法具有用时短、高通量、扩增效率高、线性范围广及重复性强等优点,为β-actin作为内参基因对人参相关基因mRNA水平的荧光定量PCR分析提供了有力的方法学基础。
| [1] | Higuchi R, Dollinger G, Walsh P S, et al. Simultaneous amplification and detection of specific DNA sequences [J]. Biotechnology, 1992, 10(4): 413-417. |
| [2] | Dussault A A, Poullot M. Rapid and simple comparison of messenger RNA levels using real-time PCR [J]. Biol Proced, 2006, 8(1): 1-10. |
| [3] | Budhia S, Haring L F, Mcconnell I, et al. Quantitation of ovine cytokine mRNA by real-time RT-PCR [J]. J Immunol Methods, 2006, 309(1/2): 160-172. |
| [4] | Dallas P B, Gottardo N G, Firth M J, et al. Gene expression levels assessed by oligonucleotide microarray analysis and quantitative real-time RT-PCR-how well do they correlate [J]. BMC Genomics, 2005, 6(1): 59. |
| [5] | Montgomery R A, Dallman M J. Semi-quantitative polymerase chain reaction analysis of cytokine and cytokine receptor gene expression during thymic ontogeny [J]. Cytokine, 1997, 9(10): 717-726. |
| [6] | Radonic A, Thulke S, Mackay I M, et al. Guideline to reference gene selection for quantitative real-time PCR [J]. Biochem Biophys Res Commun, 2004, 313(4): 856-862. |
| [7] | 贺淹才. 肌动蛋白和肌动蛋白基因的研究进展 [J]. 生命的化学, 2002, 22(3): 248-250. |
| [8] | Neuvians T P, Gashaw I, Sauer C G, et al. Standardization strategy for quantitative PCR in human seminoma and normal testis [J]. J Biotechnol, 2005, 117(2): 163-171. |
| [9] | Dominguez R, Holmes K C. Actin structure and function [J]. Annu Rev Biophys, 2011, 40: 169-186. |
| [10] | 范丙友, 李 芳, 张文婷, 等. 芍药肌动蛋白基因的克隆及表达分析 [J]. 中草药, 2013, 44(15): 2136-2142. |
| [11] | 邢朝斌, 龙月红, 修乐山, 等. 刺五加肌动蛋白基因的克隆和表达稳定性分析 [J]. 中草药, 2013, 44(13): 1819-1822. |
| [12] | Haller F, Kulle B, Schwager S, et al. Equivalence test in quantitative reverse transcription polymerase chain reaction: confirmation of reference genes suitable for normalization [J]. Anal Biochem, 2004, 335: 1-9. |
| [13] | Woo T H, Patel B K, Cinco M, et al. Identification of Leptospira biflexa by real-time homogeneous detection of rapid cycle PCR product [J] J Microbiol Methods, 1999, 35: 23-30. |
| [14] | Chris H, Philippa L, Severine T, et al. Melting curve analysis of feline calicivirus isolates detected by real-time reverse transcription PCR [J]. J Virol Methods, 2002, 106: 241-244. |
| [15] | Dhanasekaran S, Doherty T M, Kenneth J, et al. Comparison of different standards for real-time PCR-based absolute quantification [J]. J Immunol Method 2010, 354(1/2): 34-39. |
 2014, Vol. 45
2014, Vol. 45


