2. 天津药物研究院 释药技术与药代动力学重点实验室, 天津 300193
2. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
甘草为豆科甘草属植物,来源于甘草Glycyrrhiza uralensis Fisch.、光果甘草Glycyrrhiza glabra L. 和胀果甘草Glycyrrhiza inflata Bat. 的干燥根和根茎,常作佐使药入多种中药复方,味甘,性平,归心、肺、脾、胃经,具有补脾益气、清热解毒、祛痰止咳、缓急止痛、调和诸药等功效[1, 2, 3]。甘草苷是甘草中主要的黄酮类化合物,具有抗抑郁、神经保护以及治疗心脏系统疾病等作用[3, 4, 5, 6, 7]。
有研究表明甘草苷经口服给药后不易被胃肠道吸收[8],本研究中大鼠ig给予甘草苷后,在血浆及组织中并未检测到甘草苷原型药物,推测其在体内可能发生了广泛的代谢,主要以代谢产物形式存在于血液及组织中,因此有必要对甘草苷的代谢途径进行研究。体外代谢研究表明,甘草苷在胃肠道微生物的作用下可生成5种代谢产物,主要为甘草素及其甲基化产物[9]。另外,陆林玲等[10]研究发现,大鼠ig给予中药复方四逆散(含有甘草苷和甘草素等)后,推测体内可能存在6种甘草苷和甘草素的代谢产物。
作为新药开发的甘草苷(liquiritin,LQ)单体,体内可能存在的代谢产物以及代谢途径尚未见文献报道。本研究应用QTRAP型LC-MS/MS系统进行甘草苷大鼠体内代谢产物的结构鉴定,对空白生物样品和给药后生物样品经前处理后进行分析,筛选和寻找出可能的代谢物,为其进一步的开发提供实验依据和数据支持。
1 材料 1.1 药品与试剂甘草苷(质量分数98.23%)、甘草素(质量分数100%),吉林省中医药研究院;甲醇(色谱纯)、冰乙酸(色谱纯),天津康科德科技有限公司;甲酸(色谱纯)、甲酸铵(分析纯),天津市光复精细化工研究所;β-葡萄糖醛酸酶(Type H-2 From Helix Pomatia,批号011M7405),SIGMA-ALDRICH公司;磷酸二氢铵(分析纯),天津市化学试剂三厂;超纯水,实验室自制(BM—40型科诺纯水制备系统,电阻率18.2 MΩ)。
1.2 实验动物SPF级Wistar大鼠,雌雄兼用,7~10周龄,体质量200~300 g,北京市维通利华实验动物科技有限公司提供,动物许可证号SCXK(京)2012-0001,动物质量合格证号11400700015112、11400700018465。SPF级屏障系统内饲养1周后称体质量、给药、取样。饲养间采用明暗各12 h间隔照明控制,屏障系统的温度保持在(22±1)℃,湿度保持在(60±5)%。
1.3 仪器色谱柱:Diamonsil C18(200 mm×4.6 mm,5μm),Dikma科技公司产品。液相色谱系统:日本Shimadzu公司产品,配备LC—20AD型输液泵,DGU—20A3型脱气机,CTO—20A型柱温箱,SI L—20A型自动进样器,CBM—20A系统控制。质谱系统:美国AppliedBiosystems公司产品,配备API 4000 Q-TRAP质谱仪,ESI(电喷雾离子化)离子化源和Analysis1.5.2分析数据处理系统工作站。
2 方法 2.1 动物给药与生物样品采集 2.1.1 尿、粪代谢样品采集健康Wistar大鼠4只,雌雄各半,按性别分成2组,分置于代谢笼中,给药前禁食,实验期间自由进食与饮水。以甘草苷300mg/kg的剂量给大鼠ig给药(给药体积为0.5 mL/100 g)。分别收集给药前空白及给药后0~4、4~8、8~24 h各时间段的尿样和粪样,尿样记录体积,-80 ℃保存待测。
2.1.2 胆汁代谢样品采集健康Wistar大鼠5只,雌3只、雄2只,给药前禁食,自由饮水。大鼠ip 20%乌拉坦进行麻醉后,实施胆汁插管引流手术。以甘草苷300 mg/kg的剂量ig给药(给药体积为0.5 mL/100 g)。分别收集给药前空白及给药后0~2、2~4、4~6、6~8、8~12、12~19、19~24 h各时间段的胆汁样品,记录体积,-80 ℃保存待测。
2.1.3 血样采集血浆样品为大鼠ig给予甘草苷120 mg/kg的冻存样品,临用前将0~24 h不同时间点的血浆混合即可。
2.2 生物样品处理与分析 2.2.1 粪样预处理粪便样品称质量后研磨,按5 mL/g的比例加入50%甲醇水溶液提取,超声15 min,即得粪匀浆液。
2.2.2 生物样品处理吸取100μL血浆、尿、胆汁原液及粪匀浆液样品,加入300 μL甲醇,12000 r/min离心10 min(4 ℃),取上清液300 μL,40 ℃氮气吹干,100 μL 50%甲醇水溶液复溶,12 000 r/min离心5min(4 ℃),上清进样3 μL,进行LC-MS/MS分析。
2.3 LC-MS条件 2.3.1 色谱条件色谱柱为DiamonsilC18(200 mm×4.6 mm,5μm);柱温30 ℃;流动相为A(甲醇)和B(0.5 mmol/L甲酸铵水溶液,含0.2%甲酸和10%甲醇);梯度洗脱程序:0~10 min,80%~60% B;10~15 min,60%~50% B;15~16 min,50% B;16~21 min,50%~60% B;21~34 min,60%~90% B;体积流量0.5 mL/min。
2.3.2 质谱条件ESI电喷雾离子源,负离子检测;离子喷雾电压-3 000 V;离子源温度500 ℃;簇电压为-75 V;入口电压为-12 V;碰撞能为-10 V;卷帘气为68.95 kPa(10 psi);喷雾气为344.75 kPa(50 psi);加热气为413.7 kPa(60 psi);碰撞气为55.16 kPa(8 psi)。扫描模式:EMS、NL、MRM及EPI。扫描范围m/z 50~1 000。
3 结果 3.1 甘草苷与甘草素的色谱行为由于生物样品中存在大量的内源性物质,因此不仅应尽量使代谢产物和内源性物质分开,而且应使各代谢产物之间有较好的分离。通过对流动相的组成、比例及洗脱梯度的调节和优化,在本研究确定的液相条件下,甘草苷和甘草素对照品的液相色谱保留时间分别为18.6 min和25.5 min,总离子流色谱图见图 1。
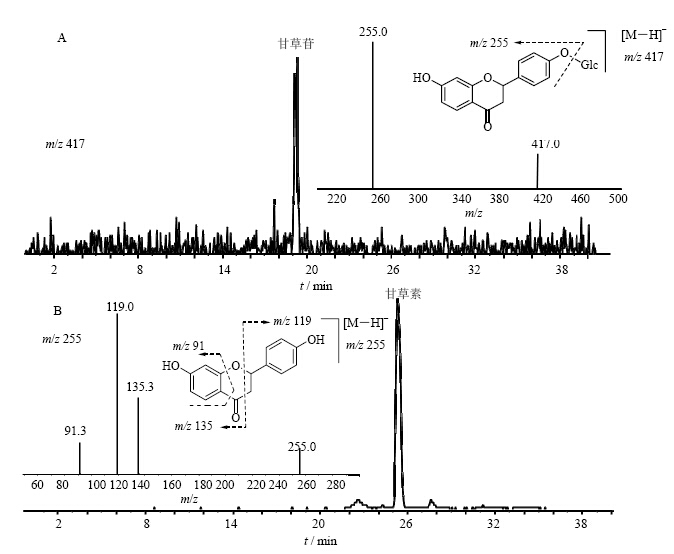 | 图 1 甘草苷(A)和甘草素(B)的总提取离子流色谱图和二级质谱图Fig.1 Extracted ion chromatograms and MS2 spectra of LQ (A) and LG (B) |
药物在生物体内的代谢转化主要是其分子进行官能团反应或与内源性极性分子的结合反应等,代谢物是具有原型特征的质谱裂解碎片或中性丢失,仍保留原型的基本骨架结构或亚结构,因此甘草苷和甘草素的质谱裂解规律是代谢产物结构解析和鉴定的依据。用蠕动注射泵将甘草苷和甘草素标准液直接导入API 4000 QTRAP质谱仪ESI源,采用负离子检测方式进行检测,获得甘草苷的 [M-H]-准分子离子峰(m/z 417)和甘草素的 [M-H]-准分子离子峰(m/z 255),对其准分子离子进行碰撞诱导解离(CID)分析,获得二级全扫描质谱图,见图 1,甘草苷的主要碎片离子为m/z 255,为甘草苷脱去一分子葡萄糖产生的碎片离子,也是甘草素的特征分子离子峰。甘草素的主要碎片离子为m/z 135、119、91,其中m/z 135和m/z 119为甘草素B环C1-C2和C3-C4键断裂的碎片离子,m/z 91(C6H3O)为碎片离子A环侧链C-O键和C-C键断裂形成的。
大鼠ig给予甘草苷后,体内共发现与甘草苷、甘草素有关的可能代谢产物共9种,大鼠胆汁、尿、粪和血浆给药后样品以及空白样品中各可能代谢产物的提取离子流色谱图见图 2,各样品中发现的可能代谢产物相关信息见表 1。对各代谢物进行结构解析,推导过程如下。
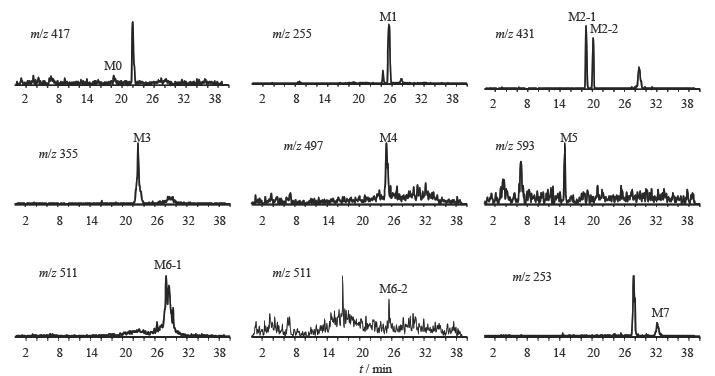 | 图 2 大鼠ig甘草苷后胆汁、尿液、粪便以及血浆中甘草苷及其代谢产物的提取离子流色谱图Fig.2 Extracted ion chromatograms for parent LQ and its metabolites in bile,urine,feces,and plasma of rats after ig administrationof LQ |
| 表 1 各样品中可能的代谢产物相关信息 Table 1 Information of metabolites in different samples |
M0:在m/z 417的提取离子流色谱图中,胆汁中检测到1个色谱峰,保留时间为18.6 min,其色谱峰与甘草苷对照品的保留时间一致,EPI质谱图与甘草苷对照品有相同的碎片离子,但胆汁中甘草苷碎片离子多于甘草苷对照品,可能是CID能量差异的原因所致。甘草苷仅在大鼠胆汁中检测到,可能为原型药物甘草苷,也可能为原型经代谢后再结合葡萄糖产生的II相代谢产物,其化学结构与原型甘草苷相同。
M1:在m/z 255的提取离子流色谱图中,可以检测到1个代谢产物的色谱峰,保留时间为25.5min,命名为M1,主要碎片离子为m/z135、119、91。将M1与甘草素对照品进行比对分析,发现其色谱峰保留时间、准分子离子及二级碎片离子均与甘草素对照品相同,因此鉴定M1是代谢产物甘草素。
M2:在m/z 431的提取离子流色谱图中,可以检测到2个代谢产物的色谱峰,保留时间为18.9、20.2min,分别命名为M2-1和M2-2。
M2-1的保留时间为18.9 min,主要碎片离子为m/z 369、296、255、135、119。M2与M1相比多176,其中碎片离子m/z 135、119与M1的特征碎片离子相同,由于二级全扫描质谱中产生脱去176的碎片离子是葡萄糖醛酸结合物的典型质谱裂解规律,因此推测其可能为甘草素(M1)的葡萄糖醛酸结合物,结合位点可能为A环的C-7位或C环的C-4位的羟基,由于m/z 296为甘草素-4′-O-葡萄糖醛酸B环裂解产生的碎片,m/z 369为甘草素-4′-O-葡萄糖醛酸A环裂解产生的碎片离子,因此确定其结合位点发生在C环C-4位羟基。
M2-2与M2-1相比,主要碎片离子相同,相对丰度基本一致,只是保留时间不同,为20.2 min,目前获得的信息不能确定其代谢转化位点与M2-1的不同之处,仅能确定是甘草素的葡萄糖醛酸结合物。
M3:在m/z 355的提取离子流色谱图中,可以检测到1个代谢产物的色谱峰,保留时间为22.9 min,命名为M3,主要特征碎片离子为m/z 255、135、119,比甘草素多80,其中碎片离子m/z 135、119与M1的特征碎片离子相同,由于二级全扫描质谱中产生脱去80的碎片离子是硫酸结合物的典型质谱裂解规律,推测其可能为甘草素(M1)的硫酸结合物,结合位点可能发生在A环C-7或C环C-4位羟基,但目前获得的信息不能确定发生代谢转化的位点。
M4:在m/z 497的提取离子流色谱图中,可以检测到1个代谢产物的色谱峰,保留时间为25.1 min,命名为M4,主要特征碎片离子为m/z 417、255、135、119,其中m/z 417是甘草苷的分子离子峰,比准分子离子m/z 497少80,推测是甘草苷-7-O-硫酸结合物。
M5:在m/z 593的提取离子流色谱图中,可以检测到1个代谢产物的色谱峰,保留时间为15.0 min,命名为M5,主要特征碎片离子为m/z 417、255、135、119,其分子离子m/z 593比主要碎片离子m/z 417多176,推测可能是甘草苷-7-O-葡萄糖醛酸结合物。
M6:在m/z 511的提取离子流色谱图中,可以检测到2个代谢产物的色谱峰,保留时间为18.6、25.5min,分别命名为M6-1和M6-2。
M6-1的保留时间为28.2 min,主要特征碎片离子为m/z 431、355、295、255、215、135、119,其分子离子m/z 511比主要碎片离子m/z 431多80,比主要碎片离子m/z 335多176,推测可能既是葡萄糖醛酸也是硫酸结合物,m/z 255、135分别是甘草素的分子离子和特征碎片离子,m/z 295、215是甘草素-7-O-硫酸-4′-O-葡萄糖醛酸结合物裂解B环产生的特征碎片离子,因此推测M6-1为甘草素-7-O-硫酸- 4′-O-葡萄糖醛酸结合物。
M6-2的保留时间为25.5 min,主要特征碎片离子为m/z 431、255、135、119,与M6-1相比少m/z 431、295、215,其分子离子m/z 511比主要碎片离子m/z 431多80,比主要碎片离子m/z 355多176 ,推测可能也是甘草素的硫酸及葡萄糖醛酸结合物,由于具体信息不够全面,因此不能确定发生代谢和转化的位点。
M7:在m/z 253的提取离子流色谱图中,可以检测到1个代谢产物的色谱峰,保留时间为32.0min,命名为M7,主要碎片离子为m/z223、209、135、117,其中m/z 135为B环裂解后的A环部分,m/z 117比B环裂解后的C环部分少2,可能是脱去2H的代谢产物,结合文献报道,确定脱氢位点为C2-C3。
3.4 甘草苷大鼠体内代谢物谱总结甘草苷在大鼠胆汁、尿、粪和血浆中可能代谢产物的色谱质谱相关信息见表 2,经峰面积归一化法计算的主要代谢产物相对生成量百分比见表 3,大鼠体内可能的代谢途径及代谢物见图 3。
| 表 2 大鼠ig甘草苷后体内代谢产物的色谱质谱信息 Table 2 Chromatographic and MS information for LQ and its metabolites after ig administration to rats |
| 表 3 甘草苷在大鼠体内主要代谢产物相对生成量百分比 Table 3 Relative percentage of LQ metabolites in rats in vivo |
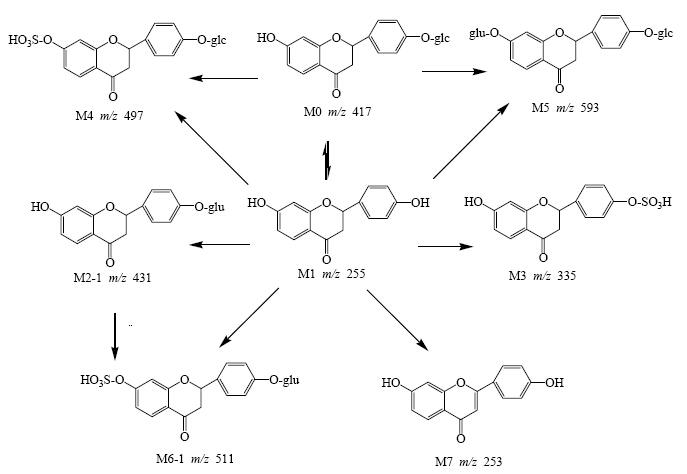 | 图 3 甘草苷在大鼠体内的代谢途径Fig.3 Metabolic pathways of LQ in rats in vivo |
药物的多数代谢产物在结构上与原型药物相似,且具有原形药物的特征质谱裂解碎片或中性丢失,所以可以通过特征碎片离子、特征中性丢失或者特征碎片离子间质量差推断代谢产物结构。本实验应用QTRAP的IDA软件及EPI扫描功能,实现1次进样即可获得“全部有效信息”,即如果发现预设代谢物的m/z,仪器自动切换至EPI,快速得到高质量的MS2谱图,提高了代谢分析的效率和质量[11, 12]。本研究通过比较给药前后大鼠尿、粪、胆汁和血浆的总离子流色谱图以及提取离子流色谱图,在ig甘草苷的大鼠胆汁、尿、粪和血浆中共检测出可能的9个代谢产物,其中I相代谢产物2个(M1和M7),II相代谢产物7个。
在代谢产物结构鉴定与确证中,标准品对照法是较准确且成熟的方法,该方法具有快速、简便、准确度高等优点,目前已有很多文献证明了该方法的可靠性[13, 14]。通过分析代谢产物的色谱保留时间和质谱信息,发现代谢产物M1与甘草素对照品的保留时间及质谱信息完全相同,由此证明,代谢产物M1为甘草素,同时也证明了本研究对代谢产物结构推断的合理性和正确性。
有研究表明黄酮类化合物在体内代谢的主要部位是肠道和肝脏,其水解反应主要发生在肠道,黄酮糖苷在肠黏膜乳糖酶根皮苷水解酶的作用下水解成苷元[15]。本研究证明甘草苷在大鼠体内主要生成脱葡萄糖基的苷元甘草素。进一步对甘草苷和甘草素的跨膜能力进行了研究,在Caco-2细胞模型下,甘草苷和甘草素的Papp值分别为2×10-6 cm/s和17.0×10-6 cm/s,另外,根据甘草素的外排率结果(外排率为0.61<2),证明甘草素的吸收主要以被动扩散形式实现,这一结果提示甘草素在肠道内的跨膜转运能力远大于甘草苷,因此体内主要以甘草素的形式吸收入血。甘草素经肠黏膜吸收后,在葡萄糖醛酸转移酶(UDPGA)等II相酶的作用下发生II相结合反应,生成葡萄糖醛酸结合物、硫酸化物及甲基化物[16, 17]。本研究表明甘草苷口服后在血浆中的主要存在形式为甘草素的硫酸结合物;粪中的主要代谢产物为甘草素和甘草素的硫酸结合物;尿中的主要代谢产物包括甘草素和甘草素的葡萄糖醛酸结合物;胆汁中的主要代谢产物包括甘草素的葡萄糖醛酸和硫酸结合物。
应用峰面积归一化法计算主要代谢产物相对生成量百分比,甘草素在大鼠尿、粪的相对生成量百分比分别为70.3%和74.7%,甘草素的硫酸结合物在大鼠胆汁、粪和血浆的相对生成量百分比分别为22.0%,23.8%和100%,提示甘草苷ig给药后在大鼠胆汁、尿、粪和血浆中的主要代谢产物为甘草素、甘草素的葡萄糖醛酸结合物及其硫酸结合物。
| [1] | 刘洋洋, 刘春生, 曾斌芳, 等. 甘草种质资源研究进展 [J]. 中草药, 2013, 44(24): 3593-3598. |
| [2] | 苏国林, 刘 刚, 刘育辰, 等. 甘草苷的提取纯化方法和药理作用研究进展 [J]. 中国现代中药, 2011, 13(10): 48-51. |
| [3] | 张明发, 沈雅琴. 甘草及其活性成分抗炎与抗炎机制的研究进展 [J]. 现代药物与临床, 2011, 26(4): 261-268. |
| [4] | 肖 渊. 甘草苷的抗抑郁作用及其机理研究 [D]. 北京: 北京中医药大学, 2009. |
| [5] | 杨 云, 卞广兴, 吕秋军. 甘草苷对原代海马神经细胞的保护和营养作用 [J]. 中国中药杂志, 2008, 33(8): 931-935. |
| [6] | Sun Y X, Tang Y, Wu A L, et al. Neuroprotective effect of liquiritin against focal cerebral ischemia/reperfusion in mice via its antioxidant and anti apoptosis properties [J]. J Asian Nat Prod Res, 2010, 12(12): 1051-1060. |
| [7] | 董 晞, 赵世萍, 刘 岩, 等. 甘草苷对乌头碱致心肌细胞损伤的保护作用 [J]. 中华中医药杂志, 2009, 24(2): 163-166. |
| [8] | 吕 鹏. 甘草苷及其苷元的透膜转运特征及初步药代动力学评价 [D]. 北京: 中国人民解放军军事医学科学院, 2010. |
| [9] | Zhang W, Jiang S, Qian D W, et al. Effect of liquiritin on human intestinal bacteria growth: metabolism and modulation [J]. Biomed Chromatogr, 2014, 28(9): 1271-1277. |
| [10] | 陆林玲, 束 艳, 钱大玮, 等. 大鼠灌胃四逆散提取物后血浆、尿液、粪便、胆汁中主要代谢产物的鉴定 [J]. 药学学报, 2011, 46(11): 1374-1379. |
| [11] | Yao M, Ma L, Duchoslav E, et al. Rapid screening and characterization of drug metabolites using multiple ion monitoring dependent product ion scan and postac-quisition data mining on a hybrid triple quadrupole-linear ion trap mass spectrometer [J]. Rapid Commun Mass Spectrom, 2009, 23(11): 1683-1693. |
| [12] | Yao M, Ma L, Humphreys W G, et al. Rapid screening and characterization of drug metabolites using a multiple ion monitoring-dependent MS/MS acquisition method on a hybrid triple quadrupole-linear ion trap mass spectrometer [J]. J Mass Spectrom, 2008, 43(10): 1364-1375. |
| [13] | 张 薇, 郑 枫, 刘文英. BAPTA-AM在体外大鼠血浆中3个代谢产物的结构确证 [J]. 中国药科大学学报, 2008, 39(2): 151-154. |
| [14] | 谢 阳, 赖 维, 万苗坚, 等. 荔枝果皮中的美白剂根皮苷的提取、纯化及鉴定 [J]. 中国美容医学, 2008, 17(7): 1032-1034. |
| [15] | Graf B, Aeho C, Dolnikowkig G, et al. Rat gastrointestinal tissues metabolize quercetin [J]. J Nutr, 2006, 136(1): 39-44. |
| [16] | Van Derwoude H, Boersmam G, Vervoort J, et al. Identification of 14 quercetin phase II mono-and mixed conjugates and their formation by rat and human phase II in vitro model systems [J]. Chem Res Toxicol, 2004, 17(11): 1520-1530. |
| [17] | Gradolatto A, Canyvenglavier M, Basly J P, et al. Metabolism of apigenin by liver phase I and phase II enzymes and by isolated perfused rat liver [J]. J Drug Metab Dispos, 2004, 32(1): 58-65. |
 2014, Vol. 45
2014, Vol. 45


