黄酮类化合物是植物中分布很广的一类化合物,也是药用植物中的主要活性成分之一,具有广谱的药理活性和较低毒性。异戊烯基化的黄酮类化合物是黄酮类化合物中独特的一类烷基化产物,特征为在黄酮类化合物的骨架上存在异戊烯基侧链。但是,异戊烯基化的黄酮类化合物分布并不广泛,目前已发现的约700个,很多这类化合物是从传统的药用植物中提取分离得到的。研究表明,异戊烯基黄酮类化合物有广泛的生物活性,如抗肿瘤[1]、抗骨质疏松作用[2, 3]、抑制酪氨酸酶、抗病菌[4]、抗氧化、抗HIV[4]等,因而异戊烯基化的黄酮类化合物具有广阔的应用前景,对其生物活性的研究也已成为药学研究领域的热点之一。
1 黄酮类化合物A环8位异戊烯基化的化学研究8-异戊烯基黄酮类化合物是黄酮类化合物中的一种,其主要特点是在黄酮类化合物母核的8位碳原子上有1个活性基团,如3, 3-二甲基丙烯基(isoprenyl)或E-3, 7-二甲基-2, 6-辛二烯基(geranyl)等[5]。其典型的结构类似物包括淫羊藿苷及其代谢物、8-异戊烯基柑橘素(8-prenylnaringenin)、8-异戊烯基染料木素(8-prenylgenistein)等(图 1)。
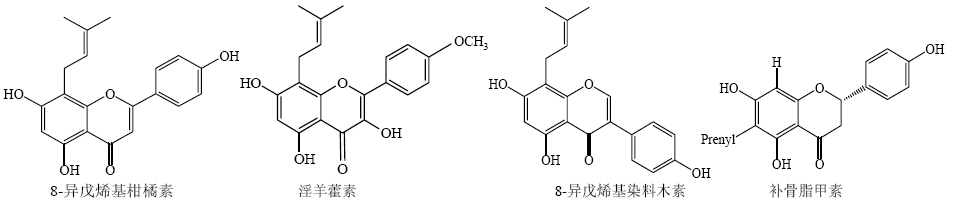 | 图 1 具有8-异戊烯基侧链的代表性黄酮类化合物Fig.1 Representatives flavonoids with 8-prenylated side chain |
黄酮类化合物中异戊烯基的存在,使得化合物分子能够强烈地亲和生物膜,相关生物活性显著提高。大量的有关异戊烯基黄酮类化合物的生物活性研究结果和构效关系分析,也同样支持异戊烯基化可增强黄酮类化合物生物活性的这一观点[6]。
2 黄酮类化合物A环C-8位异戊烯基化对生物活性的影响 2.1 抗氧化作用8-异戊烯基芹黄素(8-prenylapigenin)是从植物中提取得到的异戊烯基黄酮,广泛存在于水果、蔬菜、豆类、茶叶、咖啡及葡萄酒中。据报道其具有显著的清除超氧阴离子的作用[7],能使自由基灭活,减轻自由基对DNA和生物膜的损伤。补骨脂是我国传统中药,郭江宁[8]的实验研究表明,补骨脂中异戊烯基黄酮类化合物具有较强的抗氧化活性,是清除羟基自由基的主要活性成分。Miranda等[9]检测了几个从蛇马草和啤酒中提取的异戊烯基查耳酮和异戊烯基黄烷酮在体内对人低密度脂蛋白氧化的抑制活性,结果发现异戊烯基查耳酮和异戊烯基黄烷酮在5~25 μmol/L浓度时,就表现出了较强的抑制低密度脂蛋白氧化的活性,而非异戊烯基化的查耳酮和非异戊烯基化的黄烷酮在相同浓度时无抑制低密度脂蛋白氧化的活性。同年,又将从蛇马草和啤酒中提取的异戊烯基查耳酮进行了大鼠肝微粒体的脂氧化抑制活性研究,发现异戊烯基查耳酮抑制大鼠肝微粒体的脂氧化活性强于非异戊烯基黄酮类化合物,再次论证了异戊烯基在黄酮化合物抗氧化活性方面的重要性。
2.2 抗骨质疏松作用骨质疏松主要的表现就是骨吸收快于骨形成,导致骨代谢失衡、骨量丢失、骨密度下降、骨折率升高。Bottner等[10]研究发现8-异戊烯基柑橘素能够抑制骨质疏松模型大鼠的骨密度下降。Sehmisch等[11]比较研究了8-异戊烯基柑橘素、6-异戊烯基柑橘素、6, 8-异戊烯基柑橘素的抗骨质疏松活性,发现8-异戊烯基柑橘素的活性最强。8-异戊烯基柑橘素和柑橘素的抗酒石酸酸性磷酸酶(TRAP)阳性破骨细胞数均显著减少,TRAP酶活性显著降低,形成骨吸收陷窝的数量和面积明显减少,TRAP和组织蛋白酶K的基因表达水平明显降低。此外,8-异戊烯基柑橘素于加药后12 h达到破骨细胞凋亡高峰,而柑桔素组是24 h后达到,且前者诱导凋亡总数显著高于后者,说明8-异戊烯基柑橘素抑制破骨细胞骨吸收和诱导破骨细胞凋亡的活性明显高于柑桔素。由于两者分子结构的唯一差别在于异戊烯基团,因此,C-8位的异戊烯基团可提高黄酮母核的抗骨吸收活性。淫羊藿是抗骨质疏松的传统中药,黄酮类化合物是其抗骨质疏松的药效物质基础[12]。明磊国等[13, 14, 15]研究发现淫羊藿苷和蛇床子素对骨髓间充质干细胞和成骨细胞的分化成熟有明显促进作用。值得注意的是,淫羊藿苷和蛇床子素的C-8位上也具有异戊烯基,说明此基团与上述化合物的抗骨质疏松活性密切相关。Zhang等[16]研究发现8-异戊烯基染料木素促进大鼠成骨样细胞UMR106增殖10%~23%,且细胞外基质中钙、磷量显著增加。相反,经过6-异戊烯基染料木素处理后,UMR106细胞增殖减少。由此说明,8-异戊烯基染料木素具有骨保护作用。
2.3 抗微生物活性抗微生物是异戊烯基黄酮类化合物最早被确定的生物活性,至今该活性也仍然是许多新近发现异戊烯基黄酮类化合物的主要生物活性之一。
从苦参根中分离得到异戊烯基黄酮类化合物,多以薰衣草基(lavandulyl)的分枝异戊烯基侧链及其羟基化形式存在于A环的C-8位上。这是苦参区别于同属其他植物最明显的特征。研究发现苦参中含有的大多数的异戊烯基二氢黄酮类化合物对革兰氏阳性菌枯草芽孢杆菌、表皮葡萄球菌和痤疮丙酸杆菌显示出不同程度的抑制作用[17],对甲氧苯青霉素耐受菌金黄色葡萄球菌也显示出抑制作用[18]。Yin等[19]从补骨脂中提取、分离、纯化出28个异戊烯基黄酮类化合物,其中16种化合物对金黄色葡萄球菌和表皮葡萄球菌的抑制活性研究表明,大多数化合物显示出明显的抗菌作用,MICs水平在0.009~0.073 mmol/L。经过构效关系分析,发现在补骨脂所分离到的查耳酮衍生物中,A环有异戊烯基侧链修饰的化合物corylifol B、补骨脂色烯素和补骨脂查耳酮都显示更强的抗菌活性,而当异戊烯基被氧化或是环化如巴库查耳酮,抗菌活性则减弱或消失。
2.4 抗肿瘤作用韩惠等[20]利用MTT法对分离得到的异戊烯基黄酮类化合物进行体外抗肿瘤活性筛选,结果分离得到7个黄酮类化合物,分别鉴定为淫羊藿苷、淫羊藿素、宝藿苷I、去甲淫羊藿素、苜蓿素、淫羊藿次苷I和朝藿定C。体外抗肿瘤结果表明,淫羊藿素、宝藿苷I、去甲淫羊藿素、淫羊藿次苷I在0.5~100 μmol/L浓度对人乳腺癌MDA-MB-231细胞增殖具有明显抑制作用,并随浓度的增加,抑制作用更加明显。Bronikowska等[21]的实验研究显示,补骨脂中异戊烯基类化合物新补骨脂异黄酮会促进肿瘤坏死因子相关的凋亡诱导配体(TRAIL)诱导HeLa细胞凋亡。Gasiorowska等[22]报道,8-异戊烯基柑橘素具有较高的抑制肿瘤细胞电压门阀的kv1.3钾通道活性,同时还能促进肿瘤细胞的凋亡。
2.5 酪氨酸酶抑制作用Kim等[23]研究表明,补骨脂中异戊烯基类黄酮化合物补骨脂甲素、补骨脂二氢黄酮甲醚、补骨脂乙素具有抑制酪氨酸酶的作用。实验研究了这些多酚类化合物对蘑菇酪氨酸酶的活动抑制效能,其中,在对Lineweaver-Burks和Dixon-plot的分析中,上述化合物的强效抑制作用显示出特征性竞争抑制作用[24]。Son等[25]利用组织化学分析手段,发现苦参中含lavandulyl侧链的化合物kurarinone和sophoraflavanone G显示出较强的酪氨酸酶抑制活性,它们的IC50分别是6.6、6.2 μmol/L,构效关系分析表明,C-8位上的lavandulyl侧链对该活性的强弱非常重要。
2.6 类雌激素样作用Milligan等[26]和Pepper等[27]报道,8-异戊烯基柑橘素具有植物雌激素样作用,可以用作雌激素替代品。于令军[28]对化合物补骨脂黄酮、异补骨脂黄酮、8-C-异戊烯基-7, 4′-二羟基黄酮、8-C-异戊烯基芹黄素4个异戊烯基黄酮类化合物进行了植物雌激素样活性测定,结果表明,它们对雌激素敏感性人乳腺癌细胞株MCF-7均具有雌激素样活性。其中,异补骨脂黄酮活性最强。王志强[29]通过研究发现淫羊藿素、去甲淫羊藿素和异补骨脂黄酮等异戊烯基黄酮类化合物具有雌激素样作用,该作用经由雌激素受体介导,通过调控雌激素受体效应基因、蛋白表达和调节细胞周期发挥作用,是一类新型结构的植物来源雌激素受体调节剂。
3 结语目前国内外对天然异戊烯基化合物从不同的生物活性方面进行构效关系的研究,表明该类化合物的生物活性与其结构息息相关。黄酮经异戊烯基修饰之后,其脂溶性和对生物膜的亲和力增加,靶蛋白的相互作用增加,很多生理活性被影响。同时,异戊烯基取代位置不同,对不同细胞表现出不同的活性。众多研究表明,异戊烯基在黄酮母核的C-8位表现出的活性要强于异戊烯基在其他碳位的活性。随着研究的深入,在现有的研究基础上,可以取得更加系统的研究结果,在黄酮类化合物与异戊烯基团的构效关系研究上获得突破性成果。
| [1] | 陈积常, 黄初升, 刘红星, 等. 具有生物活性的异戊烯基及香叶基黄酮类化合物[J]. 化工技术与开发, 2013, 42(1): 12-17. |
| [2] | Reinwald S, Weaver C M. Soy isoflavones and bone health: a double-edged sword[J]. Nat Prod, 2006, 69(3): 450-459. |
| [3] | Wuttke W, Jarry H, Seidlová-Wuttke D. Isoflavones-safe food additives or dangerous drugs[J]. Ageing Res Rev, 2007, 6(2): 150-188. |
| [4] | Boonlaksiri C, Oonanant W, Kongsaeree P, et al. An antimalarial stilbene from artocarpus integer[J]. Phytochemistry, 2000, 54(4): 415-417. |
| [5] | 明磊国. 8-异戊烯基柑橘素对骨代谢相关细胞的影响及分子机制研究[D]. 兰州: 兰州理工大学, 2011. |
| [6] | Xu M J, Wu B, Ji T D, et al. Simultaneous characterization of prenylated flavonoids and isoflavonoids in Psoralea corylifolia L. by liquid chromatography with diode-array detection and quadrupole time-of-flight mass spectrometry[J]. Rapid Commun Mass Spectrom, 2012, 26(19): 2343-2358. |
| [7] | Tiziana P, Silvia F, Francesca G, et al. Anti-inflammatory and vascularprotective properties of 8-prenylapigenin[J]. Eur J Pharm, 2009, 620(1): 120-130. |
| [8] | 郭江宁. 补骨脂抗氧化与抗癌活性成分的研究[D]. 沈阳: 沈阳药科大学, 2004. |
| [9] | Miranda C L, Aponso G L, Stevens J F, et al. Prenylated chalcones and flavanones as inducers of quinone reductase in mouse Hepa 1c1c7 cells[J]. Cancer Lett, 2000, 149(1): 21-29. |
| [10] | Bottner M, Christoffel J, Wuttke W. Effects of long-term treatment with 8-prenylnaringenin and oral estradiol on the GH-IGF-1 axis and lipid metabolism in rats[J]. Endocrinology, 2008, 198(3): 395-401. |
| [11] | Sehmisch S, Hammer F, Christoffel J, et al. Comparison of thephytohormones genistein, resveratrol and 8-prenylnaringenin asagents for preventing osteoporosis[J]. Planta Med, 2008, 74(7): 794-801. |
| [12] | 蒋俊, 崔莉, 孙娥, 等. 基于淫羊藿黄酮类化合物的体内代谢阐述其抗骨质疏松药效物质基础[J]. 中草药, 2014, 45(5): 721-729. |
| [13] | 明磊国, 王鸣刚, 陈克明, 等. 淫羊藿苷对体外培养人骨髓基质干细胞增殖与成骨性分化的影响[J]. 中国骨质疏松杂志, 2010, 16(2): 100-104. |
| [14] | 明磊国, 葛宝丰, 陈克明, 等. 蛇床子素对体外培养骨髓基质干细胞增殖与成骨性分化的影响[J]. 中国药理学通报, 2010, 26(8): 1098-1103. |
| [15] | 明磊国, 葛宝丰, 陈克明, 等. 蛇床子素对体外培养成骨细胞增殖与成骨性分化的影响[J]. 中国骨伤, 2010, 23(9): 42-45. |
| [16] | Zhang Y, Li X L, Yao X S, et al. Osteogenic activities of genistein derivatives were influenced by the presence of prenyl group at ring A[J]. Arch Pharm Res, 2008, 31(12): 1534-1539. |
| [17] | Kuroyanagi M, Arakawa T, Hirayama Y, et al. Antibacterial and antiandrogen flavonoids from Sophora flavescens[J]. J Nat Prod, 1999, 62(12): 1595-1599. |
| [18] | Tsuchiya H, Sato M, Miyazaki T, et al. Comparative study on the antibacterial activity of phytochemical flavanones against methicillin-resistant Staphylococcus aureus[J]. J Ethnopharmacol, 1996, 50(1): 27-34. |
| [19] | Yin S, Fan C Q, Wang Y, et al. Antibacterial prenylflavone derivatives from Psoralea corylifolia, and their structure-activity relationship study[J]. Bioorg Med Chem, 2004, 12(16): 4387-4392. |
| [20] | 韩惠, 单淇, 周福军, 等. 箭叶淫羊藿中化学成分及其体外抗肿瘤活性研究[J]. 现代药物与临床, 2013, 28(3): 269-273. |
| [21] | Bronikowska J, Szliszka E, Czuba Z P, et al. The combination of TRAIL and isoflavones enhances apoptosis in cancer cells[J]. Molecules, 2010, 15(3): 2000-2015. |
| [22] | Gąsiorowska J, Teisseyre A, Uryga A, et al. The influence of 8-prenylnaringenin on the activity of voltage-gated kv1. 3 potassium channels in human jurkat t cells[J]. Cell Mol Biol Lett, 2012, 17(4): 559-570. |
| [23] | Kim Y K, Oh K Y, Kim J Y, et al. Polyphenols displaying tyrosinase inhibition from the seed of Psoralea coryliflia[J]. J Korean Soc Appl Biol Chem, 2010, 53(4): 427-432. |
| [24] | 耿革霞, 黄又五, 郭夫江. 补骨脂中异戊烯基黄酮类化合物及其药理作用研究进展[J]. 天然产物研究与开发, 2013, 25(9): 1297-1301. |
| [25] | Son J K, Park J S, Kim J A, et al. Prenylated flavonoid fromthe roots of Sophora flavescens with tyrosinase inhibitory activity[J]. Planta Med, 2003, 69(6): 559-561. |
| [26] | Milligan S, Kalita J, Pocock V, et al. Oestrogenic activity of the hop phyto-oestrogen, 8-prenylnaringenin[J]. Reproduction, 2002, 123(4): 235-242. |
| [27] | Pepper M S, Hazel S J, Mpel M H. 8-Prenylnaringenin, a novel phytoestrogen, inhibits angiogenesis in vitro and in vivo[J]. J Cell Physiol, 2004, 199(1): 98-107. |
| [28] | 于令军. 异戊烯基黄酮类化合物的合成方法及其雌激素样活性研究[D]. 杭州: 浙江大学, 2004. |
| [29] | 王志强. 异戊烯基黄酮类雌激素受体调节剂的神经保护和促胚胎干细胞分化为神经细胞的研究[D]. 杭州: 浙江大学, 2007. |
 2014, Vol. 45
2014, Vol. 45


