红花来源于菊科植物红花Carthamus tinctorius L. 的干燥花,为活血化瘀要药,红花作为一种多用途的综合资源植物,红花色素是天然食用色素,红花种子所含的油可作食用油,年用量一直保持在5 000吨以上[1]。红花花冠含黄酮、生物碱等成分,其中黄酮类成分红花黄色素(safflower yellow,SY)是红花中研究最多、最主要的有效成分。黄酮类化合物是广泛存在于药用植物中的一类化合物,大都与糖类结合为苷结构存在,多具有调血脂、扩张冠脉、止血、镇咳、祛痰、减低血管脆性等作用。此外,黄酮类化合物具有多种多样的生物学功能,如调节植物生长、保护植物免受紫外线的损伤,以及作为植物抗毒素(phytoalexin)和活性氧清除剂等[2]。黄酮类成分多种多样的药理功能和生物活性备受研究者的关注。
查尔酮合成酶(chalcone synthase,CHS)是黄酮类化合物合成途径中的第1个关键酶,也就是红花有效成分红花黄色素合成途径中的第1个关键酶。它催化该途径的第1步,即将3分子的丙二酰辅酶A(malonyl-CoA)和1分子的4-香豆酰辅酶A(4-coumaroyl-CoA)结合形成第1个具有C13架的黄酮类化合物——查尔酮,该产物进一步衍生转化构成了各类黄酮类化合物[3]。CHS在植物中广泛存在,第1个植物CHS基因序列是1983年在荷兰芹中发现的。到目前为止,GenBank数据库中已经有4 000多条植物CHS的核苷酸序列。
红花花冠为红花的药用部位,红花黄色素主要存在于红花花冠中,其量远远大于根、茎、叶等其他部位[4]。因此,本研究设计特异性引物,从红花新鲜花冠中克隆获得CHS。通过生物信息学对该基因蛋白的特征进行分析,使用MEGA5.1构建CHS与相关物种CHS的系统进化树,利用real time-PCR分析花期中每天红花CHS基因的表达量,并进行分析和比较。
1 材料新鲜红花花冠采于成都中医药大学药用植物园,由裴瑾教授鉴定为菊科植物红花Carthamus tinctorius L.,花期每天早上8点采摘,清洁后吸干水分直接用于RNA提取。
cDNA反转录试剂盒、Thunderbird Sybr qPCR Mix购于TOYOBO公司,植物总RNA提取试剂盒购于Omega公司,Trizol总RNA提取试剂购于天根公司,2×Taq PCR MasterMix购于Biomed公司,多功能DNA纯化回收试剂盒购于BioTeke公司。
2 方法 2.1 RNA提取和cDNA合成使用Trizol总RNA提取试剂和植物总RNA提取试剂盒提取样品总RNA,筛选RNA提取方法。利用紫外分光光度仪测定总RNA的A260和A280。选择A260/A280为1.8~2.0,凝胶电泳检测为3条带的总RNA进行反转录,反转录反应按cDNA合成试剂盒说明书进行。
2.2 CHS克隆与测序根据文献报道[5]红花CHS序列使用软件Primer Primer 5.0、在线软件http://bioinfo. ut.ee/primer 3-0.4.0/、http://www.yeastgenome.org/cgi-bin/web-primer设计引物,见表 1。以cDNA为模板,使用2×Taq PCR MasterMix分别进行PCR扩增,扩增体系20 μL:2×Taq PCR MasterMix 10 μL;正向引物1 μL,反向引物1 μL,cDNA模板5 μL,dd H2O 3 μL。考察扩增条件(退火温度以50~65 ℃梯度考察):94 ℃,3 min;30 循环(94 ℃,30 s;50~65 ℃,30 s;72 ℃,10 min);72 ℃,5 min。PCR结果凝胶电泳检测,多功能DNA纯化回收试剂盒(BioTeke)纯化回收PCR产物,由北京梓熙生物科技有限公司测序。
| 表 1 引物设计 Table 1 Primers design |
使用在线软件http://www.ncbi.nlm.nih.gov/gorf/gorf.html,找出CHS的开放阅读框(open reading frame,ORF),并获得其编码蛋白质序列;使用在线软件http://blast.ncbi.nlm.nih.gov/Blast.cgi,将预测结果与NCBI中已登录的物种进行对比分析;使用软件MEGA5.1将预测结果与相似性达90%以上的物种CHS构建进化树;使用在线软件http://web.expasy.org/protparam/,分析其编码蛋白质序列的一级结构。
2.4 红花花期CHS的表达查阅文献报道[5],得到红花CHS的real-time PCR引物序列和内参基因25s的real-time PCR引物序列。扩增体系10 μL:Thunderbird SYBR qPCR Mix5 μL,正向引物0.5 μL,反向引物0.5 μL;cDNA模板1 μL,dd H2O 3 μL。考察引物扩增曲线、溶解曲线及标准曲线,考察real-time PCR条件(退火温度以50~65 ℃梯度考察):94 ℃,3 min;30循环(94 ℃,30 s;50~65 ℃,30 s;72 ℃,10 min);72 ℃,5 min。确定条件后测试花期7 d的红花CHS和25s的表达量,并在Bio-Rad CFX Manager中分析得到相对表达量。
3 结果与分析 3.1 RNA提取结果Trizol法提取所得RNA紫外分光光度法测定A260和A280,A260/A280为2.0,凝胶电泳检测可见清晰3条带,可用于后续实验,见图 1。由于红花花冠富含红花黄色素等黄酮类物质,干扰RNA提取,加大了RNA提取的难度。试剂盒的方法不能将红花RNA提取出来,在使用Trizol法的过程中应注意以下几点:离心15 min,保证漂浮于Trizol提取液中的红花花冠粉末沉淀;分层后,在吸取上清液时,吸取50%水相,尽可能避免吸取到中间层的蛋白,以保证RNA的纯度;异丙醇沉淀RNA过程中,增加至2 h,尽可能多的使RNA沉淀;RNA清洗过程中,3次用300 μL 75%乙醇清洗,保证色素被清洗干净。
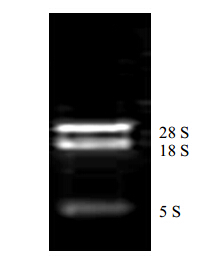 | 图 1 Trizol法提取红花RNA凝胶电泳图Fig. 1 Gel electrophoresis of safflower RNA extracted by Trizol |
引物2在扩增条件:94 ℃,3 min;30 个循环(94 ℃,30 s;64.2 ℃,30 s;72 ℃,10 min);72 ℃,5 min下,可以得到1 000 bp左右的产物,见图 2。
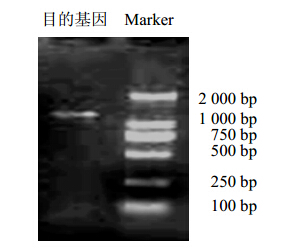 | 图 2 PCR产物凝胶电泳图Fig. 2 Gel electrophoresis of PCR products |
测序分析表明,红花CHS全长1 149 bp,包含一段1 041 bp的ORF,编码346个氨基酸组成的蛋白,见图 3。将该蛋白通过NCBI上的Blastp比对发现,该蛋白属于CHS家族。比对结果显示,红花CHS与100余种NCBI上登录的植物有相似性,其中与菊科植物水飞蓟Silybum marianum (L.) Gaertn.、翠菊Callistephus chinensis (L.) Nees、菊花Chrysanthemum x morifolium Ramat.、红凤菜Gynura bicolor (Willd.) DC.、黑心菊Rudbeckia hirta L.、大丽花Dahlia pinnata Cav. 的相似性分别达95%、95%、94%、94%、93%、92%。将相似性达90%以上的比对结果用MEGA5.1构建进化树,见图 4。通过ProtParam预测CHS蛋白分子式为C1678H2693N451O493S20,相对分子质量为37 700,等电点为6.10,负电荷的氨基酸残基数(Asp+Glu)为42,正电荷的氨基酸残基数(Arg+Lys)为38。
 | 图 3 红花CHS编码的氨基酸序列Fig. 3 Amino acid sequence encoded by safflower CHS |
 | 图 4 红花CHS与相关物种CHS的系统进化树Fig. 4 Phylogenetic tree of CHS in C. tinctorius and other relative related species |
引物序列可用于real-time PCR,条件考察结果是CHS扩增条件:95 ℃,2 min;30 循环(95 ℃,15 s;61.4 ℃,20 s;72 ℃,20 s),内参基因(25s)扩增条件:95 ℃,2 min;30 循环(95 ℃,5 s;55 ℃,20 s;72 ℃,20 s),引物特异性良好。花期7 dCHS相对于25s的表达量分析结果见表 2和图 5,结果表明红花开花第3天表达量最高,高达2.8,远远高于其余几天,表达量第2的是开花第6天,也仅仅1.2。花期7 d中,红花花色从淡黄色逐渐变成红色,花冠数量逐渐增多,大多在第3、4天持平。有文献报道[5],红花在花开第3天黄酮类成分羟基红花黄色素A量最高,与基因表达结果相吻合。
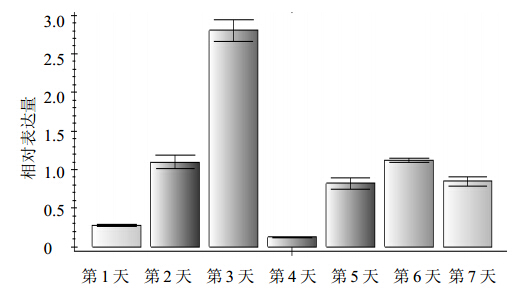 | 图 5 红花花期CHS相对表达量Fig. 5 Relative expression of CHS in safflower during florescence |
| 表 2 25s和CHS的Cq值及表达量 Table 2 Cq value and relative expression of 25s and CHS |
研究克隆获得的红花CHS,序列全长为1 149 bp,具有1 041 bp的完整ORF,编码346个氨基酸。将该蛋白通过NCBI上的Blastp比对发现,该蛋白属于CHS家族。比对结果显示红花CHS与100余种NCBI上登录的植物有相似性,其中与菊科植物水飞蓟、翠菊、菊花、红凤菜、黑心菊、大丽花的相似性分别达95%、95%、94%、94%、93%、92%。将相似性在90%以上的物种用MEGA5.1构建进化树,结果显示红花CHS与水飞蓟CHS亲缘关系最近,经典植物分类学中红花和水飞蓟同属于菊科 (Compositae)管状花亚科(Carduoideae)菜蓟族(Cynareae)。通过ProtParam预测CHS蛋白分子式为C1678H2693N451O493S20,相对分子质量为37 700,等电点为6.10,负电荷的氨基酸残基数(Asp+Glu)为42,正电荷的氨基酸残基数(Arg+Lys)为38。花期7 d中,红花花色从淡黄色逐渐变成红色,花冠数量逐渐增多,大多在第3、4天持平。基因表达分析结果表明红花CHS在花期第3天表达量最高,远远高于其余几天。该研究成功设计了PCR引物并考察得到了相应的PCR扩增条件及real-time PCR条件,克隆得到了1 149 bp的红花CHS基因,并对该基因进行了生物信息学分析,为红花CHS基因提供了更多更详尽的信息。在今后研究中,可以同时结合化学成分研究,找出基因表达与化学成分的关联性,为有效成分合成及调控机制研究提供更多的信息。
随着分子生物学的迅速发展,药用植物也开始涉及到分子生物学领域,中药有效成分研究越来越趋向于有效成分的合成及调控机制的研究。在这些研究中,最为活跃的研究领域是与活性成分形成关系最密切的生物合成相关基因克隆研究。由于临床上对天然药物的实际需求不断增加,以及基因克隆与表达技术的进步,近年来药用植物功能基因的克隆呈现快速增长的趋势[7]。在药用植物中,黄酮类化合物代谢合成途径及相关基因的研究处于起步阶段,但也取得了较大的成果,为药用植物黄酮类化合物合成途径及相关功能基因的深入研究奠定了基础。通过生物合成途径的研究,推动药用植物次生代谢工程的发展,提高中药材的品质,为中药的良种选育、规范化种植和质量控制提供技术支撑,将是中药材品质研究的前沿和热点课题。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 2010. |
| [2] | 王青云. 中草药的有效成份探讨[J]. 内蒙古中医药, 2010(13): 105-106. |
| [3] | Koes R E, Francesca Q, Joseph N M. The flavonoid biosynthetic pathway in plants: function and evolution[J]. Bioessays, 1994, 16: 123-132. |
| [4] | 郭美丽, 张芝玉, 张汉明, 等. 不同栽培居群红花各器官的组织构造和化学成分含量[J]. 第二军医大学学报, 1999, 20(7): 441-444. |
| [5] | Huang L L, Yang X, Sun P, et al. The first illumina-based de novo transcriptome sequencing and analysis of safflower flowers[J]. PLoS One, 2012, 7(6): 1-11. |
| [6] | 侯拥铓, 杨晓君, 王建华. 不同产地和采摘时间对红花有效成分的影响[J]. 内蒙古中医药, 2009(9): 49-50. |
| [7] | Andy P, Brandle S, Kehr J, et al. Amino acid analysis in five pooled single plant cell samples using capillary electrophoresis coupled to laser induced fluorescence detection[J]. Transgenic Res, 2000, 9: 243-260. |
 2014, Vol. 45
2014, Vol. 45


