2. 云南省农业科学院药用植物研究所, 云南 昆明 650223
2. Institute of Medicinal Plants, Yunnan Academy of Agricultural Sciences, Kunming 650223, China
龙胆苦苷是滇龙胆Gentiana rigescens Frach. ex Hemsl.、龙胆G. scabraBge.、三花龙胆G. triflora Pall. 和条叶龙胆G. manshurica Kitag. 等龙胆科植物中的主要有效成分[1]。龙胆苦苷的生物合成主要来源于甲羟戊酸(MVA)途径和2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径。在MEP途径中,1-脱氧-D-木酮糖-5-磷酸还原异构酶(DXR,EC 1.1.1.267)是限速酶[2],它能够催化1-脱氧-D-木酮糖5-磷酸(DXP)异构化并还原生成MEP,该反应需要Mg2+或Mn2+的参与。目前,DXR基因已从拟南芥、水稻、玉米、番茄、橡胶树、喜树和银杏等许多植物中分离[3],而且橡胶树[4]、大豆[5]、节节麦、拟南芥等植物中存在2个或多个DXR基因。Rohdich等[6]将拟南芥AtDXR基因在大肠杆菌中表达,结果其纯化蛋白可催化DXP形成MEP。DXR基因的表达受光、茉莉酸甲酯、机械损伤、真菌诱导子和植物根共生菌等的调控[3, 7, 8, 9]。在薄荷中过表达DXR基因,能够使薄荷精油产量提高50%[10]。在长春花Catharanthus roseus (Linn.) G. Don中,CrDXR基因表达量与单萜吲哚生物碱的累积呈正相关[11]。过表达DXR基因刺激MEP途径衍生的类异戊二烯精油[9]和转基因拟南芥中紫杉烯[12]的合成,而减少DXR基因表达则导致彩斑现象、色素减少和叶绿体发育停滞。在烟草叶绿体中过表达NtDXR基因,导致叶绿素a、β-胡萝卜素、叶黄素、百合黄素、玉米黄素和谷固醇等各种类异戊二烯萜类量增加[13]。在马达加斯加长春花Madagascar periwinkle Herb中,异恶草酮(clomazone)和膦胺霉素(fosmidomycin)对DXR蛋白的表达影响却很小[14]。因此,植物DXR蛋白在萜类合成和代谢中起着重要作用。
滇龙胆为传统中药材龙胆的主要植物来源之一[15]。目前,国内外对龙胆的研究主要集中在种子萌发[16, 17]、DNA条码[18, 19]、转录因子功能[20, 21]、育种等方面,而对滇龙胆GrDXR基因克隆和功能分析尚未有报道。本研究根据滇龙胆转录组中GrDXR基因序列,设计特异性引物,通过RT-PCR技术成功从滇龙胆幼叶中扩增到GrDXR基因,进行序列分析和原核表达。结果表明pGEX-4T-GrDXR工程菌在37 ℃、终浓度为1 mmol/L的IPTG诱导下成功表达出目的蛋白。本研究为滇龙胆GrDXR蛋白的功能研究及通过在龙胆中过表达GrDXR基因提高龙胆苦苷量的研究奠定基础。
1 材料和试剂 1.1 材料滇龙胆Gentiana rigescens Frach. ex Hemsl. 植株栽培于玉溪师范学院资源环境学院分子生物学实验室。实验材料为滇龙胆无菌苗的幼叶。大肠杆菌DH5α和Rosetta(DE3)菌种购买于北京全氏金公司。
1.2 试剂多糖植物组织提取试剂RNAiso、反转录试剂盒、TA克隆试剂盒、限制性内切酶、IPTG、X-gal等均购自于宝生物工程(大连)有限公司;质粒提取试剂盒和胶回收试剂盒购自北京百泰克生物技术有限公司;原核表达载体pGEX-4T-1由玉溪师范学院分子生物学实验室保存;引物由上海捷瑞生物工程有限公司合成;测序由生工生物工程(上海)股份有限公司完成。
2 方法 2.1 叶片总RNA提取、GrDXR全长cDNA的克隆和测序按照多糖植物组织提取试剂RNAiso说明书提取滇龙胆幼叶的总RNA;按照逆转录试剂盒说明书合成cDNA。根据原核表达载体pGEX-4T-1多克隆酶切位点和转录组中滇龙胆GrDXR基因序列,设计一对特异引物GrDXR BamHI-F:GGATCCATGG-CTTTGAATTTGCTCTCC,GrDXR XhoI-R:CTCG-AGTCACACTAAAGCAGGGCTCT。以cDNA为模板进行PCR扩增,反应条件:94 ℃、3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃延伸7 min。GrDXR基因PCR产物经1.0%琼脂糖凝胶电泳分离,割胶后,使用胶回收试剂盒按照说明书对目的片段进行回收,将其连接到pMD19-T载体上,转化大肠杆菌DH5α感受态细胞,涂布于添加100 mg/L氨苄青霉素+IPTG+X-gal的LB固体平板上,37 ℃培养13 h后挑取白斑,37 ℃、250 r/min摇床培养后提取质粒,经酶切鉴定正确后进行测序,获得重组质粒pMD19-GrDXR。
2.2 GrDXR基因的原核表达载体构建对质粒pGEX-4T-1和pMD19-GrDXR分别进行BamHI和XhoI双酶切,回收载体片段和目的基因,按物质的量比1∶4进行过夜连接,然后转化大肠杆菌DH5α感受态细胞,涂布于添加100 mg/L氨苄青霉素的LB固体平板,12 h后挑取克隆摇菌后提质粒,经酶切检测正确后,获得表达载体pGEX-4T-1-GrDXR。
2.3 GrDXR基因的生物信息学分析使用NCBI网站上的BLAST程序(http://www.ncbi.nlm.nih.gov/BLAST)进行序列比对,应用Genetyx进行翻译,并预测蛋白质相对分子质量和等电点(PI)等,使用DNAMAN 7进行多序列比对;使用Clustal X2.1进行比对,然后使用MEGA6.0软件内置的NJ法构建系统进化树,设置Bootstrap=1 000;利用在线数据库(http://molbiol. edu.ru/eng/scripts/01_11.html)进行稀有密码子分析。使用ChloroP服务器v1.1(http://www.cbs.dtu.dk/ services/ChloroP)进行叶绿体转运肽预测;使用Interpro软件(http://www.ebi.ac.uk/interpro/scan.html)进行保守结构域预测;使用ProtScalee软件进行疏水性分析(http://web.expasy.org/protscale);使用Predic-tProtein(https://www.predictprotein.org)对二级结构预测,使用SWISS-MODEL服务器(http://swiss-model.expasy.org/workspace)对三级结构预测;利用Expasy中的TMHMM工具(http://www.cbs.dtu.dk/services/TMHMM-2.0)预测GrDXR蛋白的跨膜螺旋区;利用在线工具WOLF PSORT(http://www.wolfpsort.org)预测GrDXR的亚细胞定位情况。
2.4 重组质粒pGEX-4T-1-GrDXR在大肠杆菌中的表达利用热激法将重组质粒pGEX-4T-1-GrDXR转化大肠杆菌Rosetta(DE3)感受态细胞,挑取单菌落接种于3 mL含100 mg/L氨苄青霉素LB液体培养基中,37 ℃、250 r/min培养12 h。然后以1∶100比例转接到无抗生素的LB液体培养基中,37 ℃、250 r/min培养3 h至A600≈0.8,在37 ℃、终浓度为1 mmol/L IPTG诱导下进行表达,同时以相同条件的pGEX-4T-1转化菌作为对照。分别诱导0、2、4、6 h后收集菌液2 mL。4 ℃、8 000 r/min离心1 min,弃上清,加入100 μL ddH2O、25 μL的5×SDS-PAGE上样缓冲液,震荡悬菌,沸水煮5 min。4 ℃、13 000 r/min离心5 min。取20 μL上清上样,进行SDS-PAGE(5%浓缩胶和10%分离胶)电泳检测。
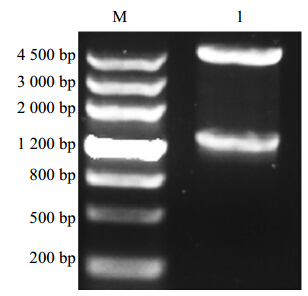
3 结果与分析 3.1 滇龙胆GrDXR cDNA序列的克隆以滇龙胆幼叶cDNA为模板,扩增出1 500 bp左右的片段(图 1)。通过TA克隆获得重组质粒pMD19-GrDXR,酶切检测正确后进行测序,结果表明所扩增序列与转录组测序序列一致。
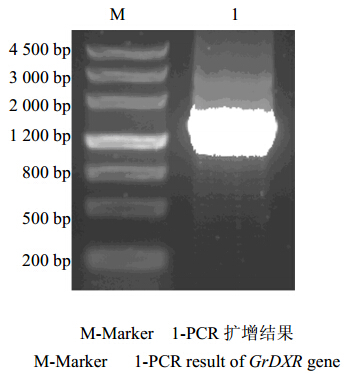 | 图 1 GrDXR基因的PCR结果Fig. 1 PCR result of GrDXR gene |
利用Genetyx软件对GrDXR的序列进行分析,结果显示GrDXR基因的开放阅读框(ORF)为1 425 bp,编码474个氨基酸,将该序列上传至GenBank数据库,获得登录号KF941189;Gentyx推测GrDXR蛋白相对分子质量为51 340,pI为5.60。
利用GeneBank数据库中的BLASTp程序对GrDXR的氨基酸进行同源性分析,结果表明滇龙胆GrDXR蛋白与萝芙木HvDXR蛋白和橡胶树HvDXR蛋白相似性最高(89.64%),与银杏GbDXR蛋白和紫杉TcDXR蛋白序列的相似性较低(75.85%)。
利用MEGA软件将GrDXR氨基酸序列与从NCBI中挑选的同源性较高的部分已知序列进行系统进化分析,结果表明滇龙胆与萝芙木、橡胶树和长春花亲缘关系较近,与银杏、紫杉和喜树等植物中的DXR亲缘关系较远(图 2)。
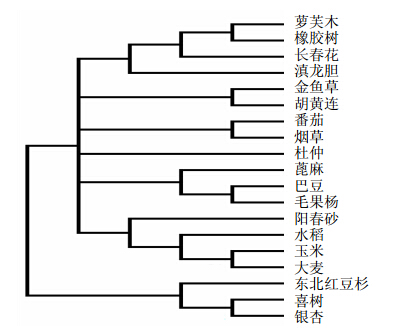 | 图 2 GrDXR蛋白与其他植物DXR蛋白的系统发育分析Fig. 2 Phylogentic relationship of GrDXR protein and some other DXR proteins |
利用DNAMAN将GrDXR氨基酸序列与从NCBI中挑选的同源性较高的部分已知序列进行多序列比对分析,结果表明GrDXR蛋白与已知蛋白序列高度保守(图 3)。
 | 图 3 GrDXR与其他植物中DXR序列的比对结果Fig. 3 Multiple sequence alignment of GrDXR with DXR sequences in other plants |
通过使用ExPASy ProtParam tool进行分析,GrDXR蛋白相对分子质量为51 350,理论pI值为5.66,分子式为C2312H3682N606O687S12。半衰期为30 h,不稳定指数为36.78,属于稳定蛋白;脂肪指数为101.86,总平均疏水性(GRAVY)为0.013。蛋白质的疏水性通常依据蛋白的GRAVY值来预测,GRAVY值在2~−2,若为正值,则此蛋白为疏水蛋白,反之则为亲水性蛋白。因此,GrDXR为疏水蛋白(图 4)。GrDXR蛋白含有20种氨基酸,其中亮氨酸的量最高,为10.5%;其次是丙氨酸和丝氨酸,分别为9.5%和8.2%;色氨酸量最低,为1.3%。对GrDXR进行稀有密码子分析,结果表明GrDXR基因中稀有密码子占1.05%,无二联或三联稀有密码子连续出现的情况,因此可选用BL21或Rosetta(DE3)进行原核表达。
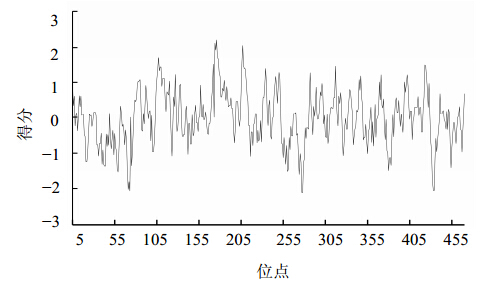 | 图 4 GrDXR蛋白的疏水性分析Fig. 4 Hydrophobicity analysis of GrDXR protein |
利用SSpro方法对GrDXR进行二级结构分析。结果表明该蛋白二级结构中α-螺旋(H)占39.03%,β-折叠(E)占14.14%,无规则卷曲(C)占46.84%。利用Swiss-Model Workspace预测GrDXR蛋白的三级结构,从图中可以看到GrDXR的三级结构主要由α-螺旋结构和无规则卷曲组成,与二级结构预测结果一致;另外,其三级结构形成能够结合底物的凹形区域(图 5)。
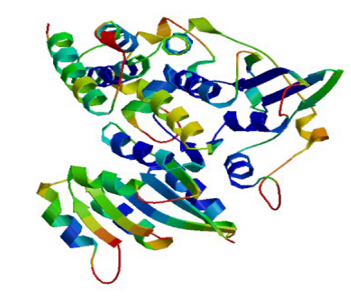 | 图 5 GrDXR的三级结构预测Fig. 5 Predicted three dimensional structure of GrDXR protein |
采用InterProScan在线工具预测GrDXR蛋白的保守结构域。结果表明GrDXR蛋白具有4个保守结构域(图 6),分别为NAD (P)-binding domain (IPR016040,71-225),1-deoxy-D-xylulose 5-phosphatereductoisomerase,N-terminal(IPR013-512,79-207),1-deoxy-D-xylulose 5-phosphate reductoisomerase,C-terminal(IPR013644,221-304)和DXP reductoisomeraseC-terminal domain(IPR026877,336-462)。利用ExPASy SignalP 4.0 Server分析GrDXR蛋白,未发现信号肽,表明该蛋白为非分泌型蛋白。利用Expasy 中的TMHMM工具预测GrDXR蛋白的跨膜螺旋区,结果表明GrDXR蛋白为非膜蛋白。利用在线工具WOLF PSORT预测GrDXR蛋白的亚细胞定位情况,结果显示该蛋白可能定位于叶绿体。使用ChloroP在线软件对叶绿体转运肽进行预测,结果表明GrDXR蛋白含有叶绿体转运肽,为第1~50个氨基酸。
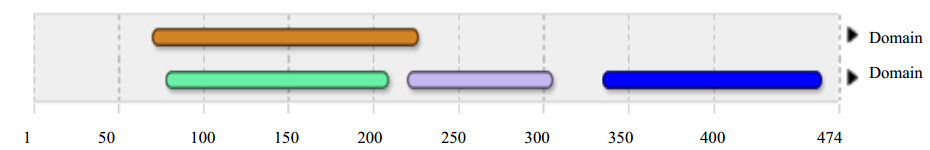 | 图 6 GrDXR蛋白保守结构域的预测Fig. 6 Prediction of conserved domains of GrDXR protein |
使用BamHI和 XhoI双酶切质粒pGEX-4T-1- GrDXR,可切出目的片段(图 7),表明GrDXR基因已成功插入载体pGEX-4T-1中。重组表达质粒 pGEX-4T-1-GrDXR测序结果表明,目的基因与原序列一致,且未出现碱基突变及移码现象。这些结果表明已获得正确的重组质粒pGEX-4T-1-GrDXR。
 | M-Marker 1-质粒pGEX-4T-1-GrDXR的BamHI和XhoI双酶切结果 M-Marker 1-digestion result of plasmid pGEX-4T-1-GrDXR by BamHI and XhoI图 7 质粒pGEX-4T-1-GrDXR酶切检测Fig. 7 Digestion of pGEX-4T-1-GrDXR plasmid |
将重组质粒pGEX-4T-1-GrDXR转化大肠杆菌Rosetta(DE3)后进行IPTG诱导表达。在37 ℃、IPTG终浓度为1 mmol/L下,分别诱导表达0、2、4、6 h后,提取总蛋白进行SDS-PAGE分析。结果表明,与对照相比,pGEX-4T-1-GrDXR工程菌经IPTG诱导后,在相对分子质量77 340(含GST蛋白)左右有1条蛋白条带,表明重组质粒pGEX-4T-1-GrDXR在大肠杆菌Rosetta(DE3)中诱导表达了GrDXR蛋白。当温度为37 ℃、诱导时间为6 h时,蛋白表达量最大(图 8),可直接用于下一步的蛋白纯化。
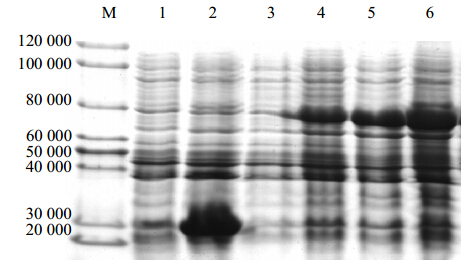 | M-Marker 1~2-pGEX-4T-1转化菌诱导0和6 h的总蛋白 3~6-pGEX-4T-1-GrDXR工程菌诱导0、2、4和6 h的总蛋白 M-Marker 1—2-pGEX-4T-1 bacteria with 1 mmol/L of IPTG induction for 0 and 6 h 3—6-pGEX-4T-1-GrDXR bacteria induced for 0, 2, 4, and 6 h图 8 37 ℃下不同诱导时间对GrDXR蛋白表达量的影响Fig. 8 Effect of different inducing time on expression of GrDXR protein at 37 ℃ |
DXR是MEP途径的限速酶[2],因此克隆和鉴定DXR基因功能对于MEP途径研究非常重要。一般地,在植物基因组中DXR基因仅有1个拷贝[5]。目前,在滇龙胆转录组中,仅检测到1个GrDXR基因。本研究从滇龙胆幼叶中成功扩增出GrDXR基因,序列分析结果表明GrDXR蛋白与萝芙木、橡胶树和长春花中的DXR蛋白亲缘关系最近,暗示着它们具有相同或相似的功能。DXR蛋白催化DXP的反应需要NADPH的存在[2],因此NADPH结合结构域对DXR酶的活性至关重要。结构域预测结果表明,GrDXR在其N端具有NAD(P)结合结构域GSTGSIGT和LAAGSNV、中间具有LPADSEHSAI和NKGLEVIEAHY 2个底物结合结构域、DXR的N末端和C末端结构域,这与其他植物中的DXR高度同源[22](图 7),进一步表明所克隆基因编码GrDXR蛋白。所有植物DXR成熟蛋白在N端都有1个富含脯氨酸的区域,而在原核生物中却没有[7]。在GrDXR蛋白N端56~64位存在富含脯氨酸的PPPAWPGRA结构域。叶绿体或质体转运肽存在于所有植物DXR蛋白中,能够介导酶进入存在MEP途径的质体中[23]。本研究中,预测到GrDXR蛋白中存在叶绿体转运肽,长度为50个氨基酸。酶基因的功能体现在蛋白质上,本研究构建了原核表达载体pGEX-4T-1-GrDXR,转入大肠杆菌Rosetta(DE3),并成功诱导表达出GrDXR蛋白。该研究为滇龙胆GrDXR蛋白结构和功能研究奠定基础,也为萜类代谢工程提供候选基因。
| [1] | 国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1998. |
| [2] | Takahashi S, Kuzuyama T, Watanabe H, et al. A 1-deoxy-D-xylulose 5-phosphate reductoisomerase catalyzing the formation of 2-C-methyl-D-erythritol 4-phosphate in an alternative nonmevalonate pathway for terpenoid biosynthesis[J]. Proc Natl Acad Sci, 1998, 95(17): 9879-9884. |
| [3] | Yao H, Gong Y, Zuo K, et al. Molecular cloning, expression profiling and functional analysis of a DXR gene encoding 1-deoxy-d-xylulose 5-phosphate reduc-toisomerase from Camptotheca acuminata[J]. J Plant Physiol, 2008, 165(2): 203-213. |
| [4] | Seetang-Nun Y, Sharkey T D, Suvachittanont W. Molecular cloning and characterization of two cDNAs encoding 1-deoxy-d-xylulose 5-phosphate reductoiso- |
| [5] | Zhang M, Li K, Liu J, et al. Identification and differential expression of two isogenes encoding 1-deoxy-d-xylulose 5-phosphate reductoisomerase in Glycine max[J]. Plant Biotechnol Rep, 2012, 6(4): 363-371. |
| [6] | Rohdich F, Lauw S, Kaiser J, et al. Isoprenoid biosynthesis in plants-2C-methyl-D-erythritol-4-phosphate synthase (IspC protein) of Arabidopsis thaliana[J]. FEBS J, 2006, 273(19): 4446-4458. |
| [7] | Carretero-Paulet L, Ahumada I, Cunillera N, et al. Expression and molecular analysis of the Arabidopsis DXR gene encoding 1-deoxy-d-xylulose 5-phosphate reductoisomerase, the first committed enzyme of the 2-C-methyl-d-erythritol 4-phosphate pathway[J]. Plant Physiol, 2002, 129(4): 1581-1591. |
| [8] | Hans J, Hause B, Strack D, et al. Cloning, characterization, and immunolocalization of a mycorrhiza-inducible 1-deoxy-d-xylulose 5-phosphate reductoisomerase in arbuscule-containing cells of maize[J]. Plant Physiol, 2004, 134(2): 614-624. |
| [9] | Cordoba E, Salmi MLeón P. Unravelling the regulatory mechanisms that modulate the MEP pathway in higher plants[J]. J Exp Bot, 2009, 60(10): 2933-2943. |
| [10] | Mahmoud S S, Croteau R B. Metabolic engineering of essential oil yield and composition in mint by altering expression of deoxyxylulose phosphate reductoisomerase and menthofuran synthase[J]. Proc Natl Acad Sci, 2001, 98(15): 8915-8920. |
| [11] | Veau B, Courtois M, Oudin A, et al. Cloning and expression of cDNAs encoding two enzymes of the MEP pathway in Catharanthus roseus[J]. BBA-Gene Struct Expr, 2000, 1517(1): 159-163. |
| [12] | Carretero-Paulet L, Cairó A, Botella-Pavía P, et al. Enhanced flux through the methylerythritol 4-phosphate pathway in Arabidopsis plants overexpressing deoxyxylulose 5-phosphate reductoisomerase[J]. Plant Mol Bio, 2006, 62(4/5): 683-695. |
| [13] | Hasunuma T, Takeno S, Hayashi S, et al. Overexpression of 1-deoxy-D-xylulose-5-phosphate reductoisomerase gene in chloroplast contributes to increment of isoprenoid production[J]. J Biosci Bioeng, 2008, 105(5): 518-526. |
| [14] | Han M, Heppel S C, Su T, et al. Enzyme inhibitor studies reveal complex control of methyl-D-erythritol 4-Phosphate (MEP) pathway enzyme expression in Catharanthus roseus[J]. PLoS One, 2013, 8(5): e62467. |
| [15] | 中国药典[S]. 一部. 2010. |
| [16] | Zhang J, Zhang J, Wang Y, et al. Effects of tree species on seed germination and seedlings growth of Chinese medicinal herb Gentiana rigescens[J]. Allelopathy J, 2012, 29(2): 325-332. |
| [17] | Zhang J, Wang Y, Yang T, et al. Use of gibberellic acid to overcome the allelopathic effect of a range of species on the germination of seeds of Gentiana rigescens, a medicinal herb[J]. Seed Sci Technol, 2012, 40(3): 443-447. |
| [18] | Wong K L, But P P H, Shaw P C. Evaluation of seven DNA barcodes for differentiating closely related medicinal Gentiana species and their adulterants[J]. Chin Med, 2013, 8: 16. |
| [19] | Nakatsuka T, Saito M, Sato-Ushiku Y, et al. Development of DNA markers that discriminate between white-and blue-flowers in Japanese gentian plants[J]. Euphytica, 2012, 184(3): 335-344. |
| [20] | Nakatsuka T, Yamada E, Saito M, et al. Heterologous expression of gentian MYB1R transcription factors suppresses anthocyanin pigmentation in tobacco flowers[J]. Plant Cell Rep, 2013, 32(12): 1925-1937. |
| [21] | Nakatsuka T, Saito M, Yamada E, et al. Isolation and characterization of GtMYBP3 and GtMYBP4, orthologues of R2R3-MYB transcription factors that regulate early flavonoid biosynthesis, in gentian flowers[J]. J Exp Bot, 2012, 63(18): 6505-6517. |
| [22] | Reuter K, Sanderbrand S, Jomaa H, et al. Crystal structure of 1-deoxy-D-xylulose-5-phosphate reducto- |
| [23] | Yang J, Adhikari M N, Liu H, et al. Characterization and functional analysis of the genes encoding 1-deoxy- d-xylulose-5-phosphate reductoisomerase and 1-deoxy-d-xylulose-5-phosphate synthase, the two enzymes in the MEP pathway, from Amomum villosum Lour[J]. Mol Biol Rep, 2012, 39(8): 8287-8296. |
 2014, Vol. 45
2014, Vol. 45


