2. 天津市北辰中医医院 药剂科, 天津 300400
2. Department of Pharmacy, Beichen Hospital of Traditional Chinese Medicine, Tianjin 300400, China
薯蓣皂苷(dioscin)是甾体总皂苷的一种,因其广泛的药理作用受到国内外研究学者的重视。现代药理研究表明其具有抗肿瘤[1, 2]、治疗心血管疾病[3, 4]、调节免疫功能[5]以及脑血管作用[6]等;同时研究发现其还具有降低血糖的作用[7],并且适量浓度的薯蓣皂苷元(diosgenin)还可以预防和治疗骨质疏松[8]。薯蓣皂苷在心血管疾病中的作用非常显著,有研究发现其具有减慢心率、降低血压、增加冠脉流量、改善心脏舒张功能及保护缺血损伤心肌等作用[9]。含有薯蓣皂苷的药品(例如维奥欣)已上市,广泛应用于冠心病的预防和治疗。近年来,关于薯蓣皂苷在心血管方面的研究更加深入,文献报道其可以促进L型钙离子通道失活并抑制正常大鼠心室肌细胞L型钙离子通道电流(ICa,L)、降低ICa,L峰值,从而发挥其抗缺血再灌所致心律失常的作用[10],但是关于其对钠离子通道的研究未见报道。因此,本实验采用血清药理学与全细胞膜片钳技术相结合的方法,观察薯蓣皂苷含药血清对大鼠正常心室肌细胞钠离子通道电流(INa)的影响,旨在探讨其保护心肌细胞和抗心律失常发生机制与钠离子通道之间的关系。
1 材料 1.1 动物Wistar大鼠,雌雄兼用,体质量230~250 g,由北京维通利华实验动物技术有限公司提供,合格证号SCXK(京)2007-0001。
1.2 实验药物薯蓣皂苷,由国家天然药物研究中心提供,质量分数为98%,低温避光保存,使用时用蒸馏水配成实验所需浓度。
1.3 试剂氯化胆碱、Na2ATP、胶原酶II均购自Sigma公司,其他均为国产分析纯。无钙台氏液(mmol/L):NaCl 136、KCl 5.4、MgCl2 1.0、NaH2PO4 0.33、HEPES 10、葡萄糖10,用NaOH调pH值至7.4。细胞保存液(KB液,mmol/L):谷氨酸70、牛磺酸15、KCl 30、KH2PO4 10、MgCl2 0.5、EGTA 0.5、HEPES 10、葡萄糖10,用KOH调pH值至7.35。钠通道电流的细胞外液(mmol/L):氯化胆碱130、CsCl 5.4、CaCl2 0.1、MgCl2 1、NaH2PO4 0.33、葡萄糖10、HEPES 10、NaCl 10、CdCl2 0.1,用CsOH调pH值至7.4。钠通道电流的细胞内液(mmol/L):CsCl 120、MgCl2 5、Na2ATP 5、CaCl2 1、EGTA 11、HEPES 10,用CsOH调pH值至7.2。
1.4 仪器膜片钳仪,MultiClamp 700B,Axon;数-模转换器,DigiData 1440 A,Axon;倒置显微镜,IX51,Olympus;三维操纵仪MP—225,Axon;微电极拉制仪P—97,Sutter Instrument。
2 方法 2.1 薯蓣皂苷含药血清和空白血清的制备Wistar大鼠10只,分别ig给予0.3 g/mL薯蓣皂苷1 mL/kg[11],2次/d,连续4 d,末次给药后1 h于腹主动脉采血,离心后取血清备用。另取Wistar大鼠10只,从腹主动脉取血,离心后取血清,作为空白血清对照组。
2.2 实验分组实验分为正常对照组(加入空白血清100 µL)及低、中、高剂量薯蓣皂苷含药血清组(分别加入1、10、100 µL薯蓣皂苷含药血清原液)。
2.3 单个心室肌细胞的制备用25%乌拉坦麻醉大鼠,仰位固定于鼠台上,舌下给予肝素后迅速剪开胸腔暴露心脏,从主动脉根部离断,取出心脏放入4 ℃台氏液中。去除脂肪及结缔组织,将主动脉逆行插管连接于Langendorff灌流装置(恒温37 ℃)上,以无钙台氏液8 mL/min连续灌流5 min。洗去心脏残血后改用80 mL含16 mg胶原酶II的无钙台氏液进行循环灌流20 min。随着灌流的进行,流出液变得黏稠,心脏颜色逐渐变浅、透明,心脏体积逐渐变大、松软。此时将心脏自左心室分别取出心室肌组织,置于装有KB液的试管中,用吸管轻轻吹打,使之分散成单个细胞后置4 ℃冰箱稳定2 h。
2.4 INa记录应用全细胞膜片钳技术记录单细胞离子电流,微电极用拉制仪两步拉制而成,充灌电极内液后电阻在3~8 MΩ。电流信号经MultiClamp 700B膜片钳放大器、DigiData 1440A数-模转化器及Pclampex 10.1采集、贮存及分析。将细胞悬液置于倒置显微镜工作平台上的容积为1 mL的浴槽中,待细胞贴壁后,用钠通道电流的细胞外液进行灌流,体积流量为1 mL/min。选用大小相近且纹理清晰的杆状细胞进行实验。待高阻封接形成以后,进行膜电容、串联电阻及漏电流补偿。平衡5 min待电极钠内液与细胞内液交换充分后,进行膜电流记录。膜电流的大小以电流密度即单位膜电容的膜电流表示。
2.5 数据处理实验数据以x±s表示,采用SPSS 11.0软件单因素方差分析和LSD检验,以相关系数做量效关系显著性检验[12]。
3 结果 3.1 薯蓣皂苷含药血清对INa的影响形成全细胞构型后,在电压钳模式下记录电流。将保持电压固定于−100 mV,指令电压−90 mV,以10 mV为步阶至50 mV,记录INa。以去极化的电位为横坐标,相应的最大电流密度为纵坐标绘制出电流-电压(I-V)曲线。结果显示1、10、100 μL(均为含药血清原液的体积)薯蓣皂苷含药血清使I-V曲线发生明显下移,内向电流显著增加;1 μL的薯蓣皂苷含药血清使INa的峰值由(−52.10±3.80)pA/pF变为(−57.31±3.76)pA/pF,而10、100 μL的薯蓣皂苷含药血清使INa的峰值由(−52.10±3.80)pA/pF变为(−76.44±4.09)、(−81.96±4.70)pA/pF,分别增加了47%和57%,具有统计学意义(P<0.01),且呈剂量依赖性(r=0.731 8,P<0.01)。结果见图 1。
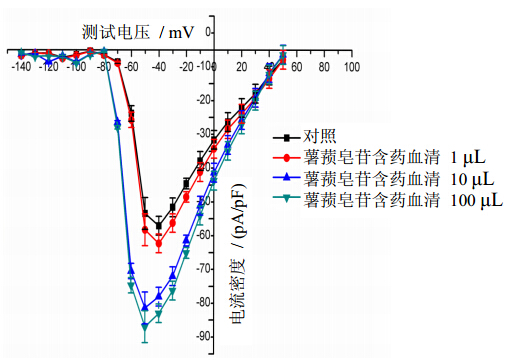 | 图 1 薯蓣皂苷含药血清对大鼠心室肌细胞INa的影响(x±s,n=8)Fig. 1 Effects of serum containing dioscin on INa density in ventricular myocytes of rats New components isolated from mistletoe medium for PSB biotransforming(x±s,n=8) |
将INa的I-V曲线的结果转为膜电导(G),并对去极化电位作图,采用Bolzmann方程[13]:G/Gmax=I/{I+exp [(Vm-V1/2)/K]}进行曲线拟合,得到INa的稳态激活曲线,式中Gmax为最大膜电导,V1/2为半数稳态激活电压,K为斜率参数。结果表明:1、10、100 μL的薯蓣皂苷含药血清均可使激活提前,激活曲线明显左移,V1/2分别由(−57.69±1.86)mV变为(−59.71±2.57)、(−66.56±1.32)(P<0.01)和(−68.52±3.91)mV(P<0.01),见图 2;而K值无明显变化,各组间无显著性差异。结果见图 2。
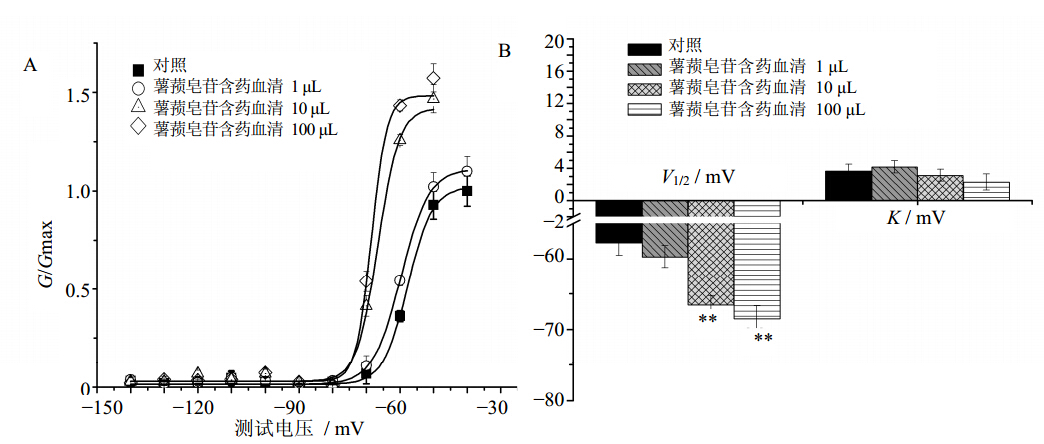 | 与对照组比较:**P<0.01,下同 **P < 0.01 vs control group, same as below图 2 薯蓣皂苷含药血清对INa稳态激活曲线 (A) 和相关参数 (B) 的影响(x±s,n=8)Fig. 2 Effects of serum containing dioscin on INa steady-state activation curves (A) and relative coefficients (B)in ventricular myocytes of rat s (x±s,n=8) New components isolated from mistletoe medium for PSB biotransforming |
采用双脉冲刺激法测定失活曲线,保持电位−80 mV施予50 ms,阶跃10 mV,−150~30 mV系列条件脉冲刺激,在每一条件脉冲后紧跟-固定去极化至−30 mV,25 ms的测试脉冲。以相对电流(I/Imax)对条件脉冲电压作图,得出INa失活曲线。依Bolzmann方程[13]:I/Imax=I/{I+exp [(Vm-V1/2)/K]},其中Imax为最大膜电流,V1/2为半数稳态失活电压,K为失活曲线斜率。结果表明,1、10、100 μL的薯蓣皂苷含药血清对INa失活曲线没有影响,与对照组相比不同剂量的薯蓣皂苷含药血清对半数稳态失活电压无明显影响(P>0.05)。结果见图 3。
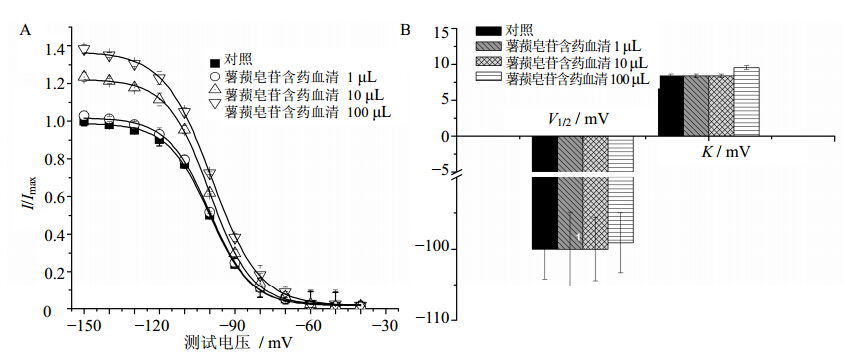 | 图 3 薯蓣皂苷含药血清对INa稳态失活曲线 (A) 和相关参数 (B) 的影响(x±s,n=8)Fig. 3 Effects of serum containing dioscin on INa steady-state inactivation curves (A) and relative coefficients (B)in ventricular myocytes of rats(x±s,n=8) |
3.4 薯蓣皂苷含药血清对INa稳态复活曲线的影响
保持电位−80 mV,施予500 ms、−40 mV的方波刺激后,复极至−80 mV,分别间隔10、20、40、80、160、320、640、1 280 ms后再施予第2次25 ms、−40 mV的方波刺激。以第2次方波引出的电流幅值对间隔时间作图,并进行曲线拟合,依照方程[13]:I=A1exp (−t/τ)+A0,求出恢复时间常数(τ)。结果显示:1、10、100 μL薯蓣皂苷含药血清剂量依赖性加速钠离子通道的恢复过程,其τ值由(150.73±21.49)ms分别变为(143.19±13.88)、(84.83±18.03)(P<0.01)、(80.63< span style='font-family:宋体'>±13.89)ms(P<0.01)。结果见图 4。
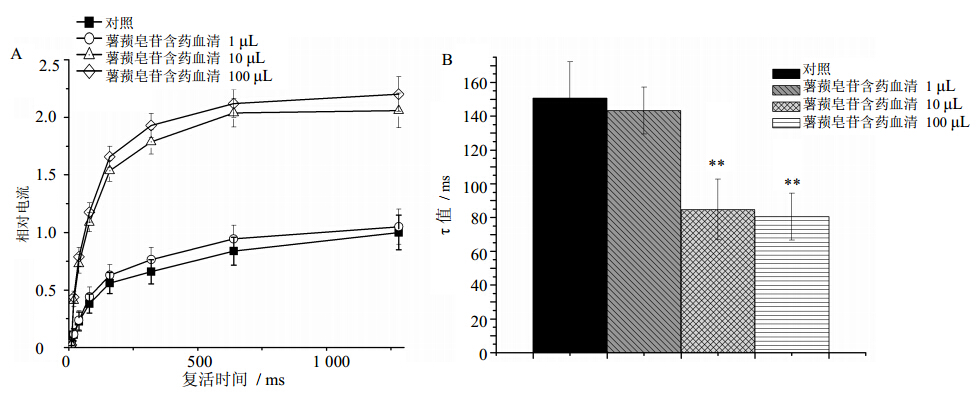 | 图 4 薯蓣皂苷含药血清对INa稳态复活曲线(A) 和相关参数 (B) 的影响(x±s,n=8)Fig. 4 Effects of serum containing dioscin on INa steady-state recovery process curves (A) and relative coefficients (B)in ventricular myocytes of rats (x±s,n=8) |
4 讨论
近年来,薯蓣皂苷在心血管方面的应用十分广泛,有研究表明,薯蓣皂苷能通过不同途径改善心肌损伤、保护心肌细胞、减轻心肌细胞钙超载,保护缺氧心肌作用[14]。同时其还可以在一定程度上保持心肌细胞膜的完整性,对心功能具有明显的保护作用[15]。同时有文献显示薯蓣皂苷元对心肌梗死也有明显的保护作用[16]。更有临床研究表明薯蓣皂苷能显著改善重症充血性心衰患者的心功能,使心功能都显著提高[17]。
钠离子通道是心脏离子通道之一,其与心律失常的发生、发展均有紧密的关系。钠离子通道的重要功能之一是激活Na+快速内流,心肌细胞去极化,形成动作电位0相[18]。因此,当心肌细胞Na+通道发生改变,细胞内Na+浓度发生变化时,可能会引起各种类型的心律失常的发生,因此,钠离子通道是许多抗心律失常药物的作用靶点。本实验通过薯蓣皂苷含药血清结合全细胞膜片钳技术,观察薯蓣皂苷含药血清对钠离子通道的作用,发现薯蓣皂苷含药血清通过加快激活及恢复过程促进钠离子内流,这有别于I类抗心律失常药。Hegyi等[19]报道传统的特异性钠通道激活剂及阻断剂对钙离子通道也会有影响。薯蓣皂苷含药血清对钠离子通道的促进作用可能通过钠-钙交换体间接影响细胞内的钙离子浓度,因此推测薯蓣皂苷可能具有正性肌力作用。此前也有研究显示薯蓣皂苷具有增强心肌收缩力,减慢心率的作用[20]。薯蓣皂苷对钠离子通道的具体作用机制有待进一步研究。
| [1] | 岳雷, 陈玲, 寇俊萍, 等. 薯蓣皂苷元药理活性及其机制研究进展[J]. 中国临床药理学与治疗学, 2010, 15(2): 233-237. |
| [2] | 何焱, 王继双, 张鹏, 等. 薯蓣皂苷元药理作用及其机制研究进展[J]. 中草药, 2013, 44(19): 2759-2765. |
| [3] | 盛芳园, 何忠梅, 陈凯, 等. 薯蓣皂苷元的提取分离、检测方法及药理作用研究进展[J]. 时珍国医国药, 2013, 24(4): 914-916. |
| [4] | 付晓丽, 张士俊, 韩英梅. 薯蓣皂苷元衍生物的合成及其抗血栓形成活性[J]. 现代药物与临床, 2011, 26(1): 46-49. |
| [5] | Jung D H, Park H J, Byun H E, et al. Diosgenin inhibits macrophage-derived inflammatory mediators through downregulation of CK2, JNK, NF-kappaB and AP-1 activation[J]. Int Immunopharmacol, 2010, 10(9): 1047-1054. |
| [6] | 张凤霞, 王新陆, 高聆, 等. 薯蓣皂苷元的研究[J]. 吉林中医药, 2013, 33(1): 75-77. |
| [7] | McAnuff M A, Omoruyi F O, Morrison E Y, et al. Changes in some liver enzymes in streptozotocin-induced diabetic rats fed sapogenin extract from bitter yam (Dioscorea polygonoides) or commercial diosgenin[J]. West Indian Med J, 2005, 54(2): 99-101. |
| [8] | 汪洋珍, 王俊俊, 梁继超, 等. 薯蓣皂苷对大鼠成骨细胞增殖、分化及OPG/RANKL mRNA表达的影响[J]. 中华中医药杂志, 2010, 25(1): 134-136. |
| [9] | 高卫真, 王玮, 范晓静, 等. 薯蓣皂苷对培养乳鼠心肌细胞缺氧/复氧损伤的保护作用[J]. 中国分子心脏病学杂志, 2008, 8(2): 72-74. |
| [10] | 张铭慧, 尹永强, 何海燕, 等. 薯蓣皂苷对大鼠心室肌细胞钙离子通道的影响[J]. 中药药理与临床, 2011, 27(1): 23-26. |
| [11] | 赵云茜, 康毅, 高卫真, 等. 薯蓣皂苷对大鼠心肌缺血再灌注损伤的保护作用[J]. 中国心血管杂志, 2008, 13(6): 434-437. |
| [12] | 魏伟, 吴希美, 李元健. 药理实验方法学[M]. 第4版. 北京: 人民卫生出版社, 2010. |
| [13] | Zhao Z, Yin Y, Wu H, et al. Arctigenin, a potential anti-arrhythmic agent, inhibits aconitine-induced arrhythmia by regulating multi-ion channels[J]. Cell Physiol Biochem, 2013, 32(5): 1342-1353. |
| [14] | 张伟峰, 刘宝山. 薯蓣皂苷的药理作用研究进展[J]. 世界中西医结合杂志, 2010, 5(6): 543-545. |
| [15] | 汪玲芳, 赵云茜, 高卫真, 等. 薯蓣皂苷增强大鼠缺血再灌注损伤后心肌抗氧化能力[J]. 中药药理与临床, 2009, 25(5): 44-46. |
| [16] | Jayachandran K S, Vasanthi H R, Rajamanickam G V. Antilipoperoxidative and membrane stabilizing effect of diosgenin, in experimentally induced myocardial infarction[J]. Mol Cell Biochem, 2009, 327(1/2): 203-210. |
| [17] | 张冬梅, 孙秀月. 薯蓣皂苷在重症充血性心衰治疗中的应用体会[J]. 中国社区医师, 2010, 36(12): 143. |
| [18] | 李姝, 王得利, 栾海蓉. 心肌离子通道的研究进展[J]. 牡丹江医学院学报, 2009, 30(3): 73-75. |
| [19] | Hegyi B, Komáromi I, Nánási P P, et al. Selectivity problems with drugs acting on cardiac Na+ and Ca2+ channels[J]. Curr Med Chem, 2013, 20(20): 2552-2571. |
| [20] | 郭卫莉, 王玮, 高卫真, 等. 薯蓣皂苷对缺氧/复氧所致的乳鼠心肌细胞凋亡的保护作用[J]. 中药药理与临床, 2011, 27(2): 29-32. |
 2014, Vol. 45
2014, Vol. 45



