2. 新疆维吾尔自治区维吾尔医药研究所, 新疆维吾尔医方剂学实验室, 新疆 乌鲁木齐 830049
2. Xinjiang Laboratory of Uighur Medical Prescription, Xinjiang Institute of Traditional Uighur Medicine, Urumqi 830049, China
白癜风是一种获得性色素脱失的皮肤病,全球发病率在2%左右,发病人群以年轻人偏多,通常会影响面部中央和生殖器,往往定位于手和脚[1],虽然白癜风患者没有任何身体及生理上的病痛,但仍遭受严重的心理和压力。据统计66%的白癜风患者因外表而感到尴尬,不愿与他人交流,导致严重的抑郁症,部分患者甚至自杀[2]。目前对白癜风的治疗方法主要有准分子激光、手术疗法和激素治疗[3],但均难以得到广泛的应用,激光和手术治疗给患者带来身体上的痛苦和昂贵的费用,激素治疗又导致患者身体免疫力下降[4],因此迫切需要安全有效的治疗方法。
高良姜是一种常用的中药材,在传统的维吾尔医药复方制剂中被用于治疗白癜风[5],本课题组前期研究结果表明高良姜具有治疗白癜风的作用,并通过体外谱效结合方法确认高良姜治疗白癜风的有效物质基础之一是高良姜素[6]。本研究重点研究不同质量分数的高良姜素对氢醌诱导的白癜风小鼠模型的治疗作用,并阐明其可能的作用机制。
1 材料 1.1 仪器BIO—RAD550型酶标仪(美国伯乐公司);LDZX—75KBS立式压力蒸汽灭菌器(上海申安医疗器械厂);BECKMAN高速低温离心机(美国PE公司); BS224S Sartorius精密电子天平(赛多利斯科学仪器北京有限公司)。
1.2 实验动物C57BL/6小鼠90只,雄性,体质量(20±2)g,购自北京维通利华实验动物技术有限公司,动物合格证号SCXK(京)2012-0001。
1.3 试药质量分数为90%、99%高良姜素,均为自制[7];8-甲氧基补骨脂素(8-MOP,东京化成工业株式会社);氢醌(天津市登科化学试剂有限公司),参考文献方法[8]制成2.5%氢醌软膏;胆碱酯酶(CHE)试剂盒、丙二醛(MDA)试剂盒(南京建成科技有限公司);小鼠酪氨酸酶(TYR)ELISA试剂盒(上海生工生物科技有限公司)。
2 方法 2.1 分组、模型制备与给药C57BL/6小鼠90只适应性饲养3 d后,以体质量为指标,随机分为对照组、模型组、8-MOP组(4.250 mg/kg)和90%、99%高良姜素低、中、高剂量(0.425、4.250、42.500 mg/kg)组,每组10只。采用松香/蜡混合物脱去各组小鼠背部毛发约2 cm×2 cm,脱毛后第6天开始造模,于小鼠背部涂抹2.5%氢醌软膏0.5 g,对照组小鼠背部涂抹蒸馏水,连续涂抹65 d;造模第26天各给药组开始ig给药,连续给药40 d,每天进行皮肤拍照。实验期间观察小鼠皮肤颜色变化,末次给药2 h后,摘眼球采血,分离血清。
2.2 生化指标的测定[8,9]取小鼠血清,分别按TYR、MDA、CHE试剂盒说明书操作,分别于酶标仪520、532、490 nm处测定吸光度(A)值,分别计算TYR、MDA水平及CHE活性。
2.3 小鼠皮肤含黑色素毛囊计数用手术刀沿C57BL/6小鼠脊椎线方向切取0.5 cm×1 cm的皮肤组织,并记录编号;固定于10%中性福尔马林中;HE染色后,进行皮肤组织学观察、毛囊计数,用光镜观察50个毛囊,记录含有黑色素的毛囊数。
2.4 基底层黑素细胞的测定[10]用手术刀沿C57BL/6小鼠脊椎线方向切取0.5 cm×1 cm的皮肤组织,并记录编号;固定于10%中性福尔马林中24 h;流水冲洗3~4 min;放入含0.1 mol/L的磷酸盐缓冲液(pH 7.4)的0.1%多巴中,于37 ℃静置1 h;换入新鲜的多巴试剂中,37 ℃静置12 h;流水再冲洗10 min;用Bouin氏液固定24 h后,将标本取出后流水冲洗4 h后脱水,常规石蜡包埋切片;脱蜡至水,切制薄切片,附贴于载玻片上。将切片脱蜡移至水洗。用苏木素-伊红对比染色。脱水,透明,中性树胶封固。多巴氧化酶染色后,黑素细胞阳性显示为棕黑色染色。分别于光镜下测定每个高倍镜视野内各组黑素细胞数量,每个标本观察10个高倍镜视野,计算每100个表皮基底细胞中黑素细胞的平均数量。
2.5 含黑素颗粒的表皮细胞的测定[10]将固定于10%中性福尔马林的皮肤组织,包埋、切片后,用氯化铁和铁氰化钾混合液浸染15~20 min;以1%醋酸水溶液分化30 s,自来水洗涤数次,95%酒精及无水酒精迅速脱水,二甲苯透明,中性树胶封固。Lillie染色后,黑色素呈暗绿色为阳性,分别于光镜下测定各组含黑素颗粒的表皮细胞数量,每个标本观察10个高倍镜视野,计算每100个表皮基底细胞中含黑素颗粒的基底细胞的平均数量。
2.6 TYR蛋白表达的测定将固定于10%中性福尔马林的皮肤组织,常规石蜡包埋、切片后,采用链霉素抗生物素蛋白-过氧化物酶常规染色,一抗为TYR单克隆抗体,二抗为生物素标记,DAB显色。采用免疫组化方法进行TYR蛋白表达的测定,各抗体在显镜下细胞内出现黄色或棕黄色颗粒或团块状为阳性表达。采用二级计分法判定结果,阳性细胞计数<5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分。按染色强度分类:淡黄色1分,黄或深黄2分,褐或棕黄色3分。两者相加小于2分为阴性(−),2~3分为阳性(+),4~5分为中等阳性(++),6~7分为强阳性(+++)。
2.7 数据分析 数据以 ±s表示,采用SPSS 16.0软件进行分析,组间比较采用单因素方差分析。
±s表示,采用SPSS 16.0软件进行分析,组间比较采用单因素方差分析。
末次给药后对各组小鼠皮肤肉眼观察并拍照记录,图 1可以看出模型组小鼠背部毛发明显较对照组变白,给予不同质量分数的高良姜素后小鼠背部毛发明显变黑。
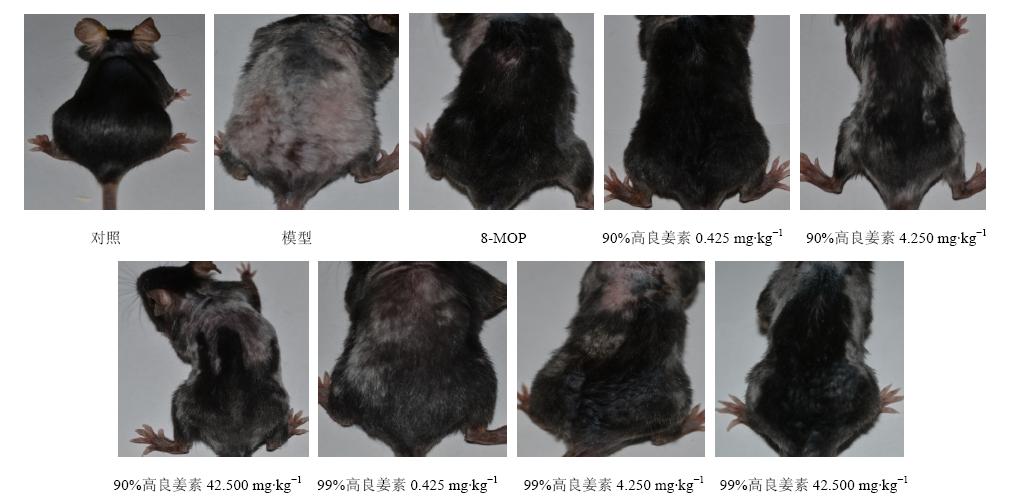 | 图 1 治疗后各组小鼠皮肤照片Fig. 1 Photographs of mice in each group after treatment |
表 1结果表明,与对照组相比,模型组小鼠背部皮肤中含黑色素的毛囊数、基底层黑素细胞数和含黑素颗粒的表皮细胞数均显著下降(P<0.01);给予高良姜素治疗后,各给药组小鼠背部皮肤中含黑色素的毛囊数均显著提高(P<0.01);90%高良姜素给药剂量为4.250 mg/kg时,基底层黑素细胞数和含黑素颗粒的表皮细胞数显著上升(P<0.05、0.01);99%高良姜素给药剂量为4.250、42.500 mg/kg时,显著提高基底层黑素细胞数(P<0.01);99%高良姜素剂量为4.250 mg/kg时,能够显著提高含黑素颗粒的表皮细胞数(P<0.05)。
表 1 不同质量分数高良姜素对小鼠皮肤中含黑色素毛囊数、基底层黑素细胞数和含黑素颗粒表皮细胞数的影响(  ±s ,n=10)
Table 1 Effects of galangin with different purity on melanin-containinghairfollicles,basal melanocytes,and melanin-containing epidermal cells in dorsal skin of mice ( ±s ,n=10)
Table 1 Effects of galangin with different purity on melanin-containinghairfollicles,basal melanocytes,and melanin-containing epidermal cells in dorsal skin of mice (  ±s ,n=10) ±s ,n=10) |
由表 2可知,模型组小鼠血清中TYR水平较对照组显著下降(P<0.01),MDA水平和CHE活性显著升高(P<0.01);给予高良姜素治疗后,90%高良姜素给药剂量为0.425、4.250 mg/kg时,能够显著上调TYR水平,降低MDA水平及CHE活性(P<0.05、0.01);99%高良姜素3个剂量均能够升高血清TYR水平(P<0.05、0.01),而剂量为0.425、4.250 mg/kg时,降低MDA水平(P<0.01),剂量为4.250 mg/kg时,能够显著降低CHE活性(P<0.01)。
表 2 不同质量分数高良姜素对小鼠血清TYR、MDA水平和CHE活性的影响( ±s ,n=10)
Table 2 Effects of galangin with different purity on levels of TYR and MDA,activity of CHE in serum of mice ( ±s ,n=10)
Table 2 Effects of galangin with different purity on levels of TYR and MDA,activity of CHE in serum of mice ( ±s ,n=10) ±s ,n=10) |
表 3结果表明,与对照组相比,模型组小鼠背部皮肤中TYR蛋白表达显著下降(P<0.01);给药治疗后,90%高良姜素剂量为4.250 mg/kg时,TYR蛋白表达水平显著提高(P<0.05);其他给药组均呈上升趋势,但无显著性差异。
| 表 3 不同质量分数高良姜素对小鼠皮肤中TYR蛋白表达的影响 Table 3 Effects of galangin with different purity on TYR protein expression in skin of mice |
长期以来,小鼠被作为研究白癜风的动物模型,现已建立了C57BL/6小鼠模型[11,12],主要观察小鼠背部黑色毛发数量、黑素颗粒及黑色素等指标[13]。皮肤黑色素的形成过程是一系列复杂的生理生化过程,其中包括黑素细胞的迁移、分化,成熟的黑色素细胞、黑色素形成体、黑色素颗粒的运输以及黑色素的排泄。表皮色素细胞和黑色素的消失常常导致皮肤颜色的损失[14];而氢醌是一种已知的TYR抑制剂,也是治疗色素沉着性疾病的有效外用制剂,其机制是抑制TYR催化酪氨酸转化为黑色素,TYR是黑色素合成的限速酶[15]。有研究表明2%的氢醌软膏运用于93例色素沉着患者,63.5%的患者色素减退,无不良反应[16]。本研究制备2.5%氢醌软膏,复制C57BL/6小鼠白癜风模型,结果显示,模型组小鼠背部脱毛区明显长出白色的毛发,组织病理学分析发现模型组小鼠背部皮肤含黑色素毛囊数、基底层黑素细胞以及含黑素颗粒的表皮细胞数均明显较对照组小鼠低,表明白癜风小鼠模型复制成功。
负责毛发色素沉着的黑素细胞主要位于将黑色素向毛干皮质角质细胞转移的毛囊中[17],本研究中,模型组小鼠毛发明显比对照组白,同时含黑色素的毛囊数量也明显比对照组小鼠毛囊数减少,表明含黑色素毛囊的数量直接决定了小鼠毛发的颜色。本研究发现高良姜素治疗组的小鼠背部毛发颜色比模型组明显变黑,并且在所有剂量下,小鼠背部区域含黑色素毛囊的数量显著增加。虽然白癜风是一种获得性色素脱失疾病,皮损病灶部位,黑素生成异常,并且许多研究表明在白癜风病变部位很少或几乎不存在基底层黑素细胞、含黑素颗粒的表皮细胞以及TYR[18]。多巴氧化酶染色试验结果显示,与模型组比较,高良姜素治疗组小鼠背部皮肤基底层黑素细胞数量明显增多,此外含黑素颗粒的表皮细胞数也显著增加,表明高良姜素能够改善氢醌诱导的小鼠白癜风症状。
TYR是黑素合成的限速酶,并在黑素合成的整个生理过程中起着重要的作用。研究表明,白癜风患者皮损部位存在许多抗酪氨酸酶抗体[19]。在本研究中,模型组小鼠血清中TYR水平及皮肤中TYR蛋白表达明显比对照组低,给予高良姜素治疗后,血清TYR水平及皮肤TYR蛋白表达显著增加,表明促进TYR及TYR蛋白表达可能是高良姜素治疗白癜风的作用机制之一。
氧化应激已被作为诱发黑素细胞减少导致白癜风的因素之一[20]。MDA是脂质过氧化反应的终产物和作为氧化应激的具体指标。许多临床研究表明,白癜风患者血清中MDA水平较高,并且白癜风患者的总抗氧化活性较正常人低,正是氧化应激在白癜风发病中起着重要的作用,并导致黑素细胞受损引发白癜风[21]。而CHE增加时,白癜风患者的植物神经功能也常常是紊乱的,CHE能够增强乙酰胆碱和交感神经活性的代谢,降低副交感神经的兴奋性。MDA水平和CHE活性的异常变化将减少黑素合成,诱发白癜风的发生[22,23]。本研究中模型组小鼠血清中MDA量及CHE活性明显较对照组高,与临床检测趋势相同,经高良姜素治疗后,血清MDA及CHE水平显著下降。因此调节MDA水平及CHE活性可能是高良姜素治疗白癜风的另一个作用机制。
以上研究结果表明90%和99%高良姜素对氢醌诱导的白癜风小鼠模型有一定的治疗作用,能够改善白癜风症状。但两种质量分数的高良姜素在剂量与治疗效果上存在一定的差异,两种质量分数高良姜素的3个剂量均能促进小鼠皮肤含黑色素的毛囊数升高,但是两种质量分数的高良姜素给药剂量为4.250 mg/kg时,基底层黑素细胞数和含黑素颗粒的表皮细胞数显著上升;而99%高良姜素给药剂量为42.500 mg/kg时,也能显著提高基底层黑素细胞数;90%高良姜素其他剂量却没有治疗效果。在调节TYR水平上,99%高良姜素3个剂量均能够上调TYR浓度,而90%高良姜素给药剂量为0.425、4.250 mg/kg时,能够显著上调TYR水平;二者在治疗 剂量上存在差异,此外TYR蛋白表达,只有90%高良姜素有促进作用,表明二者的作用机制也存在着差异。研究中也对小鼠皮肤中TRP-1及TRP-2蛋白表达进行检测,结果两种质量分数的高良姜素对这两种蛋白的表达无促进作用(数据未列出),这与体外药效及机制评价结果一致[24]。同时也提示在进行候选化合物研究时,不同质量分数的化合物在治疗效果和作用机制均存在一定的差异,并不是化合物的纯度越高药效越好。本课题组将进一步深入研究,高良姜素可能成为治疗白癜风的潜在候选药物。
| [1] | Agrawal D, Shajil E, Marfatia Y, et al. Study on the antioxidant status of vitiligo patients of different age groups in Baroda[J]. Pig Cell Res, 2004, 17(3): 289-294. |
| [2] | Akrem J, Mrabet Y, Mohamed H. Oxidative stress in experimental vitiligo C57Bl/6 mice[J]. Indian J Dermatol, 2012, 57(4): 221-224. |
| [3] | Arican O, Kurutas E B. Oxidative stress in the blood of patients with active localized vitiligo[J]. Acta Dermatovenerol Alpina Panonica Adriatica, 2008, 17(1): 12-16. |
| [4] | Baharav E, Merimski O, Shoenfeld Y, et al. Tyrosinase as an autoantigen in patients with vitiligo[J]. Clin Exp Immunol, 1996, 105(1): 84-88. |
| [5] | 中华人民共和国卫生部标准维吾尔药分册[S]. 1999. |
| [6] | 霍仕霞, 康雨彤, 彭晓明, 等. 高良姜提取物指纹图谱与其促进黑素生成的谱效关系分析[J]. 中草药, 2013, 44(8): 995-1002. |
| [7] | 康爱荣, 闫明, 彭英, 等. 高良姜中高良姜素的醇提和纯化工艺研究[J]. 中国中医药信息杂志, 2011, 5(18): 44-46. |
| [8] | 何文, 韩瑞玲, 罗顺德. 8-甲氧补骨脂素脂质体凝胶对白癜风模型豚鼠的治疗作用研究[J]. 中国药房, 2005, 16(2): 92-94. |
| [9] | Kale B. Correlation of oxidative stress and antioxidant status with cholinesterases in different grades of organophosphorus toxicity[J]. Int J Sci Res Envion Sci, 2013, 5(8): 85-91. |
| [10] | Birbeck M S, Breathnach A S, Everall J D. An electron microscope study of basal melanocytes and high-level clear cells (langerhans cells) in vitiligo[J]. J Invest Dermatol, 1961, 37(6): 51-64. |
| [11] | Lerner A B, Shiohara T, Boissy R E, et al. A mouse model for vitiligo[J]. J Invest Dermatol, 1986, 87(3): 299-304. |
| [12] | 张兰兰, 闫明, 刘晓东, 等. 两种化学脱色剂对两种动物模拟白癜风作用比较[J]. 医药导报, 2009, 28(6): 690-692. |
| [13] | van den Boorn J G, Konijnenberg D, Dellemijn T A, et al. Autoimmune destruction of skin melanocytes by perilesional T cells from vitiligo patients[J]. J Invest Dermatol, 2009, 129(9): 2220-2232. |
| [14] | Mishima Y, Kawasaki H, Pinkus H. Dendritic cell dynamics in progressive depigmentations. Distinctive cytokinetics of dendritic cells revealed by electron microscopy[J]. Arch Dermatol Forsch, 1972, 243(12): 67-87. |
| [15] | Denton C R, Lerner A B, Fitzpatrick T B. Inhibition of melanin formation by chemical agents[J]. J Invest Dermatol, 1952, 18(2): 119-135. |
| [16] | Fitzpatrick T, Arndt K, Mofty A E, et al. Hydroquinone and psoralens in the therapy of hypermelanosis and vitiligo[J]. Arch Dermatol, 1966, 93(5): 589. |
| [17] | Commo S, Gaillard O, Bernard B A. Human hair greying is linked to a specific depletion of hair follicle melanocytes affecting both the bulb and the outer root sheath[J]. Br J Dermatol, 2004, 150(3): 435-443. |
| [18] | Jarrett A, Szabo G. The pathological varieties of vitiligo and their response to treatment with meladinine[J]. Br J Dermatol, 1956, 68(10): 313-326. |
| [19] | Baharav E, Merimski O, Shoenfeld Y, et al. Tyrosinase as an autoantigen in patients with vitiligo[J]. Clin Exp Immunol, 1996, 105(1): 84-88. |
| [20] | Agrawal D, Shajil E, Marfatia Y, et al. Study on the antioxidant status of vitiligo patients of different age groups in Baroda[J]. Pigment Cell Res, 2004, 17(3): 289-294. |
| [21] | Arican O, Kurutas E B. Oxidative stress in the blood of patients with active localized vitiligo[J]. Acta Dermatovenerol Alpina Panonica Adriatica, 2008, 17(1): 12-16. |
| [22] | Akrem J, Mrabet Y, Mohamed H. Oxidative stress in experimental vitiligo C57Bl/6 mice[J]. Indian J Dermatol, 2009, 54(4): 221-224. |
| [23] | 盛国荣. 退白汤对实验性白癜风动物模型的治疗作用[J]. 中药药理与临床, 2011, 27(6): 88-90. |
| [24] | 霍仕霞, 彭晓明, 高莉, 等. 不同纯度高良姜素对人A375黑色素瘤细胞黑素合成及TYR、TRP-1、-2 mRNA和蛋白的表达影响[J]. 中草药, 2014, 45(2): 244-249. |
 2014, Vol. 45
2014, Vol. 45


