2. 大理学院药学与化学学院, 云南 大理 671000
2. College of Pharmacy and Chemistry, Dali University, Dali 671000, China
东北岩高兰Empetrum nigrum L. var. japonicum K. Koch为岩高兰科(Empetraceae)岩高兰属Empetrum L. 珍稀植物,是岩高兰科在中国仅有的1个变种,在我国主要分布于东北大兴安岭地区[1]。东北岩高兰全株均可入药,枝叶补脾和胃,能治疗肚腹胀满和消化不良,果能滋阴养肝明目,全株亦可作茶饮,具有助消化提精神的养生功效[2,3,4]。但国内有关该变种药学与化学成分方面的研究和报道较少。为深入明确东北岩高兰中的活性成分,本实验对其进行了系统的次生代谢产物研究,从其全草95%乙醇提取物中分离鉴定了12个化合物,分别为3β-羟基-21-烯-岩高兰三萜(3β-hydroxy-nigrum-21-en,1)、4′-羟基-α,β-二氢查耳酮-2′-O-β-D-葡萄糖苷(4′-hydroxy-α,β-dihydrochalcone-2′-O-β-D-gluco- pyranoside,2)、5-(2-苯乙基)-间苯二酚-1-O-β-D-葡萄糖苷 [5-(2-phenylethyl)-3-hydroxyphenol-1-O- β-D-glucopyranoside,3]、2′,4′-二羟基查耳酮(2′,4′-dihydroxy-chalcone,4)、2′-甲氧基-4′-羟基-α,β-二氢查耳酮(2′-methoxy-4′-hydroxy-α,β-dihydro- chalcone,5)、苯丙酸(phenylpropionic acid,6)、肉桂醇(cinnamyl alcohol,7)、槲皮素(quercetin,8)、(−)-表儿茶素 [(−)-epicatechin,9]、槲皮素-3-O- α-L-阿拉伯糖苷(quercetin-3-O-α-L-arabinoside,10)、金丝桃苷(hyperoside,11)、8-甲氧基槲皮素- 3-葡萄糖苷(8-methoxyquercetin-3-glucoside,12)。经SciFinder数据库查询,发现化合物1为1个新的三萜,化合物2为1个新的二氢查耳酮,分别命名为3β-羟基-21-烯-岩高兰三萜(3β-hydroxy-nigrum- 21-en)和4′-羟基-α,β-二氢查耳酮-2′-O-β-D-葡萄糖苷(4′-hydroxy-α,β-dihydroc halcone-2′-O-β-D-gluco- pyranoside)。化合物3、4、6~12为首次从岩高兰属植物中分离得到。
1 仪器与材料JASCO P—1020型数字式旋光仪(大连华洋科学仪器有限公司);Shimadzu UV—2401PC 型紫外光谱仪(日本岛津公司);Tensor 27型红外光谱仪KBr压片(德国布鲁克公司);VG Auto Spec 3000(英国VG公司)及Finnigan MAT 90质谱仪(德国Finnigan公司);Bruker AM—400和DRX—500核磁共振光谱仪(德国布鲁克公司)。半制备HPLC用Agilent 1200 HPLC完成,色谱柱为Zorbax SB-C18(Agilent,250 mm×9.4 mm,5 μm,3 mL/min),检测器为多波长检测器;柱色谱硅胶(200~300目)和薄层色谱硅胶GF254均为青岛海洋集团有限公司生产;MCI填充材料为MCI-gel CHP-20P;Sephadex LH-20为GE healthcare生产。
东北岩高兰全草(包括根、茎和叶)于2011年8月采自大兴安岭北部高山林带,由中国科学院昆明植物研究所何俊博士鉴定为东北岩高兰Empetrum nigrum L. var. japonicum K. Koch,标本(KIB-2011-P-457)保存于昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室。
2 提取与分离干燥的东北岩高兰全草8 kg,粉碎,用95%乙醇室温提取48 h,再在80 ℃下回流提取2次,每次3 h,回收溶剂得乙醇浸膏,该浸膏用80%丙酮冷提48 h后旋转蒸干得丙酮浸膏,再依次用石油醚、氯仿和正丁醇萃取,回收溶剂分别得到各萃取物64、87、138 g。
石油醚萃取物经硅胶柱色谱,石油醚-醋酸乙酯(50∶1、30∶1、15∶1、10∶1、1∶1)梯度洗脱得到7个流分(Fr. A~G)。Fr. C和Fr. E析出结晶,析出结晶反复经丙酮重结晶得到化合物1(500 mg),Fr. F和Fr. G经过硅胶柱色谱,石油醚-醋酸乙酯(10∶1→1∶1)梯度洗脱,再经凝胶Sephadex LH-20色谱(流动相为纯甲醇),经反复硅胶柱色谱得到化合物5(200 mg)。氯仿萃取物析出沉淀,经反复甲醇重结晶得化合物4(425 mg),剩余样品经硅胶柱色谱,氯仿-甲醇(99∶1、98∶2、10∶1、1∶1)梯度洗脱得到5个流分(Fr. H~L)。Fr. J(19 g)经硅胶柱色谱,石油醚-醋酸乙酯(30∶1、20∶1、15∶1)梯度洗脱得流分Fr. J1~J6;Fr. J6经反复硅胶柱色谱,石油醚-醋酸乙酯洗脱,得到化合物6(50 mg)和7(75 mg)。正丁醇部位经硅胶柱色谱,水饱和氯仿-甲醇(99∶1、95∶5、93∶7、90∶10、80∶20、70∶30、1∶1)梯度洗脱,得到流分Fr. M~P。Fr. N经MCI(甲醇-水2∶8、3∶7、4∶6、6∶4、8∶2、10∶0),以及凝胶Sephadex LH-20(流动相为纯甲醇)、硅胶柱色谱(氯仿-甲醇10∶1)分离纯化,得到化合物2(200 mg),剩余样品通过半制备HPLC(甲醇-水65∶35)得到化合物3(7 mg)、8(222 mg)、9(220 mg)和10(15 mg)。Fr. O经MCI(甲醇-水2∶8、3∶7、4∶6、5∶5、6∶4、8∶2、10∶0)、硅胶柱色谱(氯仿-甲醇10∶1、8∶1,加2滴水)得到化合物11(1.77 g)和12(7 mg)。
3 结构鉴定化合物1:白色粉末,15%硫酸乙醇溶液显粉色。mp 113~114 ℃。[α]20D −7.6° (c 0.12,CHCl3)。IR光谱给出羟基 (3 442 cm−1) 特征吸收峰。EI-MS显示分子离子峰m/z: 428 [M]+,结合HR-EI-MS m/z: 428.400 9 [M]+(计算值428.401 8)可以确定化合物1的分子式为C30H52O。在1H-NMR谱(表 1)中显示出6个单峰甲基δH0.79,1.01,1.02,1.04,1.60和1.69,以及2个双峰甲基δH 0.88 (3H,d,J = 6.4 Hz) 和0.93 (3H,d,J = 7.1 Hz)。1H-NMR谱(表 1)中还显示出1个烯氢质子δH 5.09 (1H,t,J = 7.2 Hz),提示分子中存在1个三取代的双键。1H-NMR谱图还显示出1个次甲基或羟基单峰质子位于δH3.75 (1H,brs)。其余信号全部位于高场δH1.00~2.02,提示这些质子为亚甲基或次甲基的信号。13C-NMR和DEPT谱图(表 1)显示该分子含有30个碳,分别为8个甲基、10个亚甲基、7个次甲基(包括1个低场次甲基位于δC 73.1,1个双键次甲基位于δC125.4),还有5个季碳。13C-NMR结合1H-NMR数据提示该化合物为1个氧化度较低的三萜化合物。与岩高兰E. nigrum L. 中已分离得到的三萜化合物nigrum-21-en-3-one[5]的NMR数据比较,结构非常相似。2个化合物主要的区别在于,nigrum-21-en-3- one中的1个羰基 (δC 212.9) 在化合物1中被替换为1个含氧次甲基 (δC 73.1),提示C-3在化合物1中被羟基取代。从化合物1的HMBC谱(表 1)中发现,δH 3.75与C-1,2,4,5和23-Me都有相关,表明这个次甲基质子为H-3。化合物1的ROESY谱图数据(表 1)和nigrum-21-en-3-one也非常相似,说明化合物1中手性碳的立体化学仍未改变。化合物1的ROESY谱中显示23-Me与24-Me,H-8与25-Me和27-Me的相关点,表明这些质子为相同取向(β构型)。此外,也观察到H-17与26-Me和28-Me的ROESY相关,由此也确定了这些质子均为α-构型。化合物1的ROESY谱图中还显示H-3与H-4和H-10的相关,表明H-3质子为α构型。因此,化合物1的结构被最终确定(图 1),并命名为3β-羟基-21-烯-岩高兰三萜。
| 表 1 化合物1的1H/13C-NMR (400/100 MHz,CDCl3) 数据及HMBC、ROESY相关 Table 1 1H-NMR and 13C-NMR (400/100 MHz,CDCl3) data,HMBC and ROESY correlations of compound 1 |
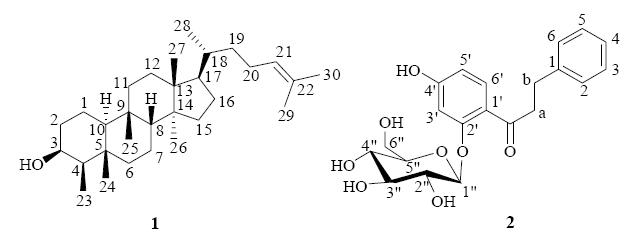 | 图 1 化合物1和2的结构Fig. 1 Chemical structures of compounds 1 and 2 |
化合物2:白色粉末。mp 90~91 ℃;[α]20D −66.9° (c 0.10,MeOH)。IR光谱显示羟基 (3 439 cm−1) 和羰基 (1 648 cm−1) 特征吸收峰。HR-EI-MS m/z: 404.149 7 [M]+ (计算值404.147 1),给出其分子式为C21H24O8。在1H-NMR谱图(表 2)中的芳氢质子δH7.2 2~7.23 (4H,overlapped) 和7.13 (1H,m) 显示分子中存在1个单取代的苯环,而芳氢质子δH 6.50 (1H,dd,J = 8.7,2.2 Hz),6.70 (1H,d,J = 2.2 Hz) 和7.60 (1H,d,J = 8.7 Hz) 推测分子中含有1个ABX三取代的苯环。在1H-NMR谱图(表 2)中还存在1组吡喃葡萄糖基质子信号 (δH 3.40~5.01),以及2个亚甲基质子信号 (δH 3.38和2.96)。结合13C-NMR谱图,推测化合物2为吡喃葡萄糖取代的二氢查耳酮。化合物2的HSQC谱图将氢谱质子信号与碳谱碳信号相连接起来。根据化合物2的1H-1H COSY谱图中5个稀氢质子之间的相关,推测结构中存在1个单取代的苯环;而H-1′′~6′′的1H-1H COSY相关,推测化合物2的结构中存在1个吡喃葡萄糖基。上述谱图数据结合HMBC谱图数据进一步证实化合物2为吡喃葡萄糖取代的二氢查耳酮。化合物2的HMBC谱图中,δH 6.70 (1H,d,J = 2.2 Hz) 与δC 121.6 (C-1′),160.2 (C-2′),164.3 (C-4′),110.9 (C-5′) 和羰基碳 (δC 202.6) 相关,表明C-2′和4′被氧化。而糖端基质子信号δH 5.01 (1H,d,J = 7.1 Hz,H-1″) 与δC 160.2 (C-2′) 相关,说明吡喃葡萄糖基连接在C-2′位。因此最终确定了化合物2的结构,见图 1,并命名为4′-羟基-α,β-二氢查耳酮-2′-O-β-D-葡萄糖苷。
| 表 2 化合物2的1H/13C-NMR (500/125 MHz,CD3OD) 数据和HMBC相关 Table 2 1H-NMR and13C-NMR (500/125 MHz,CD3OD) data and HMBC correlations of compound 2 |
化合物3:白色粉末。1H-NMR (500 MHz,CD3OD) δ: 7.19 (2H,m,H-5′,7′),7.12 (2H,m,H-4′,8′),7.10 (1H,m,H-6′),6.37 (1H,d,J = 1.2 Hz,H-6),6.33 (1H,t,J = 1.4 Hz,H-2),6.25 (1H,s,H-4),4.73 (1H,d,J = 7.1 Hz,H-1″),3.85 (1H,d,J = 11.9 Hz,H-6″a),3.66 (1H,dd,J = 11.9,4.1 Hz,H-6″b),3.39 (1H,m,H-3″),3.38 (1H,m,H-2″),3.36 (1H,m,H-5″),3.34 (1H,m,H-4″),2.81 (2H,t,J = 7.3 Hz,H-2′),2.74 (2H,t,J = 7.0 Hz,H-1′);13C-NMR (100 MHz,CD3OD) δ: 160.1 (C-1),159.3 (C-3),145.4 (C-5),143.1 (C-3′),129.5 (C-4′,8′),129.3 (C-5′,7′),126.9 (C-6′),110.7 (C-4),109.1 (C-6),102.6 (C-2),102.2 (C-1″),78.1 (C-5″),77.9 (C-3″),74.9 (C-2″),71.3 (C-4″),62.5 (C-6″),39.2 (C-1′),38.8 (C-2′)。以上数据与文献报道一致[6],故鉴定化合物3为5-(2-苯乙基)-间苯二酚-1-O-β-D-葡萄糖苷。
化合物4:黄色块晶(甲醇)。1H-NMR (500 MHz,DMSO-d6) δ: 13.40 (1H,s,2′-OH),10.79 (1H,s,4′-OH),8.20 (1H,d,J = 8.9 Hz,H-6′),7.98 (1H,d,J = 15.5 Hz,H-β),7.88 (2H,m,H-3,5),7.80 (1H,d,J = 15.5 Hz,H-α),7.44 (3H,m,H-2,4,6),6.43 (1H,dd,J = 8.8,1.8 Hz,H-5′),6.30 (1H,d,J = 1.8 Hz,H-3′);13C-NMR (125 MHz,DMSO-d6) δ: 191.5 (C=O),165.8 (C-2′),165.2 (C-4′),143.6 (C-β),134.6 (C-1),133.1 (C-6′),130.6 (C-4),128.9 (C-2,6),128.8 (C-3,5),121.3 (C-α),113.0 (C-1′),108.3 (C-5′),102.6 (C-3′)。以上数据与文献报道一致[7],故鉴定化合物4为2′,4′-二羟基查耳酮。
化合物5:黄色针晶(甲醇)。1H-NMR (500 MHz,CDCl3) δ: 7.73 (1H,d,J = 8.2 Hz,H-6′),6.49 (1H,d,J = 2.0 Hz,H-3′),6.47 (1H,dd,J = 8.2,2.0 Hz,H-5′),7.24~7.25 (5H,overlapped,H-2~6),3.45 (3H,s,-OCH3),3.41 (2H,t,J = 7.5 Hz,H-α),2.89 (2H,t,J = 7.3 Hz,H-β);13C-NMR (100 MHz,CDCl3) δ: 201.0 (C=O),162.2 (C-2′),161.5 (C-4′),141.6 (C-1),133.0 (C-6′),128.4 (C-2,6),128.3 (C-3,5),125.9 (C-4),119.9 (C-1′),108.1 (C-5′),99.1 (C-3′),55.4 (-OCH3),45.1 (C-β),30.8 (C-α)。以上数据与文献报道一致[8],故鉴定化合物5为2′-甲氧基-4′-羟基-α,β-二氢查耳酮。
化合物6:白色蜡状物。1H-NMR (400 MHz,CDCl3) δ: 7.30 (2H,m,H-2′,6′),7.22 (3H,m,H-3′~5′),2.97 (2H,t,J = 7.8 Hz,H-2),2.69 (2H,t,J = 7.8 Hz,H-3);13C-NMR (100 MHz,CDCl3) δ: 178.2 (C-1),140.3 (C-1′),128.4 (C-3′,5′),128.3 (C-2′,6′),126.3 (C-4′),35.6 (C-2),30.6 (C-3)。以上数据与文献报道一致[9],故鉴定化合物6为苯丙酸。
化合物7:无色油状物。1H-NMR (400 MHz,CDCl3) δ: 7.39 (2H,d,J = 7.3 Hz,H-3′,5′),7.32 (2H,t,J = 7.5 Hz,H-2′,6′),7.26 (1H,t,J = 7.4 Hz,H-4′),6.64 (1H,d,J = 15.9 Hz,H-3),6.37 (1H,dt,J = 15.9,4.6 Hz,H-2),4.33 (2H,d,J = 4.6 Hz,H-1);13C-NMR (100 MHz,CDCl3) δ: 136.6 (C-1′),130.1 (C-3′,5′),129.2 (C-4′),127.7 (C-2′,6′),131.2 (C-3),128.5 (C-2),63.6 (C-1)。以上数据与文献报道一致[10],故鉴定化合物7为肉桂醇。
化合物8:黄色粉末。1H-NMR (500 MHz,CD3OD) δ: 7.72 (1H,s,H-2′),7.62 (1H,d,J = 7.9 Hz,H-6′),6.87 (1H,d,J = 8.2 Hz,H-5′),6.36 (1H,s,H-8),6.18 (1H,s,H-6);13C-NMR (100 MHz,CD3OD) δ: 177.0 (C-4),165.0 (C-7),162.0 (C-5),157.9 (C-9),148.3 (C-4′),147.7 (C-2),145.8 (C-3′),137.0 (C-3),123.9 (C-1′),121.6 (C-6′),116.0 (C-5′),115.8 (C-2′),104.4 (C-10),99.1 (C-6),94.4 (C-8)。以上数据与文献报道一致[11],故鉴定化合物8为槲皮素。
化合物9:无色固体。1H-NMR (400 MHz,CD3OD) δ: 4.78 (1H,brs,H-2),4.15 (1H,brs,H-3),2.73 (1H,dd,J = 16.7,2.8 Hz,H-4a),2.87 (1H,dd,J = 16.7,4.3 Hz,H-4b),5.95 (1H,d,J = 2.0 Hz,H-6),5.90 (1H,d,J = 2.0 Hz,H-8),6.99 (1H,s,H-2′),6.78 (1H,d,J = 7.9 Hz,H-5′),6.82 (1H,d,J = 7.9 Hz,H-6′);13C-NMR (100 MHz,CD3OD) δ: 157.8 (C-7),157.3 (C-5),157.2 (C-9),145.7 (C-3′),145.5 (C-4′),132.1 (C-1′),119.4 (C-6′),115.9 (C-5′),115.2 (C-2′),100.0 (C-10),96.3 (C-8),95.8 (C-6),79.6 (C-2),67.3 (C-3),29.1 (C-4)。以上数据与文献报道一致[12],故鉴定化合物9为 (−)-表儿茶素。
化合物10:黄色粉末。1H-NMR (400 MHz,CD3OD) δ: 7.75 (1H,d,J = 1.6 Hz,H-2′),7.55 (1H,dd,J = 8.4,1.6 Hz,H-6′),6.87 (1H,d,J = 8.4 Hz,H-5′),6.37 (1H,d,J = 1.5 Hz,H-8),6.18 (1H,d,J = 1.5 Hz,H-6),5.16 (1H,d,J = 6.6 Hz,H-1″);13C-NMR (100 MHz,CD3OD) δ: 179.5 (C-4),166.1 (C-7),161.4 (C-5),158.7 (C-9),158.4 (C-2),150.0 (C-4′),146.0 (C-3′),135.7 (C-3),123.1 (C-6′),122.9 (C-1′),117.5 (C-5′),116.2 (C-2′),105.6 (C-1″),104.7 (C-10),100.0 (C-6),94.8 (C-8),74.2 (C-3″),72.9 (C-2″),68.6 (C-4″),67.0 (C-5″)。以上数据与文献报道一致[13],故鉴定化合物10为槲皮素-3-O-α-L-阿拉伯糖苷。
化合物11:黄色粉末。1H-NMR (400 MHz,DMSO-d6) δ: 7.64 (1H,d,J = 8.4 Hz,H-6′),7.51 (1H,s,H-2′),6.81 (1H,d,J = 8.4 Hz,H-5′),6.39 (1H,s,H-8),6.18 (1H,s,H-6),5.36 (1H,d,J = 7.6 Hz,H-1″),3.14~3.63 (6H,m,H-2″~6″);13C-NMR (100 MHz,DMSO-d6) δ: 177.5 (C-4),164.2 (C-7),161.3 (C-5),156.3 (C-9),156.2 (C-2),148.5 (C-4′),144.9 (C-3′),133.5 (C-3),122.0 (C-6′),121.1 (C-1′),116.0 (C-2′),115.2 (C-5′),104.1 (C-10),103.9 (C-1″),98.7 (C-6),93.6 (C-8),75.9 (C-5″),73.2 (C-3″),71.2 (C-2″),68.0 (C-4″),60.2 (C-6″)。以上数据与文献报道一致[14],故鉴定化合物11为金丝桃苷。
化合物12:黄色粉末。1H-NMR (400 MHz,CD3OD) δ: 7.79 (1H,s,H-2′),7.67 (1H,d,J = 8.0 Hz,H-6′),6.89 (1H,d,J = 8.4 Hz,H-5′),6.26 (1H,s,H-6),3.90 (3H,s,-OCH3),5.28 (1H,m,Glc-H-1′′),3.23~3.90 (6H,m,Glc-H-2″~6″);13C-NMR (100 MHz,CD3OD) δ: 179.7 (C-4),158.6 (C-7),157.9 (C-2),156.6 (C-5),150.1 (C-4′),149.5 (C-9),145.9 (C-3′),135.7 (C-3),129.1 (C-8),123.0 (C-6′),122.9 (C-1′),117.7 (C-5′),116.1 (C-2′),105.6 (C-1″),105.3 (C-10),100.1 (C-6),77.3 (C-5″),77.2 (C-3″),75.1 (C-2″),70.0 (C-4″),62.0 (-OCH3),61.9 (C-6″)。以上数据与文献报道一致[15],故鉴定化合物12为8-甲氧基槲皮素-3-葡萄糖苷。
| [1] | 任玉昌, 张桂表. 我国珍稀植物——东北岩高兰[J]. 中国野生植物, 1991(1): 32-33. |
| [2] | 陈辉. 东北岩高兰的分布及保护利用价值[J]. 内蒙古林业调查设计, 2011, 34(6): 119-121. |
| [3] | 李瑞明, 王振月, 康毅华, 等. 岩高兰生药学研究[J]. 中南药学, 2005, 3(3): 175-177. |
| [4] | 满志宏, 杨玉新, 张春雨. 黑龙江省东北岩高兰现状及开发利用[J]. 黑龙江科技信息, 2007(1): 122. |
| [5] | Toiron C, Rumbero A, Wollenweber E, et al. A new skeletal triterpenoid isolated from Empetrum nigrum[J]. Tetrahedron Lett, 1995, 36(36): 6559-6562. |
| [6] | Tang W, Lu W, Cao X, et al. Two new dihydrostilbenoid glycosides isolated from the leaves of Litsea coreana and their anti-inflammatory activity[J]. Nat Prod Commun, 2013, 8(4): 479-480. |
| [7] | 杨欢, 王栋, 童丽, 等. 镰形棘豆的化学成分研究 (I)[J]. 中国药学杂志, 2008, 43(5): 338-340. |
| [8] | Krasnov E, Ermilova E, Kadyrova T, et al. Phenolic components of Empetrum nigrum extract and the crystal structure of one of them[J]. Chem Nat Comp, 2000, 36(5): 493-496. |
| [9] | 吴霞, 于志斌, 叶蕴华, 等. 荜茇化学成分的研究 (I)[J]. 中草药, 2008, 39(2): 178-180. |
| [10] | 于建婷, 林均明, 邹晓楠, 等. 海洋生物卤虫卵化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2012, 29(5): 248-351. |
| [11] | Boligon A A, Feltrin A C, Machado M M, et al. HPLC analysis and phytoconstituents isolated from ethyl acetate fraction of Scutia buxifolia Reiss. leaves[J]. Lat Am J Pharm, 2009, 28(1): 121-124. |
| [12] | Lopes L, Marques R, Pereira S, et al. Antinociceptive effect on mice of the hydroalcoholic fraction and (-) epicatechin obtained from Combretum leprosum Mart & Eich[J]. Braz J Med Biol Res, 2010, 43(12): 1184-1192. |
| [13] | 李路军, 杜鹏, 张鹏, 等. 榕叶冬青叶的化学成分研究[J]. 中草药, 2013, 44(5): 519-523. |
| [14] | 马俊利, 李金双. 金银忍冬叶的化学成分研究[J]. 现代药物与临床, 2013, 28(4): 476-479. |
| [15] | Wu T S, Furukawa H. Flavonol glycosides from Humata pectinata[J]. Phytochemistry, 1983, 22(4): 1061-1062. |
 2014, Vol. 45
2014, Vol. 45


