2. 南方医科大学中医药学院, 广东 广州 510515;
3. 广州军区广州总医院 药剂科, 广东 广州 510010
2. School of Traditional Chinese Medicine, Southern Medical University, Guangzhou 510515, China;
3. Department of Pharmacy, Guangzhou General Hospital of Guangzhou Military Command, Guangzhou 510010, China
肿瘤是危害人类的重大疾病之一,近年来,运用中药治疗肿瘤是目前国内外研究的热点[1]。氧化苦参碱(oxymatrine)是苦参的有效成分,属于四环喹诺里西啶类(quinolizidine)生物碱[2],药理和临床研究发现,氧化苦参碱具有抗炎、抗病毒、抗纤维化、免疫调节等多种药理作用[3],并且其抗肿瘤的作用越来越得到重视[4]。本研究针对氧化苦参碱对人结肠癌细胞株SW620增殖、细胞周期及p16/cyclinD1/CDK4通路调节方面的影响,探讨其对大肠癌可能的作用机制。
1 材料和方法 1.1 材料人结肠腺癌细胞株SW620为南方医科大学中医药学院药理实验室所存。氧化苦参碱(质量分数≥98%)由宁夏盐池县医药公司提供,批号080630;5-氟尿嘧啶(5-Fu)注射液由上海旭东海普药业生产,批号100108。新生胎牛血清购自杭州四季青公司;0.25% Trypsin、RPMI 1640培养基购于吉诺公司;噻唑蓝(MTT)购于Sigma公司;二甲基亚砜(DMSO)购于A1Tlresco公司。细胞周期检测试剂盒购于碧云天公司;兔抗p16、cyclinD1、CDK4及β-actin一抗与兔二抗均购自美国Sigma公司。
1.2 细胞培养SW620细胞用含10%胎牛血清的RPMI 1640培养基,于37 ℃、5 %CO2孵箱中培养,待细胞生长到80%~90%,弃除培养液,PBS轻轻洗涤细胞2、3次,用0.25%胰酶消化3~5 min,终止消化后,RPMI 1640培养液重悬细胞,并按1∶3的比例进行传代,分别接种至表面积为25 cm2的培养瓶中,移入37 ℃、5%CO2孵箱中培养[5]。
1.3 MTT法检测SW620细胞增殖调整细胞悬液浓度至2×105/mL,取100 μL的细胞悬液接种于96孔培养板中,37 ℃、5%CO2培养箱孵育,培养至细胞贴壁单层铺满孔底。对照组加入同样量的培养液200 μL,阳性对照组加入终质量浓度为4 mg/L的5-Fu,氧化苦参碱设1、2、4、8、16、32 μmol/L 6个浓度,每组设3个重复孔,药物分别作用24、48、72 h后,每孔加20 μL(5 mg/mL)MTT,培养4 h后,弃去培养基,加150 mL的DMSO溶液,轻轻振荡约10 min后,酶标仪490 nm测吸光度(A)值,计算细胞增殖率。
细胞增殖率=A实验组 / A对照组
1.4 Hoechst33258光镜观察SW620细胞核形态对数生长期的细胞消化成单细胞悬液,以5×105/mL浓度接种于装有消毒玻片的培养皿中,培养24 h后,更换培养基。实验组加入氧化苦参碱2、4、8 μmol/L,另设对照组。作用24 h后收集细胞爬片,固定后Hoechst33258染色,荧光显微镜下观察细胞核形态。
1.5 流式细胞仪分析SW620细胞周期细胞处理、分组同“1.4”项。收集培养24 h的所有细胞,1 000 r/min离心5 min,弃上清液,PBS洗2次,1 200 r/min离心5 min,吸尽上清液,加入70%乙醇(4 ℃预冷)固定,碘化丙啶(PI)染色30 min。进行流式细胞仪分析,并用MUTCYCLE软件分析细胞周期分布情况。
1.6 荧光实时定量PCR检测基因水平细胞处理分组同“1.4”项。RNA提取与纯化:在细胞沉淀中加入Trizol试剂1 mL,充分振荡混匀,室温放置5 min,加入氯仿0.2 mL,盖紧盖子,用振荡器振荡15 s,室温孵育2~3 min,4 ℃、12 000 r/min离心15 min,取上清液至新的1.5 mL Eppendorf管中。加与上清液等体积的异丙醇,轻轻混匀,-20 ℃孵育样品20~30 min,4 ℃、12 000 r/min离心10 min,弃上清液,75%乙醇(含DEPC水)800 μL洗涤沉淀1次,4 ℃、7 500 r/min 离心5 min,弃乙醇。空气或真空干燥5~10 min(不要完全干燥),加DEPC处理水20~50 μL溶解RNA,-80 ℃保存备用。若长期保存,加入2.5倍体积乙醇,置-80 ℃保存。逆转录反应:取4 μL RNA模板进行逆转录反应,仪器为BIO-RAD定性PCR仪(美国),反应体系按逆转录试剂盒说明书进行。荧光定量PCR反应条件:93 ℃、2 min,93 ℃、15 s,55 ℃、25 s,72 ℃、25 s,共40个循环。PCR引物由上海英俊公司设计合成,具体序列见表 1。
|
|
表 1 荧光定量PCR反应引物序列 Table 1 Primer sequence of quantitation RT-PCR by fluorescent |
细胞处理分组同“1.4”项。细胞以5×109/L接种至6孔板,按照实验分组进行相应处理后,提取细胞总蛋白,以双辛丁酸(BCA)法进行蛋白定量检测。按每个样品25 μL上样后进行电泳分离蛋白质。电泳结束后,采用半干转法将蛋白质转移至聚偏氟乙烯(PVDF)膜上,脱脂奶粉室温封闭l h后,将一抗与膜4 ℃孵育过夜(抗p16、CyclinD1及CDK4,体积分数为1∶1 000),二抗以1∶10 000室温孵育2~3 h,化学发光法显色成像,分析条带灰度值,检测p16、CyclinD1、CDK4蛋白表达水平。
1.8 统计学方法
应用SPSS l3.0软件包进行,多组比较采用One-way ANOVA分析,两组间比较采用t检验,数据均以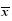 ±s表示。
±s表示。
不同浓度的氧化苦参碱作用于SW620细胞不同时间后对细胞增殖的影响结果见表 2。结果表明氧化苦参碱能显著抑制SW620细胞的增殖,与对照组比较,给药组细胞增殖率显著降低(P<0.05),并有明显的剂量效应关系,其作用24 h的IC50值为4.02 μmol/L。与5-Fu组比较,氧化苦参碱在浓度为8~32 μmol/L时,对SW620增殖抑制率显著提高(P<0.05)。
|
|
表 2 氧化苦参碱对SW620细胞增殖的影响 (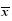 ±s,n=3)
Table 2 Effect of oxymatrine on proliferation of SW620 cells ( ±s,n=3)
Table 2 Effect of oxymatrine on proliferation of SW620 cells (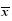 ±s,n=3) ±s,n=3)
|
氧化苦参碱作用SW620细胞24 h后,细胞经Hoechst33258染色,荧光显微镜下观察可见SW620细胞核形态出现了明显的改变,见图 1,与对照组比较,药物处理后,细胞皱缩,染色质浓缩边集,形成新月形细胞核。对照组无明显凋亡细胞。随着氧化苦参碱作用浓度增加,细胞核皱缩更明显。
 | 图 1 氧化苦参碱对SW620细胞形态的影响 (Hoechst33258染色) Fig. 1 Effectof oxymatrine on morphology of SW620 cells (Hoechst33258 staining) |
氧化苦参碱2、4、8 μmol/L作用SW620细胞24 h后,与对照组比较,细胞在G1期的比例明显增加(P<0.05、0.01),S期的比例显著降低(P<0.05、0.01),见表 3。
|
|
表 3 苦参碱对SW620细胞周期的影响 (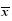 ±s,n=3)
Table 3 Effect of oxymatrine on cell cycle of SW620 cells ( ±s,n=3)
Table 3 Effect of oxymatrine on cell cycle of SW620 cells (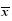 ±s,n=3) ±s,n=3)
|
RT-PCR结果显示,p16(INK4A)基因在氧化苦参碱组中表达明显升高,与对照组比较差异显著(P<0.01),氧化苦参碱8 μmol/L组p16 mRNA表达水平最高;氧化苦参碱组cyclinD1和CDK4 mRNA的表达均下降,与对照组比较差异显著(P<0.05、0.01),氧化苦参碱8 μmol/L组cyclinD1和CDK4 mRNA水平与对照组比较下降最为显著(P<0.01),见图 2。
 | 图 2 氧化苦参碱对SW620细胞p16、cyclinD1、CDK4 mRNA表达的影响 (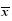 ±s,n=3)
Fig. 2 Effect of oxymatrine on mRNA expression of p16,cyclinD1,and CDK4 in SW620 cells ( ±s,n=3)
Fig. 2 Effect of oxymatrine on mRNA expression of p16,cyclinD1,and CDK4 in SW620 cells (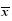 ±s,n=3) ±s,n=3)
|
免疫印迹法结果(图 3和表 4)显示,与对照组比较,氧化苦参碱可明显提高SW620细胞内p16蛋白表达水平(P<0.05、0.01),氧化苦参碱8 μmol/L组p16蛋白表达水平最高(P<0.01);与对照组比较,氧化苦参碱组CyclinD1和CDK4蛋白表达水平均下降(P<0.05、0.01),氧化苦参碱4 μmol/L组CyclinD1和CDK4蛋白水平下降最为显著(P<0.01)。
 | 图 3 氧化苦参碱对SW620细胞p16、CyclinD1、CDK4蛋白表达的影响 Fig. 3 Effect of oxymatrine on protein expression of p16,cyclinD1,and CDK4 in SW620 cells |
|
|
表 4 各组细胞内p16、CyclinD1及CDK4蛋白表达相对量 (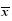 ±s,n=3)
Table 4 Relative quantity of protein expression of p16,cyclinD1,and CDK4 in SW620 cells ( ±s,n=3)
Table 4 Relative quantity of protein expression of p16,cyclinD1,and CDK4 in SW620 cells (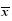 ±s,n=3) ±s,n=3)
|
大肠癌是全球发病率居第3位的常见肿瘤,近年来其发病率呈逐年上升趋势[2]。针对大肠癌的化疗方案主要是以5-Fu为主的综合化疗,但存在毒副反应大等缺陷。中药以其独特的抗肿瘤疗效、不良反应少等特点,已成为抗肿瘤研究的热点之一[6]。氧化苦参碱对SW620结肠癌细胞具有明显的诱导凋亡作用,是很有潜力的抗癌药物。体外实验表明氧化苦参碱对多种肿瘤细胞有抑制或杀伤作用,并能诱导细胞分化和凋亡[2,4]。本研究发现不同浓度氧化苦参碱(1~32 μmol/L)对结肠癌细胞SW620有不同程度的增殖抑制作用,并有一定的剂量效应关系。通过细胞形态学的观察,氧化苦参碱作用SW620细胞24 h后,可见细胞核固缩、核碎裂、细胞膜起泡等形态。
近年来的研究认为,肿瘤是一类细胞周期性疾病。细胞周期的调节因子中就包括多种癌基因和抑癌基因。在细胞增殖周期中,最主要的调控点是G1期与S期之间的调控点[5]。G1期与S期调控点受控于细胞周期蛋白(cyclins)和细胞周期蛋白依赖性激酶抑制因子(CKIs)对细胞周期蛋白依赖性激酶(CDKs)的正负调节作用,即正常细胞从G1期向S期的调控需要cyclinDl的正调控和p16的负调控来完成[7,8]。p16蛋白主要通过与CDK竞争性结合cyclinD,而阻碍其与Cyclin D形成复合物,cyclin D/CDK激酶失活,从而阻止细胞从G1期进入S期,细胞增殖受抑制[9,10]。本实验研究表明:流式细胞仪检测发现氧化苦参碱作用SW620 细胞24 h后,在2~8 mmol/L内,细胞的G1期比例逐渐升高,S期比例明显下降,存在G1/S阻滞[11]。通过以上研究结果推测氧化苦参碱主要是通过阻滞SW620细胞G1期向S期的进程,形成G1期阻滞,造成G1期细胞堆积阻滞并阻断细胞的DNA合成和复制,从而影响细胞周期进程,起到抑制肿瘤细胞增殖的作用。RT-PCR及免疫印迹法研究表明,与对照组比较,cyclinDl、CDK4蛋白及mRNA表达均下降。p16蛋白和mRNA表达明显增强。说明氧化苦参碱通过调控了G1期这些细胞周期正负调节因子表达发挥作用,最终抑制细胞周期进展,而导致肿瘤细胞凋亡。综上所述,氧化苦参碱诱导的SW620细胞凋亡,可能是通过使细胞阻滞G1期无法完成修复而发挥抗肿瘤作用,其分子机制可能与抑制p16/cyclinD1/CDK4通路有关。
| [1] | 周逢仓, 金 明. 肿瘤的分子诊断及其研究进展 [J]. 安徽卫生职业技术学院学报, 2003, 2(1): 54-56. |
| [2] | 申晓东, 宋关斌, 严润彬, 等. 苦参碱和氧化苦参碱抗肿瘤作用的研究进展 [J]. 重庆大学学报: 自然科学版, 2005, 28(6): 125-128. |
| [3] | 张鸣号, 王秀玉, 何沿虹, 等. 氧化苦参碱对感染性休克大鼠心肌组织细胞因子的影响 [J]. 中草药, 2012, 43(11): 2242-2246. |
| [4] | 朱晓伟, 宝金荣, 布 仁. 苦参碱和氧化苦参碱抗肿瘤作用机制研究进展 [J]. 化学试剂, 2010, 32(1): 32-36. |
| [5] | Tajitsu Y, Ikeda R, Nishizawa Y, et al. Molecular basis for the expression of major vault protein induced by hyperosmotic stress in SW620 human colon cancer cells [J]. Int J Mol Med, 2013, 32(3): 703-708. |
| [6] | Liang L, Wang X Y, Zhang X H, et al. Sophoridine exerts an anti-colorectal carcinoma effect through apoptosis induction in vitro and in vivo [J]. Life Sci, 2012, 91(25/26): 1295-1303. |
| [7] | Soto M J, Cabrera M C, Serrano O S, et al. Mutation and homozygous deletion analyses of genes that control the G1/S transition of the cell cycle in skin melanoma: p53, p21, p16 and p15 [J]. Clin Transl Oncol, 2005, 7(4): 156-164. |
| [8] | Kang Y K, Kim W H, Jang J J. Expression of G1-S modulators (p53, p16, p27, cyclin D1, Rb) and Smad4/Dpc4 in intrahepatic cholangiocarcinoma [J]. Hum Pathol, 2002, 33(9): 877-883. |
| [9] | Wang X Y, Wang Y G, Wang Y F. Ginsenoside Rb1, Rg1 and three extracts of traditional Chinese medicine attenuate ultraviolet B-induced G1 growth arrest in HaCaT cells and dermal fibroblasts involve down-regulating the expression of p16, p21 and p53 [J]. Photodermatol Photoimmunol Photomed, 2011, 27(4): 203-212. |
| [10] | Nakamura S, Nishioka K. Enhanced expression of p16 in seborrhoeic keratosis; a lesion of accumulated senescent epidermal cells in G1 arrest [J]. Br J Dermatol, 2003, 149(3): 560-565. |
| [11] | 何劲松, 赖焕辉, 姜立华, 等. p16、CyclinD1、Cdk4、Rb基因在胰腺癌中的表达及其意义 [J]. 癌症, 1999, 18(4): 418-421. |
 2014, Vol. 45
2014, Vol. 45


